विभागीय शुद्धीकरण : विशेषतः मूलद्रव्य व संयुग यांतील अशुद्धी (मलद्रव्ये) काढून टाकून अतिशुद्ध द्रव्य मिळविण्यासाठी अथवा त्यांचे संघटन नियंत्रित करण्यासाठी वापरण्यात येणारे तंत्र वा प्रक्रिया. यात घनरूप द्रव्यांच्या नमुन्यामधील सापेक्षतः कमी लांबीचा पट्टा म्हणजे ‘विभाग’ वितळविला जाऊन द्रवरूप होतो. असा द्रवरूप विभाग मग नमुन्याच्या एका टोकाकडे सावकाशपणे स्थानांतरित होत जातो. यामुळे अशुद्धी एका टोकाकडे एकवटल्या जाऊन उरलेला नमुना शुद्ध होतो. धातू, मिश्रधातू, आंतरधातवीय संयुगे. अर्धसंवाहक (ज्यांची विद्युत् संवाहकता धातू व निरोधक यांच्या दरम्यानची असते असे पदार्थ), कार्बनी व अकार्बनी संयुगे इ. असंख्य द्रव्ये या तंत्राने अतिशुद्ध करतात. इलेक्ट्रॉनीय उद्योग व मूलभूत वैज्ञानिक संशोधन यांत अशी द्रव्ये मुख्यतः वापरतात.
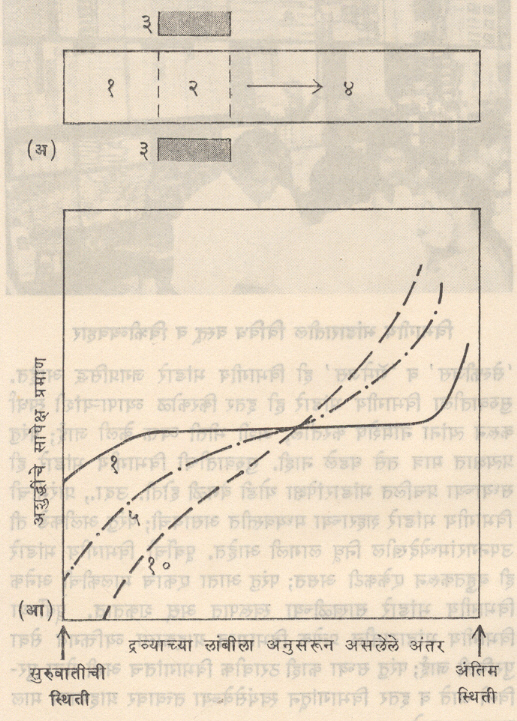
अशुद्धींमुळे द्रव्याचा वितळबिंदू वाढतो किंवा कमी होतो. जेव्हा एखादे द्रव्य द्रव व घन या दोन्ही अवस्थांमध्ये समतोलावस्थेत असते तेव्हा या दोन अवस्थांमध्ये अशुद्धी भिन्न प्रमाणात विरघळतात. अशा प्रकारे निर्माण होणाऱ्या संघटनांतील या फलकावर विभागीय शुद्धीकरणाचे कार्य चालते. या फरकामुळे अशुद्धी विभक्तीकरण (वेगळे होऊन एकत्र जमण्याची क्रिया) किंवा फेरवाटप शक्य होते. कारण अशुद्धी द्रवरूप विभागात रहातात. हा विभाग स्थानांतरित होताना त्या एका टोकाकडे नेल्या जाऊन उरलेला नमुना शुद्ध होतो. ही प्रक्रिया पुनःपुन्हा केल्यास अशुद्धींचे प्रमाण कमी होत जाऊन अतिशुद्ध द्रव्य मिळते (पहा आकृती). अशा द्रव्यात १० अब्ज भागांमध्ये केवळ १ भाग अशुद्धी असू शकते (म्हणजे १ वाघीणीवर साखरेत १ कण अशुद्धी असण्यासारखे हे आहे). अशा तऱ्हेने अशुद्धींचे फेरवाटप होताना द्रव्याचे संघटन नियंत्रितही करता येते. अशुद्धींमुळे मूळच्या द्रव्याचा वितळबिंदू कमी होतो की वाढतो त्यानुसार अशुद्धी एकवटण्याचे टोक निश्चित होते. अशुद्धींमुळे वितळबिंदू कमी होणारी द्रव्ये अधिक आहेत. अशा द्रव्यांच्या बाबतीत द्रवरूप विभाग ज्या दिशेने नेला जातो त्याच दिशेत अशुद्धी पुढे पुढे जातात. अशा प्रकारे अशुद्धी ज्या टोकाला एकवटल्या आहेत असे धातच्या कांबीचे टोक कापून टाकल्यास उरलेली कांब अतिशुद्ध असते.
विभागीय शुद्धीकरणाचा शोध बेल सिरॅमिक लॅबोरेटरीजमध्ये लागला. तेथे डब्ल्यू. जी. प्फॉन या अमेरिकन शास्त्रज्ञांनी याचे प्रथम वर्णन केले होते. १९५२ साली त्यांनी ट्रँझिस्टरसाठी लागणारे अतिशुद्ध जर्मेनियम या प्रक्रियेने बनविले होते. यामुळेच ट्रँझिस्टर तंत्रविद्येचा झपाट्याने जगभर प्रसार होऊ शकला [⟶ट्रॅझिस्टर तंत्रविद्या]. भागशः किंवा आंशिक स्फटिकीभवनाद्वारे असे अतिशुद्ध स्फटिक वितळविता येणे शक्य नव्हते. कारण धारकपात्र व विक्रियाकारक द्रव्ये यांमुळे संदूषण होऊन शुद्धता कमी होत असे. यातूनच त्याचे सुधारित म्हणता येईल असे हे तंत्र पुढे आले. या दोन्ही तंत्रांत केवळ द्रव्य वितळविण्याच्या पद्धतीमध्येच फरक आहे. एक तृतीयांशापेक्षा अधिक मूलद्रव्ये तसेच शेकडो कार्बनी व अकार्बनी संयुगे या तंत्राने जास्तीत जास्त शुद्ध रूपात मिळविण्यात आली आहेत. यामुळे त्यांचे अंगभूत गुणमर्ध प्रथमच निश्चित करता आले.
विभागीय शुद्धीकरण व्यापारी तत्त्वावर वापरताना किमान वेळात व किमान खर्चात आवश्यक तेवढ्या शुद्धतेचे आवश्यक तेवढे द्रव्य तयार करणे, हा हेतू असतो. हे साध्य करण्यासाठी या प्रक्रियेतील बदलता येणारे घटक (म्हणजे प्रचल) पर्याप्त (इष्टतम) ठेवतात. द्रवरूप विभागाची लांबी व त्यांची संख्या, दोन विभागांतील अंतर, प्रक्रिया पुन्हा किती वेळा करावयाची ती संख्या आणि द्रवरूप विभागाची स्थानांतराची गती हे या प्रक्रियेतील बदलणारे घटक आहेत. प्रयोगाची परिस्थिती व द्रव्याचे भौतिक गुणधर्म यांनुसार द्रवरूप विभागाची लांबी ठरवावी लागते. द्रव व घन अवस्थांमध्ये काटेकोर विभाजक रेषा असणारा कमी लांबीचा विभाग इष्ट समजतात. द्रवरूप विभागाची लांबी स्थिर ठेवल्यास नमुन्याची लांबी जेवढी अधिक असेल, तेवढी अंतिम शुद्धता अधिक मिळते. प्रक्रिया परत करण्याची संख्या कमी ठेवल्यास एकूण वेळ कमी लागतो पण यामुळे वापरण्यायोग्य द्रव्याची (कांबीची) लांबी कमी होते. प्रक्रिया परत करण्याची संख्या मोठ्या असल्यास द्रवरूप विभागाची लांबी कमी असताना अशुद्धींचे सर्वोत्कृष्ट विभक्तीकरण होते. द्रवरूप विभागाच्या स्थानांतराची गती वाढविल्यास प्रत्येक प्रक्रियेस लागणारा वेळ कमी होतो परंतु यामुळे अशुद्धींच्या विभक्तीकरणाची कार्यक्षमता कमी होते. ९९·९९९५% पेक्षा अधिक शुद्ध ॲल्युमिनियम मिळविण्यासाठी करण्यात येणाऱ्या विभागीय शुद्धीकरणातील प्रचल पुढीलप्रमाणे असतात : द्रवरूप विभागाच्या स्थानांतराची गती ताशी २·५ सेंमी. व द्रवरूप विभाग व नमुना यांच्या लांबीमधील गुणोत्तर ०·१ असून ही प्रक्रिया परत परत ३० वेळा करतात. मूळ नमुन्यातील अशुद्धींची वाटणी, द्रवरूप विभागांची संख्या, आकारमान आणि स्थानांतराची दिशा यांच्यावर त्यातील अशुद्धीची अंतिम वाटणी अवलंबून असते.
विभागीय शुद्धीकरणासाठी पुष्कळ प्रकारची उपकरणे वापरतात. पुढील घटक विचारात घेऊन त्यांचे अभिकल्प (आराखडे) तयार करतात : तापनाची किंवा शीतलीकरणाची पद्धत, धारकपात्रांचे स्वरूप (त्यांचे द्रव्य व आकारमान), द्रवरूप विभागाच्या स्थानांतरणासाठीची यंत्रणा, द्रव ढवळण्याची क्रिया आणि संरक्षक परिस्थिती.
तापनासाठी विद्युत् रोधक वेटोळी, विद्युत् प्रवर्तन, विद्युत् प्रज्योत, इलेक्ट्रॉन शलाका, प्रारित ऊर्जा, आयनद्रायू (आयनीभूत वायू), विविध प्रकारचे ⇨लेसर किरण, सौर ऊर्जा तसेच दोन भिन्न द्रव्यांमधील संधीमधून विद्युत् प्रवाह पाठवून करण्यात येणारे पेल्त्ये तापन (वा शीतलीकरण) इ. पद्धती वापरतात. उच्च तापमानातही न वितळता टिकून राहणाऱ्या उच्चतापसह धातू व संयुगे यांच्या तापनासाठी विद्युत् प्रवर्तन किंवा इलेक्ट्रॉन शलाका वापरतात, तर कार्बनी संयुगांसाठी सामान्यपणे विद्युत् रोध तापन वापरतात. कधीकधी यासाठी प्रारित (तरंगरूपी) ऊर्जाही वापरतात. विद्युत् संवाहक द्रव्यांसाठी विद्युत् प्रवर्तन पद्धती वापरतात. यामध्ये द्रवरूप विभागांभोवतीच्या तारेतून विद्युत् प्रवाह जात असतो [⟶ विद्युत् तापन]. यामध्ये प्रत्येक तापकामुळे द्रवरूप विभाग निर्माण होतो. मग तो स्थानांतरित करण्यासाठी दंड वा तापक सरकवितात. यामुळे प्रत्येक तापकापुढे छोटा द्रवरूप विभाग निर्माण होतो. द्रवरूप विभाग तापकासमोरून दूर गेला की, द्रव थंड होऊन गोठतो. अशुद्धी द्रव अवस्थेत राहतात व त्या या विभागासह स्थानांतरित होतात. पुढील तापकाने द्रवरूप विभाग परत बनतो. अशा रीतीने अशुद्धी एका टोकाकडे जाऊन नमुना प्रत्येक वेळी अधिक शुद्ध होतो.
शुद्ध करावयाचे द्रव कोठी तापमानाला द्रवरूप राहत असल्यास त्याचे शुद्धीकरण शीतपेटीत करावे लागते. यामुळे ते प्रथम गोठून घनरूप होते.
काच, उष्णता व रसायनरोधी व्हायकर काच, सायुज्यित सिलिका, धातू, प्लॅस्टिक ग्रॅफाइट तसेच ॲल्युमिनिअम, झिर्कॉन, मॅग्नेशियम, बेरिलियम या धातूंची ऑक्साइडे ही द्रव्ये धारकपात्रासाठी वापरतात. उभ्या दिशेत शुद्धीकरण करताना अगंज पोलादासारखे (स्टेनलेस स्टीसारखे) अपारदर्शक द्रव्य धारकपात्रासाठी वापरतात. धारकपात्र फुटणार नाही याची काळजी त्याचे द्रवय निवडतानाच घ्यावी लागते. मात्र द्रवरूप विभागाचे तापमान जसजसे वाढत जाते तसतसे या द्रव्यांची निवड करण्याचे काम गुंतागुंतीचे होत जाते. धारकपात्रात शुद्ध करावयाच्या धातू व मिश्रधातूंच्या बाबतीत त्यांचा कमाल वितळबिंदू १,५००० से.पर्यंत असावा लागतो. कारण याहून जास्त तापमानाला द्रव्य व धारकपात्र यांच्यात अधिक प्रमाणात विक्रिया होण्याची शक्यता असते. तथापि उच्च वितळबिंदू असलेल्या व विक्रियाशील धातू, संयुगे, अर्धसंवाहक यांचेही धाकरपात्रात विभागीय शुद्धीकरण करता येते. मात्र असे धारकपात्र पाण्याने थंड ठेवावे लागते. कमी वितळबिंदू असणाऱ्या कार्बनी संयुगांचे शुद्धीकरण काचेच्या किंवा प्लॅस्टिकच्या धारकपात्रात करतात.
विभागीय संतलन हा विभागीय शुद्धीकरणाचा एक विशिष्ट प्रकार आहे व तो अर्धसंवाहक उद्योगाच्या गरजेतून पुढे आला आहे. यामध्ये द्रवरूप विभाग आलटून पालटून दोन्ही दिशांनी स्थानांतरित होतो. यामुळे नमुन्याच्या संपूर्ण लांबीभर अशुद्धींची एकसारखी किंवा समांग वाटणी होते. या पद्धतीने मुद्दाम समाविष्ट करावयाच्या अशुद्धींची इष्ट पातळी साध्य करता येते. उदा., जर्मेनियमाच्या स्फटिकांत इंडियम किंवा अँटिमनीसारख्या इष्ट अशुद्धी सर्वत्र एकसारख्या व नियंत्रित प्रमाणात समाविष्ट करता येतात.
तरंगत्या विभागीय शुद्धीकरणात सिलिकॉनाची कांडी टोकांशी चिमट्यांनी पकडून ठेवलेली असते. विद्युत् प्रवर्तन तापनाद्वारे द्रवरूप विभाग निर्माण होतो. हा विभाग त्याच्या स्वतःच्याच ⇨पृष्ठताणाद्वारे जागच्या जागी धरून ठेवला जातो. यामुळे त्याची उंची स्थिर राहते. या पद्धतीत धारकपात्राची गरज नसल्याने संदूषणाचा प्रश्न उदभवत नाही. सिलिकॉनाप्रमाणेच उच्च वितळबिंदू असलेल्या टंगस्टन, मॉलिब्डेनम, लोखंड, निकेल, ऱ्होडियम इ. धातूंसाठीही ही पद्धती उपयुक्त आहे.
तापमान-प्रवणता विभागीय वितळण्याच्या (वितळविण्याच्या) तंत्रात स्फटिक एका टोकाला तापवितात व दुसऱ्या टोकाला थंड करतात. यामध्ये द्रवरूप विभागाचे स्थानांतर गरम टोकाकडे होते. सिलिकॉन, जर्मेनियम व गॅलियम यांच्यात बोरॉन व फॉस्फरस समाविष्ट केल्यास त्यांची विद्युत् संवाहकता वाढते आणि हाच ⇨इलेक्ट्रॉनीय उद्योगाचा आधार आहे. (तापमान-प्रवणतेमुळे सागरी हिमातून खाऱ्या पाण्याचे थेंब स्थानांतर करतात, हे याचे नेहमी आढळणारे उदाहरण आहे).
अखंड विभागीय शुद्धीकरणात कच्चया मालाचा नमुना धारकपात्रातून अखंडपणे जातो. यामुळे शुद्ध व अशुद्ध द्रव्यांचे अखंड प्रवाह निर्माण होतात.
विभागीय शुद्धीकरणाचे तंत्र साधे, सोपे असून यात बहुधा संदूषण होत नाही. मात्र याद्वारे शुद्धीकरण मंद गतीने होते (उदा., कार्बनी संयुगांसाठी याची गती ताशी ०·१ ते २ सेंमी. तर अकार्बनी द्रव्यांसाठी ताशी ०·५ ते ३० सेंमी. एवढीच असते). केवळ मर्यादित प्रमाणावर अतिशुद्ध द्रव्ये मिळविण्यासाठीच याचा उपयोग होतो. धातूंचे मोठ्या प्रमाणावर शुद्धीकरण करण्यासाठी याचा उपयोग होत नाही. तथापि कार्बनी द्रव्यांची उष्णता संवाहकता कमी असल्याने त्यांचे मोठ्या प्रमाणावर शुद्धीकरण करणे या तंत्राद्वारे शक्य आहे. बाष्प-घन रूपांतरात घनफळामध्ये प्रचंड फरक होतो. त्यामुळे अशा द्रव्यांच्या शुद्धीकरणासाठी याचा उपयोग होऊ शकत नाही. तसेच घन-घन रूपांतराच्या बाबतीतही यावर मर्यादा पडतात.
ट्रँझिस्टर, संकलित मंडले इत्यादी इलेक्ट्रॉनीय प्रयुक्तींच्या दृष्टीने हे तंत्र अतिशय महत्त्वाचे ठरले आहे. शिवाय याचे निरनिराळ्या प्रकारचे इतर अनेक उपयोगही होतात. अणुभट्टीविषयीचे तंत्रज्ञान व खास मिश्रधातूंची निर्मिती यांमध्ये हे तंत्र उपयुक्त ठरले आहे. उदा., सायक्लोट्रॉन अनुस्पंदन, उष्णता संवाहकता, अनुस्फुरण, अल्कली (क्षारीय) हलाइडे वगैरेंच्या संशोधनात आवश्यक असणारी अतिशुद्ध द्रव्ये यामुळेच उपलब्ध झाली. या तंत्राने अतिशुद्ध द्रव्ये अल्प प्रमाणात उपलब्ध होतात व या द्रव्यांचे मौलिक अंगभूत गुणधर्म निश्चित करण्यासाठी याचा उपयोग झाला आहे. परिणामी अशा द्रव्यांचे काही अनपेक्षित गुणधर्म उघड झाले आहेत. कारण अशुद्धींमुळे त्यांचे हे गुणधर्म लक्षात आले नव्हते.
विभागीय शुद्धीकरणाद्वारे पुढील द्रव्ये अतिशुद्ध रूपात मिळविता येतात : कमी वितळबिंदू असलेल्या तांबे, चांदी, सोने ॲल्युमिनियम, कॅडमियम, जस्त, बिस्म्थ, कथिल, अँटिमनी, शिसे, गॅलियम, पोटॅशियम, लिथियम, मॅग्नेशियम या तर उच्च वितळबिंदू (८१,७७५० से.पेक्षा जास्त) असलेल्या बेरिलियम, टिटॅनियम, निकेल, लोखंड, झिरकोनियम, इट्रियम, पॅलॅडियम, प्लॅटिनम, ऱ्होडियम, रुबिडियम, इंडियम, ऑस्मियम, कोबाल्ट, क्रोमिनम, मँगॅनीज, व्हॅनेडियम, नोबेलियम, मॉलिब्डेनम, टँटॅलम, ऱ्हीनियम, टंगस्टन या धातू तसेच अर्धसंवाह द्रव्ये (उदा., सिलिकॉन, जर्मेनियम) द्वि-अंगी मिश्रधातू व आंतरधातवीय संयुगे (उदा.,HgTe, CdTe, Bi2Teg, As2Te3, CdSnAs2, CoSi2, InSb, GaAs, GaSb, AlSb, InP, GaP) शिवाय क्षारीय हॅलाइडे (उदा., KCl, NaCl, KBr, KI, AgCl, AgBr, CsI, LiF)
पहा : अर्धसंवाहक इलेक्ट्रॉनीय उद्योग इलेक्ट्रॉनीय प्रयुक्ति ट्रँझिस्टर तंत्रविद्या.
संदर्भ : 1. Bunshah, R. F. Ed., Techniques of Metals Research, Vol. I, New York, 1968.
2. Kirk-Othmer Encyclopedia of Chemical Technology, Vol. 24, Toronta, 1984.
3. Parr, N. L. Zone Refining and Allied Techniques, London, 1960.
4. Pfann, W. G. Hawkins, D.T. Zone Melting, New York, 1978.
5. Schildknecht, Zone Melting, New York, 1966.
खानगांवकर, प. रा.
“