लोहविद्युत्: (फेरोइलेक्ट्रिसिटी). काही विशिष्ट प्रकारच्या विद्युत् अपारक स्फटिकांवर (ज्यात स्थिर 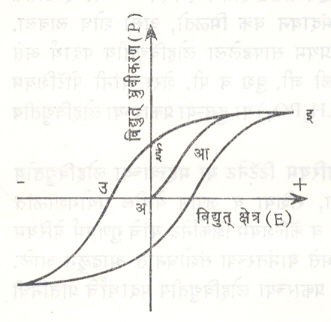 विद्युत् क्षेत्र टिकविता येते अशा स्फटिकांवर) बाहेरून विद्युत् क्षेत्र लावले, तर त्यांमध्ये विद्युत् ध्रुवीकरण होते म्हणजेच त्या स्फटिकांमध्ये विद्युत् द्विध्रुवी परिबल [⟶ विद्युत् गतिकी] निर्माण होते. विद्युत् क्षेत्रामध्ये सतत सारखा बदल करीत गेल्यास अशा पदार्थात निर्माण होणारे ध्रुवीकरण (P) व त्यावर लावलेले विद्युत् क्षेत्र (E) यांकरिता अरेषीय मंदायन प्रकारचा [⟶ चुंबकत्व] संबंध प्रयोगाने मिळतो (आ. १).
विद्युत् क्षेत्र टिकविता येते अशा स्फटिकांवर) बाहेरून विद्युत् क्षेत्र लावले, तर त्यांमध्ये विद्युत् ध्रुवीकरण होते म्हणजेच त्या स्फटिकांमध्ये विद्युत् द्विध्रुवी परिबल [⟶ विद्युत् गतिकी] निर्माण होते. विद्युत् क्षेत्रामध्ये सतत सारखा बदल करीत गेल्यास अशा पदार्थात निर्माण होणारे ध्रुवीकरण (P) व त्यावर लावलेले विद्युत् क्षेत्र (E) यांकरिता अरेषीय मंदायन प्रकारचा [⟶ चुंबकत्व] संबंध प्रयोगाने मिळतो (आ. १).
अशा प्रकारचा संबंध लोहचुंबकीय पदार्थामध्ये चुंबकत्व व चुंबकीकारक क्षेत्र यांमध्ये मिळत असल्यामुळे या विद्युत् आविष्कारास वक्र सादृशावरून लोहविद्युत् अशी संज्ञा देण्यात 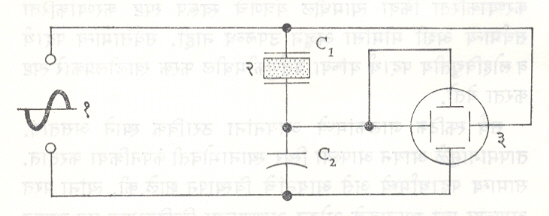 येते. तसे पाहिले असता ही संज्ञा फारशी सयुक्तिक नाही कारण लोहविद्युतीय पदार्थाचा लोहाशी काहीही संबंध नसतो आणि या दोन आविष्कारांच्या मागील यंत्रणेमध्ये पण विशेष असे साम्य दिसत नाही. लोहविद्युतीय स्फटिकाकरिता मंदायन वक्र मिळविण्यासाठी वापरली जाणारी उपकरण योजना आ. २ मध्ये दाखविली आहे.
येते. तसे पाहिले असता ही संज्ञा फारशी सयुक्तिक नाही कारण लोहविद्युतीय पदार्थाचा लोहाशी काहीही संबंध नसतो आणि या दोन आविष्कारांच्या मागील यंत्रणेमध्ये पण विशेष असे साम्य दिसत नाही. लोहविद्युतीय स्फटिकाकरिता मंदायन वक्र मिळविण्यासाठी वापरली जाणारी उपकरण योजना आ. २ मध्ये दाखविली आहे.
C1 या प्रतलीय धारित्रामध्ये [⟶ विद्युत् धारित्र] आयताकार समांतर फलकाच्या स्वरूपात असणारा पदार्थ (स्फटिक) अपारक म्हणून ठेवलेला असतो. मंडलाला निम्न कंप्रतेचा (एका सेकंदात होणारी कंपन संख्या निम्न असलेला) प्रत्यावर्ती विद्युत् पुरवठा (ठराविक कालवधीने दिशा व महत्ता बदलणारा विद्युत् पुरवठा) दिला असता पदार्थाकरिता मंदायन वक्र सरळ ऋण किरण दोलनदर्शकावर [⟶ इलेक्ट्रॉनीय मापन] प्रदर्शित केला जातो.
आ. १. मधील मंदायन वक्रावरून हे स्पष्ट होते की, लावलेल्या विद्युत् क्षेत्राच्या तीव्रतेत (E) सतत वाढ केली असता पदार्थाचे ध्रुवीकरण पण सतत वाढत जाऊन इ बिंदूपाशी तिचे मूल्य संपृक्त (महत्तम) होते. या बिंदूपासून आता जर विद्युत् क्षेत्र E सतत वाढ केली असता पदार्थाचे ध्रुवीकरण पण सतत वाढत जाऊन इ बिंदूपाशी तिचे मूल्य संपृक्त (महत्तम) होते. या बिंदूपासून आता जर विद्युत् क्षेत्र E सतत कमी करून शून्यापर्यंत नेले, तर पदार्थातील ध्रुवीकरण इई या वक्राने दाखविल्याप्रमाणे थोडे कमी होते पण ते शून्य होत नाही. विद्युत् क्षेत्र शून्य झाले, तरी ध्रुवीकरण अई या शेष मूल्यावर स्थिर होते. याचा अर्थ असा होतो की, पदार्थाच्या दोन्ही पृष्ठभागावनंर कायम स्वरूपाचे विद्युत् भार निर्माण होत असतात. यामुळे पदार्थाला शाश्वत स्वरूपाचे विद्युत् द्विध्रुवी परिबल प्राप्त होते. हा विद्युत् भार किंवा परिबल नाहीसे करण्याकरिता अइ या मूल्याचे विरुद्ध दिशेतील विद्युत् क्षेत्र पदार्थावर लावणे आवश्यक होते. योग्य मूल्याच्या व्युत्क्रमी विद्युत् क्षेत्राचा उपयोग करून पदार्थाच्या ध्रुवीकरण दिशेत व्युत्क्रमी बदल घडवून आणता येतो.
अवस्था संक्रमण: ज्या पदार्थामध्ये शाश्वत स्वरूपाचे ध्रुवीकरण झाले आहे अशा पदार्थाच्या तापमानात सारखी वाढ करीत गेल्यास व विद्युत् क्यूरी तापमानावर (प्येअर क्यूरी या भौतिकीविज्ञांच्या नावावरून ओळखण्यात येणाऱ्या तापमानावर) पदार्थ पोहोचल्यास हे ध्रुवीकरण नष्ट होऊन त्यामध्ये अवस्था-संक्रमण होते. लोहविद्युत् पदार्थाचे समविद्युत् पदार्थमध्ये रूपांतरण होते. क्यूरी तापमानाते मूल्य निरनिराळ्या पदार्थांकरिता वेगवेगळे असते.
उत्स्फूर्त विद्युत् ध्रुवीकरण व लोहविद्युतीय लघुक्षेत्रे: याउलट क्यूरी तापमानापेक्षा जास्त तापमानावरच्या (लोहविद्युतीय) पदार्थाला एकसारखे थंड करीत नेले, तर परत क्यूरी तापमानाला त्यामध्ये अवस्था-संक्रमण होते. त्यावर कोणतेही विद्युत् क्षेत्र कार्य करीत नसले, तरी पदार्थाच्या सममितीमध्ये भंग होऊन त्यामधील काही विशिष्ट अक्षदिशेत उत्स्फूर्तपणे विद्युत् ध्रुवीकरण होते. या वेळी पदार्थामधील सर्व घटक विभागांकरिता विद्युत् ध्रुवीकरणाची दिशा एकच नसते. त्यामुळे त्याचे सामान्यपणे निरनिराळ्या आकारमानांच्या अशा सूक्ष्म लघुक्षेत्रांत विभाजन होते. उत्स्फूर्त ध्रुवीकरण ही संज्ञा फक्त एका लघुक्षेत्राच्या बाबतीतच सार्थ असते. सबंध स्फटिकाकरिता हे वर्णन लागू पडत नाही कारण संपूर्ण पदार्थाकरिता परिणामी ध्रुवीकरण हे शून्य मूल्याचेच असते.
यांपैकी कोणत्याही एका लघुक्षेत्रामधील सर्व आयनांकरिता (म्हणून त्यामुळे निर्माण झालेल्या संपूर्ण लघुक्षेत्राकरिता ही आयन म्हणजे विद्युत् भारति अणू, रेणू वा अणुगट) विद्युत् ध्रुवीकरणाची दिशा एकच असते पण निरनिराळ्या लघुक्षेत्रांकरिता ध्रुवीकरणाच्या दिशा निरनिराळ्या असतात. लोहविद्युतीय प्रकार (१) व प्रकार (२) यांमध्ये अशा प्रकारे उत्स्फूर्त ध्रुवीकरण झाल्यास त्यांमधील ध्रुवीकरणाच्या दिशांचे वितरण कसे होते याची कल्पना आ. ३ वरून येईल. यामध्ये दाखविलेले वितरण सुलभीकृत व आदर्श स्वरूपाचे आहे, हे लक्षात ठेवणे आवश्यक आहे. लघुक्षेत्र निर्मितीमुळे स्फटिकामध्ये यांत्रिक ताप निर्माण होतात.
विद्युत ध्रुवीकरणामुळे पदार्थामध्ये स्थानिक भौतिकीय स्वरूपाचे बदल होतात. क्ष-किरण किंवा न्यूट्रॉन यांच्या शलाकांच्या पदार्थाद्वारे होणाऱ्या प्रकीर्णनाच्या (विखुरण्याच्या क्रियेच्या) आकृतिबंधावरून या  बदलाच्या स्वरूपाविषयी माहिती मिळविता येते. पदार्थ जर प्रकाशाकरिता पारदर्शक असेल (उदा., वेरियम टिटॅनेट, BaTiO3 हा तिसऱ्या गटातील लोहविद्युतीय पदार्थ) तर ध्रुवण सूक्ष्मदर्शकाद्वारे (ज्यात ध्रुवित म्हणजे एकाच प्रतलात कंप पावणाऱ्या प्रकाशामध्ये पदार्थाचे निरीक्षण करण्यात येते अशा सूक्ष्मदर्शकाद्वारे) त्यातील लघुक्षेत्रांचा अभ्यास करता येतो कारण लघुक्षेत्रामध्ये प्रकाशाचे द्विप्रणमन होते (निरनिराळ्या वेगाने जाणाऱ्या दोन घटकांमध्ये विभाजन होते). अशा प्रकारे मिळालेले लघुक्षेत्राचे आकृतिबंध आ. ४ मध्ये दाखविले आहेत.
बदलाच्या स्वरूपाविषयी माहिती मिळविता येते. पदार्थ जर प्रकाशाकरिता पारदर्शक असेल (उदा., वेरियम टिटॅनेट, BaTiO3 हा तिसऱ्या गटातील लोहविद्युतीय पदार्थ) तर ध्रुवण सूक्ष्मदर्शकाद्वारे (ज्यात ध्रुवित म्हणजे एकाच प्रतलात कंप पावणाऱ्या प्रकाशामध्ये पदार्थाचे निरीक्षण करण्यात येते अशा सूक्ष्मदर्शकाद्वारे) त्यातील लघुक्षेत्रांचा अभ्यास करता येतो कारण लघुक्षेत्रामध्ये प्रकाशाचे द्विप्रणमन होते (निरनिराळ्या वेगाने जाणाऱ्या दोन घटकांमध्ये विभाजन होते). अशा प्रकारे मिळालेले लघुक्षेत्राचे आकृतिबंध आ. ४ मध्ये दाखविले आहेत.
 लघुक्षेत्राची परिमाणे काही मिमी. ते अवसूक्ष्म (साध्या प्रकाशीय सूक्ष्मदर्शकाच्या साहाय्याने दृश्यमान न होणाऱ्या) मूल्याची असतात. दोन निकटवर्ती लघुक्षेत्रांना विभागणारी एक भिंत असते. या भिंतीची रुंदी पदार्थाच्या स्फटिक जालकाच्या परिमाणाच्या काही थोड्या पटींत असते.
लघुक्षेत्राची परिमाणे काही मिमी. ते अवसूक्ष्म (साध्या प्रकाशीय सूक्ष्मदर्शकाच्या साहाय्याने दृश्यमान न होणाऱ्या) मूल्याची असतात. दोन निकटवर्ती लघुक्षेत्रांना विभागणारी एक भिंत असते. या भिंतीची रुंदी पदार्थाच्या स्फटिक जालकाच्या परिमाणाच्या काही थोड्या पटींत असते.
क्यूरी तापमानाच्याखाली पदार्थाचे तापमान असताना त्यामध्ये वरीलप्रमाणे उत्स्कूर्तपणे विद्युतीय ध्रुवीकरण होते. या परिस्थितीमध्ये जर त्यावर बाहेरून विद्युत् क्षेत्र लावले, तर विद्युत् क्षेत्र दिशेला अनुकूल अशा दिशेत ध्रुवीकरण असणाऱ्या लघुक्षेत्राच्या क्षेत्रफळात वाढ होते आणि ही वाढ विद्युत् क्षेत्राला प्रतिकूल असणाऱ्या लघुक्षेत्रात घट करून सिद्ध होते. त्यामुळे वाढल्या E बरोबर पदार्थाचे ध्रुवीकरण वाढत जाऊन शेवटी ते संपृक्त होते. संपृकत अवस्थेत सर्व लघुक्षेत्र ध्रुवीकरण दिशा बाह्य विद्युत् क्षेत्राला समांतर होतात. त्यामुळे यापुढे E मध्ये वाढ केली, तर ध्रुवीकरणात वाढ होण्याची शक्यता रहात नाही.
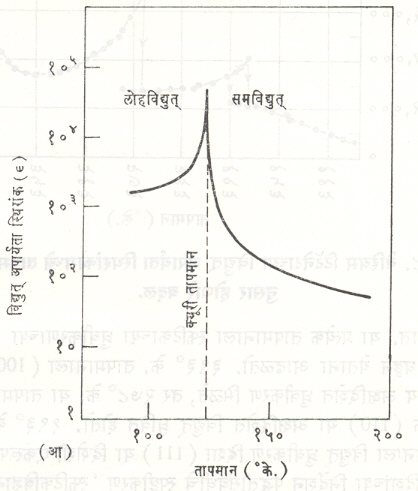
विद्युत् अपारक गुणधर्म: पदार्थाच्या विद्युत् अपार्यता स्थिरांकाचे (Є) तापमानाबरोबरचे चलन पाहिले, तर ते चुंबकीय प्रवणतेसंबंधीच्या क्यूरी-वाइस नियमाच्या [⟶ चुंबकत्व] सदृश अशा खाली दिलेल्या नियमाप्रमाणे बदल दाखविते.
पदार्थाचा विद्युत् अपार्यता स्थिरांक (Є) = C / T-Tc येथे C = क्यूरी स्थिरांक व Tc = क्यूरी तापमान (किंवा सामान्यतः क्यूरी तापमानापेक्षा किंचित कमी असलेले तापमान). क्यूरी तापमानाकरिता पदार्थाच्या विद्युत् अपार्यता स्थिरांकामध्ये मोठ्या प्रमाणात जो बदल होतो त्याचे स्वरूप काही पदार्थामध्ये संतत स्वरूपाचे असते, तर ते काहींमध्ये असंतत असे आढळते.
पदार्थाकरिता जर मंदायन वक्र मिळाले, तर पदार्थ लोहविद्युतीय आहे याबद्दल पुरेसा व आवश्यक पुरावा आहे असे जरी गृहीत घरले जात असले, तरी त्याकरिता (१) लघुक्षेत्र निर्मिती व (२) क्यूरीवाइस नियमाचे पालन, या दोन्ही प्रकारांचा दुय्यम पुरावा पडताळा म्हणून सामान्यपणे मिळविला जातो.
ऐतिहासिक : रॉशेल लवण अथवा पोटॅशियम सोडियम टार्टारेट (KNaC4H4O6.4H2O) हा पदार्थ आपल्या असामान्य विद्युत गुणधर्माबद्दल १८९४ सालापासून प्रसिद्ध होता. १९२१ मध्ये जे. व्हालासेक यांनी या लवणाकरिता मंदायन वक्र मिळतो, असा शोध लावला. त्यामुळे हे लवण म्हणजे प्रथम सापडलेला लोहविद्युतीय पदार्थ असे म्हणता येते. १९३५ साली जी. बुश व पी. शेरर यांनी पोटॅशियम डायहायड्रोजन फॉस्फेट (KH2PO4) व दुसऱ्या प्रकारच्या लोहविद्युतीय पदार्थाचा शोध लावला.
इ. स. १९४३ मध्ये बेरियम टिटॅनेट या महत्त्वाच्या लोहविद्युतीय पदार्थाचा शोध अमेरिका, रशिया व जपान येथील प्रयोगशाळांत लागला. स्ट्राँशियम टिटॅनेट व कॉल्शियम झिर्कोनेट यांचे गुणधर्म बेरियम टिटॅनेटाप्रमाणेच आहेत, असे यानंतरच्या संशोधनात आढळून आले. बेरियम टिटॅनेट हे तिसऱ्या प्रकारच्या लोहविद्युतीय पदार्थाचे प्रतिनिधी आहे.
लोहविद्युत् गुणधर्म व त्यांचे विशदीकरण: लोहविद्युत् गुणधर्मांकरिता कोणते स्फटिक प्रकार आवश्यक आहेत याबद्दल सर्वसाधारण नियम सापडत नाहीत. स्फटिकामध्ये जर सममिती केंद्राचा अभाव असेल, तर तो लोहविद्युतीय असण्याचा संभव असतो पण असा अभाव असलेला प्रत्येक स्फटिक लोहविद्युतीय असतोच, असे आढळत नाही. सर्व लोहविद्युतीय पदार्थ दाबविद्युत् आविष्कार [⟶ दाबविद्युत्] दाखवितात व त्यामधील अणू हे समविद्युत् स्वरूपाचे असतात म्हणजे त्यांना शाश्वत स्वरूपाचे विद्युत् परिबल असते. या दोन अटी सर्व लोहविद्युतीय पदार्थांकरिता सार्थ असतात, असे मात्र आढळते.
सर्व प्रकारच्या लोहविद्युतीय पदार्थांच्या गुणधर्मांचे विशदीकरण करण्याकरिता किंवा त्यामधील यंत्रणेचे स्वरूप स्पष्ट करण्याकरिता सर्वमान्य अशी मीमांसा अजून उपलब्ध नाही. सर्वसामान्य पदार्थ व लोहविद्युतीय पदार्थ यांच्या वर्तणुकीमधील फरक खालीलप्रकारे स्पष्ट करता येतो.
सर्व स्फटिक जालकामंध्ये आयनांना ठराविक स्थाने असतात. तापमानामुळे आयन आपल्या स्थिर स्थानाभोवती कंपनक्रिया करतात. सामान्य पदार्थामध्ये असे आयनांचे विस्थापन झाले की, त्यांना परत आपल्या मूळ स्थानाकडे ओढून आणणाऱ्या स्थितिस्थापक पुनःस्थापन करणाऱ्या प्रेरणा निर्माण होतात. त्यामुळे आयनांच्या विस्थापनाला फक्त क्षणिक असेच स्वरूप असते. याउलट लोहविद्युतीय पदार्थाच्या जालकामधील आयनाचे तापमान-प्रेरित कंपनक्रियेमुळे जर विस्थापन झाले, तर त्यामुळे तेथे स्थानिक विद्युत् क्षेत्र निर्माण होऊन आसमंतातील आयनांचे विद्युतीय ध्रुवीकरण होते. ध्रुवीकरणामुळे ज्या प्रेरणा कार्यान्वित होतात त्यांमुळे पुनःस्थापन प्रेरणेला विरोध होत असल्यामुळे एकदा विस्थापित झालेला आयन परत आपल्या मूळ स्थानी येऊ शकत नाही. तो विस्थापित अवस्थेमध्ये कायमचा स्थिर होतो. परिणामतः पदार्थामध्ये अनेक ठिकाणी कायम स्वरूपाची स्थानिक विद्युत् क्षेत्रे निर्माण होऊन त्यामुळे त्यामध्ये लघुक्षेत्रे निर्माण होतात.
लोहविद्युतीय पदार्थांचे गट: लोहविद्युतीय पदार्थांचे वर्गीकरण अनेक प्रकारे होऊ शकते. सामान्यपणे लोहविद्युतीय पदार्थांचे तीन गट आहेत असे समजण्यात येते.


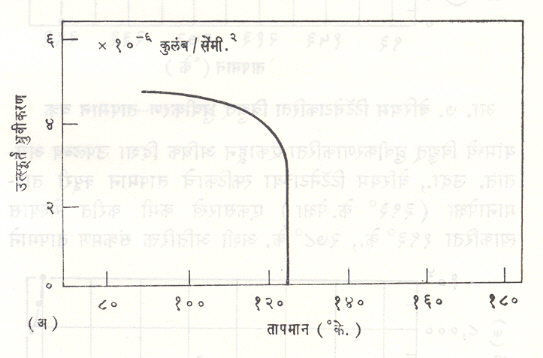
पहिल्या गटात टार्टारेटांचा समावेश केला जातो. या प्रकारचे रॉशेल लवण हे एक सर्वज्ञात असे एक उदाहरण आहे. रॉशेल लवण दाबविद्युत् परिणामाकरिताही प्रसिद्ध आहे. त्याला २५५° के. व २९६° के. अशी दोन क्यूरी तापमाने असून यांच्या दरम्यानच्या तापमानाकरिता हा पदार्थ लोहविद्युतीय गुणधर्म दाखवितो. या संदर्भात लक्षात ठेवण्याजोगती गोष्ट म्हणजे विद्युत् ध्रुवीकरण स्फटिकाच्या फक्त एका दिशेतच होते. या गटामध्ये ग्लायसीन सल्फेट, कोलमनाइट, थायोयूरिया इत्यादींचाही समावेश होतो.
रॉशेल लवणाकरिता उत्स्फूर्त ध्रुवीकरण व विद्युत् आपर्यता स्थिरांकाचे तापमानानुसार होणारे बदल आ. ५ मध्ये दाखविले आहेत. आ. ५ (आ) मधील व ती पुढील अशा प्रकारच्या सर्व वक्रांत विद्युत् अपार्यता स्थिरांकाचे निर्देशन लॉगरिथमी मापनश्रेणीमध्ये करण्यात आले आहे.
दुसऱ्या गटाचे डाय हायड्रोजन फॉस्फेट ऑफ पोटॅशियम (KH2PO4) हे लवण प्रातिनिधिक समजता येते. या पदार्थामध्ये सुद्धा निर्माण होणारे ध्रुवीकरण स्फटिकाच्या एकाच अक्षात होताना आढळते. या प्रकारातील पदार्थाकरिता क्यूरी तापमान खूप कमी असल्यामुळे याचा प्रयुक्तीमध्ये फारसा उपयोग होत नाही. या पदार्थांकरिता उत्स्फूर्त ध्रुवीकरणाचे प्रमाण मध्यम प्रतीचे असते. त्याप्रमाणे विद्युत् अपार्यता स्थिरांकाचे मूल्य पण जास्त असते (आ. ६). या प्रकारामध्येच KH2AsO4 व RbH2PO4 यांचाही समावेश होतो.
या वर्गातील KH2PO4 या पदार्थाच्या लोहविद्युत् रूपांतरणाकरिता समाधानकारक मीमांसा उपलब्ध आहे. या पदार्थाची स्फटिकरचना पाहिली, तर तीमध्ये फॉस्फेट चतुष्फलक असून त्यांच्या मध्यभागी फॉस्फरस आयन असतो, तर त्याच्या चार टोकांशी ऑक्सिजन आयन असतात. वरच्या ऑक्सिजन आयनाचे अनुबंधन खालच्या ऑक्सिजन आयनाबरोबर हायड्रोजन आयनबंधाद्वारे साधले जाते.
या बंधामध्ये हायड्रोजन आयनांना वेगवेगळी स्थाने व्यापणे शक्य असते. या प्रत्येक स्थानानुरूप पदार्थमध्ये वेगवेगळ्या मूल्याचे ध्रुवीकरण मिळते. मागे वर्णन केल्याप्रमाणे जर फॉस्फेट गटाच्या सापेक्ष या हायड्रोजन आयनाचे विस्थापन झाले, तर त्यामुळे पदार्थामध्ये ध्रुवीकरण होते. क्ष-करिण विश्लेषणामध्ये असे आढळले की, पदार्थाच्या लोहविद्युत् अवस्थेमध्ये फक्त हायड्रोजन आयनाचेच विस्थापन होत नाही तर ऑक्सिजन, फॉस्फरस व पोटॅशियम हे आयन पण विस्थापित होतात. विस्थापनामुळे निर्माण होणाऱ्या ध्रुवीकरण मूल्याचे गणन केले, तर ते प्रयोगाने आढळलेल्या ध्रुवीकरणाशी जुळते, असे दिसते. या प्रकारामध्ये हायड्रोजन आयनबंधाला विशेष महत्त्व असते.
 लोहविद्युतीय पदार्थाच्या तिसऱ्या गटामध्ये बेरियम टिटॅनेट, टँटॅलेटे, निओबेटे, टंगस्टेटे, पेरोव्हस्काइटे, मिथिल अमोनियम ॲलम इ. पदार्थांचा समावेश होतो. या पदार्थाचे वैशिष्ट्य असे असते की, यांमध्ये विद्युत् ध्रुवीकरणाकरिता एकाहून अधिक दिशा उपलब्ध असतात. उदा., बेरियम टिटॅनेटाच्या स्फटिकाचे तापमान क्यूरी तापमानापेक्षा (३९३° के. पेक्षा) एकसारखे कमी करीत गेल्यास त्याकरिता १९३° के., २७८° के. अशी अतिरिक्त संक्रमण तापमाने मिळतात. या प्रत्येक
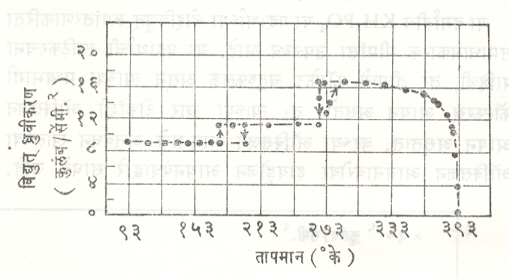
लोहविद्युतीय पदार्थाच्या तिसऱ्या गटामध्ये बेरियम टिटॅनेट, टँटॅलेटे, निओबेटे, टंगस्टेटे, पेरोव्हस्काइटे, मिथिल अमोनियम ॲलम इ. पदार्थांचा समावेश होतो. या पदार्थाचे वैशिष्ट्य असे असते की, यांमध्ये विद्युत् ध्रुवीकरणाकरिता एकाहून अधिक दिशा उपलब्ध असतात. उदा., बेरियम टिटॅनेटाच्या स्फटिकाचे तापमान क्यूरी तापमानापेक्षा (३९३° के. पेक्षा) एकसारखे कमी करीत गेल्यास त्याकरिता १९३° के., २७८° के. अशी अतिरिक्त संक्रमण तापमाने मिळतात. या प्रत्येक 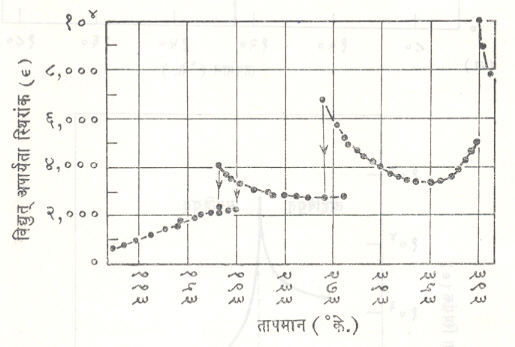 तापमानाला स्फटिकाच्या ध्रुवीकरणाच्या दिशेत बदल घडून येताना आढळतो. ३९३° के. तापमानाला (100) या समतुल्य अक्षदिशेत ध्रुवीकरण मिळते, तर २७८° के. या तापमानाला स्फटिक (110) या अक्षदिशेत विद्युत् ध्रुवित होतो. १९३° के. या तापमानाला विद्युत् ध्रुवीकरण दिशा (111) या दिशेशी एकरूप होते. (अक्षदिशांच्या निर्देशन पद्धतीसंबंधीचे स्पष्टीकरण ‘स्फटिकविज्ञान’ या नोंदीत पहावे). या प्रत्येक तापमानाला स्फटिकाच्या संरचनेत थोडे फेरफार होत असतात, हे लक्षात ठेवावयास पाहिजे. बेरियम टिटॅनेटाकरिता क्यूरी तापमानाच्या जवळपास विद्युत् ध्रुवीकरणाचे तापमानाबरोबर कसे चलन होते हे आ. ७ मध्ये दाखविले आहे. या पदार्थाच्या विद्युत् अपार्यता स्थिरांकामध्ये मिळणारे तापमानानुसार होणारे बदल आ. ८ मध्ये ११३° के. ते ३९३° के. या संपूर्ण तापमान फरकाकरिता दाखविले आहेत. आकृतीवरून २७८° के. व १९३° के. या तापमानांकरिता होणाऱ्या फेरफारांची चांगली कल्पना येते.
तापमानाला स्फटिकाच्या ध्रुवीकरणाच्या दिशेत बदल घडून येताना आढळतो. ३९३° के. तापमानाला (100) या समतुल्य अक्षदिशेत ध्रुवीकरण मिळते, तर २७८° के. या तापमानाला स्फटिक (110) या अक्षदिशेत विद्युत् ध्रुवित होतो. १९३° के. या तापमानाला विद्युत् ध्रुवीकरण दिशा (111) या दिशेशी एकरूप होते. (अक्षदिशांच्या निर्देशन पद्धतीसंबंधीचे स्पष्टीकरण ‘स्फटिकविज्ञान’ या नोंदीत पहावे). या प्रत्येक तापमानाला स्फटिकाच्या संरचनेत थोडे फेरफार होत असतात, हे लक्षात ठेवावयास पाहिजे. बेरियम टिटॅनेटाकरिता क्यूरी तापमानाच्या जवळपास विद्युत् ध्रुवीकरणाचे तापमानाबरोबर कसे चलन होते हे आ. ७ मध्ये दाखविले आहे. या पदार्थाच्या विद्युत् अपार्यता स्थिरांकामध्ये मिळणारे तापमानानुसार होणारे बदल आ. ८ मध्ये ११३° के. ते ३९३° के. या संपूर्ण तापमान फरकाकरिता दाखविले आहेत. आकृतीवरून २७८° के. व १९३° के. या तापमानांकरिता होणाऱ्या फेरफारांची चांगली कल्पना येते.
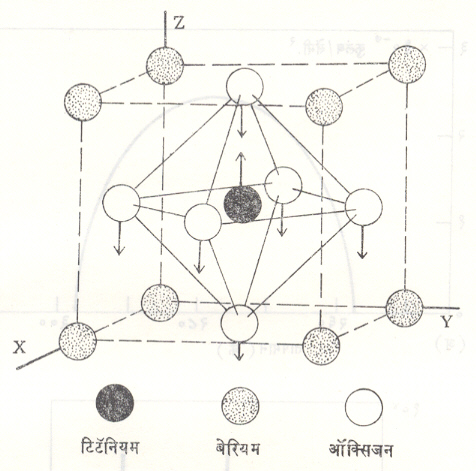 बेरियम टिटॅनेटामध्ये विद्युत् ध्रुवीकरणाची प्रक्रिया कशी सिद्ध होते याची कल्पना आ. ९ वरून येईल. अध्रुवित अवस्थेमध्ये स्फटिकातील टिटॅनियम, बेरियम व ऑक्सिजन या आयनांची स्थाने दाखविली आहेत. ध्रुवित अवस्थेत ऑक्सिजन आयन कोणत्या दिशेत विस्थापित होतात हे बाणांच्या साहाय्याने दाखविले आहे. ऑक्सिजन आयनाचे अस्तित्व या लोहविद्युतीय गटाकरिता महत्त्वाचे असते. क्ष-किरण प्रकीर्णन प्रयोगांवरून O – – आयनांचे बेरियम आयनाच्या सापेक्ष होणारे विस्थापन ०.०८ ते ०.१ Å (Å– अँगस्ट्रॉम, १ Å= १०—१० मी.) या प्रतीचे असते, असे आढळून आले आहे.
बेरियम टिटॅनेटामध्ये विद्युत् ध्रुवीकरणाची प्रक्रिया कशी सिद्ध होते याची कल्पना आ. ९ वरून येईल. अध्रुवित अवस्थेमध्ये स्फटिकातील टिटॅनियम, बेरियम व ऑक्सिजन या आयनांची स्थाने दाखविली आहेत. ध्रुवित अवस्थेत ऑक्सिजन आयन कोणत्या दिशेत विस्थापित होतात हे बाणांच्या साहाय्याने दाखविले आहे. ऑक्सिजन आयनाचे अस्तित्व या लोहविद्युतीय गटाकरिता महत्त्वाचे असते. क्ष-किरण प्रकीर्णन प्रयोगांवरून O – – आयनांचे बेरियम आयनाच्या सापेक्ष होणारे विस्थापन ०.०८ ते ०.१ Å (Å– अँगस्ट्रॉम, १ Å= १०—१० मी.) या प्रतीचे असते, असे आढळून आले आहे.
याशिवाय ग्वानिडीन संयुगांचा एक चौथा गट आहे. या पदार्थांच्या संरचनेविषयी फारशी माहिती उपलब्ध नाही. क्यूरी तापमान गाठण्यापूर्वीच या पदार्थाचे अपघटन (घटक अलग होण्याची क्रिया) होते, असे दिसून आले आहे.
काही विशिष्ट कार्बनी मेणांच्या मिश्रणांचे तीव्र विद्युत् क्षेत्रात घनीभवन होऊ दिले असता त्यांचे विद्युत् परिबल शाश्वत स्वरूप धारण करते. अशा पदार्थांना इलेक्ट्रेट असे म्हणतात. १९२५ मध्ये एगुची यांनी या पदार्थांचा शोध लावला. तोरमल्ली (टुर्मलीन) सारख्या स्फटिकांत ते तापविले, तरच निरीक्षण करता येईल इतके उत्स्फूर्त परिबल निर्माण होते. अशा पदार्थाना उत्ताप विद्युतीय पदार्थ असे म्हणतात. [⟶ विद्युत्].
लोहविद्युतीय पदार्थांचे उपयोग: या पदार्थाचा (विशेषतः बेरियम टिटॅनेट) विद्युत् यांत्रिक ऊर्जा परिवर्तक (विद्युत् प्रणालीपासून येणाऱ्या तरंगाचे ग्रहण करून यांत्रिक प्रणालीला तरंग पोहोचविणारी किंवा याविरुद्ध दिशेने कार्य करणारी प्रयुक्ती) म्हणून फार मोठ्या प्रमाणात उपयोग होतो. विद्युत् क्षेत्रामुळे या पदार्थात जो द्विप्रणमन परिणाम मिळतो, त्याचा उपयोग करून प्रकाशाचे विरूपण करता येते [⟶ प्रकाशीय संदेशवहन विरूपण]. बेरियम टिटॅनेटावर (त्याचप्रमाणे LiNbO3, KTaNbO3 व LiTaO3 या पदार्थावर) प्रकाश पडल्यामुळे त्याच्या प्रणमनांकामध्ये बदल होतो. याद्वारे प्रकाशीय अवगमांचा (माहितीचा) संचय करता येतो. उत्स्फूर्त ध्रुवीकरणाचे मूल्य पदार्थाच्या तापमानावर अवलंबून रहात असल्यामुळे, औष्णिक व अवरक्त (वर्णपटातील तांबड्या रंगाच्या अलीकडील) प्रारणांचे (तरंगरूपी ऊर्जांचे) संवेदक म्हणून हे पदार्थ वापरता येतात.
संदर्भ : 1. Dekker, A. J. Solid State Physics, London, 1970.
2. Fridkin. V. M. Photoferroelectrics, Berlin, 1979.
3. Kittel, C. Introduction to Solid State Physics, Bombay, 1964.
4. Lines, M.E. Glass, A. M. Principles and Applications of Ferroelectrics and Related Materials, Oxford, 1977.
5. Mitsui, T. and others Trans. Ishihashi, Y. and others. An Introduction to the Physics of Ferroelectrics, New York, 1976.
चिपळोणकर, व. त्रिं.भोसले, ना. वि.
“