युरेनियम : धातुरूप मूलद्रव्य. रासायनिक चिन्ह U. अणुक्रमांक (अणुकेंद्रातील प्रोटॉनांची संख्या) ९२ अणुभार २३८·०३ आवर्त सारणीतील (इलेक्ट्रॉन रचनेनुसार केलेल्या मूलदव्यांच्या कोष्टकरूप मांडणीतील) ३ब गटातील व ॲक्टिनाइड श्रेणीतील (अणुक्रमांक ८९ ते १०३ या मूलद्रव्यांच्या श्रेणीतील) मूलद्रव्य ज्ञात समस्थानिकांचे (अणुक्रमांक तोच पण भिन्न अणुभार असलेल्या त्याच मूलद्रव्यांच्या प्रकारांचे) द्रव्यमानांक (अणुकेंद्रातील प्रोटॉन व न्यूट्रॉन यांची एकूण संख्या) २२६ ते २४० पर्यंत सर्व समस्थानिक किरणोत्सर्गी (भेदक कण व किरण बाहेर टाकणारे) असून निसर्गात २३४, २३५ व २३८ या द्रव्यमानांकांचे समस्थानिक आढळतात व बाकीचे किरणोत्सर्गी प्रक्रियांनी तयार करण्यात आलेले आहेत विद्युत् विन्यास (अणुकेंद्राभोवतील विविध कक्षांतील इलेक्ट्रॉनांची संख्या) २, ८, १८, ३२, २१, ९, २ संयुजा (इतर अणूंशी संयोग पावण्याची क्षमता दर्शविणारा अंक) ३, ४, ५, ६ घनता १९·०४ ग्रॅ./सेंमी३. वितळबिंदू ११३२०·४ ± ०·८ से. उकळबिंदू ३८१८० से. ही धातू वर्धनशील (पत्रे तयार करता येणारी) व तन्य (तारा काढता येणारी) असून विद्युत् दुर्वाहक आहेत. युरेनस या ग्रहावरून युरेनियम हे नाव पडलेले आहे.
एम्. एच्. क्लापरोट या जर्मन शास्त्रज्ञांनी १७८९ साली सॅक्सनी (जर्मनी) मधील पिचब्लेंड या धातुकापासून (कच्च्या रूपातील धातूपासून) विलग करून युरेनियमाचा शोध लावला. प्रत्यक्षात हे युरेनियम डाय-ऑक्साइड होते, असे नंतर आढळून आले. युरेनियम धातू शुद्ध स्वरूपात प्रथम ई. एम्. पेलीगॉट यांनी १८४१ मध्ये मिळविली. ए. एच्. बेक्रेल यांनी युरेनियम हे नैसर्गिकपणे किरणोत्सर्गी आहे हे १८९६ मध्ये दाखविले. आल्फा किरण उत्सर्जनामुळे या मूलद्रव्याचे उस्फूर्तपणे सतत रूपांतरण होत असते, असे प्रयोगान्ती कळले. [⟶ किरणोत्सर्ग].
दुसऱ्या महायुद्धापूर्वीच्या काळात मृत्तिका पात्रांना पिवळा (किंवा हिरवा) रंग देण्याकरिता युरेनियम वापरले जात होते. काही विशेष प्रकारच्या पोलादांना कठिणता आणण्याकरिता पण याचा उपयोग केला जात होता. नैसर्गिक युरेनियम हे २३४, २३५ आणि २३८ द्रव्यमानांक असलेल्या ३ समस्थानिकांचे मिश्रण असते. त्यांच्या वजनी प्रमाणाची टक्केवारी अनुक्रमे ०·०००५४%, ०·७२% व ९९·२७५% अशी असते (या टक्केवारीच्या मूल्यांत नमुन्याचा उद्गम व किरणोत्सर्गी क्षयाचे प्रमाण यांनुसार थोडाफार फरक पडतो). या समस्थानिकांची अर्धायुष्ये (किरणोत्सर्गाची मूळची क्रियाशीलता निम्मी होण्यास लागणारे काळ) अनुक्रमे २·४५ × १०५ वर्षे, ७·०४ × १०७ वर्षे व ४·४७ ×१०९ वर्षे इतकी आहेत.
युरेनियम (२३५) हा समस्थानिक ए. जे. डेमस्टर यांनी १९३६ साली शोधून काढला. या समस्थानिकावर मंदगी न्यूट्रॉनाचा मारा केला असता त्याचे भंजन होऊन (अणुकेंद्र फुटून) प्रचंड प्रमाणात ऊर्जा मुक्त होते, असे १९३९ मध्ये ओसे हान, लिझे माइटनर आणि फ्रिट्झ स्ट्रासमान यांनी प्रथम दाखविले. यामुळे युरेनियमाला फार मोठे महत्त्व प्राप्त झाले. या प्रक्रियेचा उपयोग करून ऊर्जा पुरविणारा पहिला अणुकेंद्रीय विक्रियक (अणुभट्टी) अमेरिकेमध्ये शिकागो विद्यापीठामध्ये एन्रीको फेर्मी यांच्या नेतृत्वाखाली डिसेंबर १९४२ साली प्रथम कार्यान्वित करण्यात आला. याच प्रक्रियेच्या स्फोटक आविष्काराचा म्हणजे अणुबाँबचा प्रयोग हीरोशीमावर १९४५ साली करण्यात आला. युरेनियम (२३८) या समस्थानिकावर जर वेगवान न्यूट्रॉनांचा मारा केला, तर त्याचे शोषण होऊन त्यापासून दोन बीटा कणांचे उत्सर्जन होऊन त्याचे प्लुटोनियम या भंजनक्षम मूलद्रव्यात अंती रूपांतर होते असे प्रयोगाने आढळले आहे [⟶ प्लुटोनियम].
युरेनियमचा उपयोग आता प्रामुख्याने अणुऊर्जानिर्मितीसाठी करण्यात येतो [⟶ अणुकेंद्रीय अभियांत्रिकी].
आढळ : युरेनियम धातुकाचे दोन मुख्य प्रकार आहेत. युरेनियम ऑक्साइडाचे प्रमाण विशेष जास्त असलेली पिचब्लेंड वा युरेनाइट यासारखी प्राथमिक द्रव्ये हा यांमधील पहिला प्रकार होय परंतु ही धातुके फारच थोड्या ठिकाणी व तीसुद्धा अल्प प्रमाणातच सापडतात. दुय्यम दर्जाच्या धातुकांमध्ये युरॅनोफेन यासारख्या धातुकाचा समावेश होतो. या धातुकांत युरेनियम ऑक्साइडाचे प्रमाण बऱ्यापैकी असते. कमी प्रमाणात युरेनियम असलेली धातुके बऱ्याच ठिकाणी विखुरलेली आढळतात.
पिचब्लेंडाच्या (अथवा युरेनाइटाच्या) शिरा झाईरे, कॅनडा, चेकोस्लोव्हाकिया, फ्रान्स इ. देशांमधील खडकांमध्ये सापडतात. काही ठिकाणी सोने व चांदी यांच्या धातुकांबरोबर युरेनियम व थोरियम या दोन्ही मूलद्रव्यांची मिश्र धातुके सापडतात. या धातुकांमध्ये युरेनियमाचे प्रमाण कमी असल्यामुळे त्यांपासून युरेनियम मिळविण्याकरिता जास्त खर्च येतो. अशा प्रकारचे साठे पृथ्वीवर कॅनडा, ऑस्ट्रेलिया, मादागास्कर व आफ्रिकेमधील अनेक ठिकाणी मिळाले आहेत. गाळाच्या खडकांमध्ये सुद्धा युरेनियम मिळते पण याचे प्रमाण आणखी कमी असते. असे साठे अमेरिकेमध्ये मिळाले आहेत. फॉस्फेटी खडक, शेल खडक यांमध्ये पण युरेनियम सापडते. या प्रकारचे खडक अमेरिकेतील फ्लॉरिडा व टेनेसी या राज्यांत आढळतात. तसे पाहिले असता युरेनियमच्या धातुकाचे वितरण जगभर सर्व ठिकाणी झाले आहे. आपणास आवश्यक असणारे युरेनियम कोणत्याही देशाला आपल्या देशामध्येच मिळविणे संपूर्णपणे शक्य आहे. फक्त ही धातू शुद्ध करण्याकरिता देशानुरूप लागणारा खर्च धातुकाच्या दर्जाप्रमाणे कमीजास्त मूल्याचा असतो.
जगामधील निरनिराळ्या दर्जांच्या युरेनियमाच्या पुरवठ्याबद्दलचा १९७२ मध्ये केलेला अंदाज कोष्टक क्र. १ मध्ये दिलेला आहे.
कोष्टक क्र. १. जगातील निरनिराळ्या दर्जाच्या युरेनियमाचा पुरवठा
(१९७२)
|
क्रमांक |
उत्पादन खर्च (डॉलर प्रती किग्रॅ.) |
अंदाजी साठा (टन) |
पुरवठ्याची स्थिती |
|
१ |
२२ |
४, २०, ००० |
१९८० पर्यंत पुरावा |
|
२ |
३३ |
७, ००, ००० |
१९८५ पर्यंत पुरावा |
|
३ |
६६ |
१, ६०, ००० |
– |
क्रमांक (१) या साठ्यांत युरेनियमाचे प्रमाण सर्वांत अधिक असल्यामुळे त्यापासून एक किग्रॅ. शुद्ध युरेनियम मिळविण्याकरिता सर्वांत कमी खर्च (म्हणजे २२ डॉलर प्रती किग्रॅ.) लागतो. हा साठा १९८० च्या आसपास संपुष्टात यावा, असा अंदाज व्यक्त करण्यात आला होता.
उपलब्ध माहितीप्रमाणे जगातील युरेनियमाचे बहुतेक सर्व शिलकी साठे कम्युनिस्टेतर देशांमध्ये आहेत, असे दिसते. १९७३ मध्ये या साठ्यांबद्दल पुढील अंदाज व्यक्त करण्यात आला होता. (आकडे टनांमध्ये): अमेरिकेची संयुक्त संस्थाने २, ५९, ००० दक्षिण आफ्रिका २, ०२, ००० कॅनडा १, ८५, ०००.
कम्युनिस्ट राष्ट्रगटात १९६० सालच्या माहितीनुसार १,००,००० ते ३,७०,००० टन शिलकी साठा असावा, असा अंदाज करण्यात आला होता. पृथ्वीच्या कवचात सु. २५ किमी. खोलीपर्यंत एकंदर १०१७ किग्रॅ., तर महासागरांखाली असणाऱ्या विभागामध्ये १०१३ किग्रॅ. युरेनियम असावे, असा पण एक अंदाज केला गेला आहे. पृथ्वीवर युरेनियम हे मूलद्रव्य सरासरीने १० लाख भागांत ४ भाग या प्रमाणात सापडते म्हणजे पृथ्वीवरील एक टन द्रव्यात युरेनियमाचा भाग ४ ग्रॅम एवढा असतो. हे मूलद्रव्य दुर्मिळ नसून त्याची विपुलता शिसे किंवा मॉलिब्डेनम या धातूंच्या विपुलतेएवढीच आहे. युरेनियमपासून होणारा किरणोत्सर्ग प्रबल स्वरूपाचा असल्यामुळे पृथ्वीवरच्या निरनिराळ्या स्थानी युरेनियम धातुक साठ्यांचा शोध घेणे किंवा पूर्वेक्षण करणे सुवाह्य गायगर गणित्राद्वारे [⟶ कण अभिज्ञातक] करणे सुलभ असते. युरेनियम धातुकामधून त्याच्या विघटन क्रियेमुळे निर्माण होणारी किंवा अन्य प्रकारे त्याबरोबर संबंधित असणारी अनेक खनिजद्रव्ये जंबुपार (दृश्य वर्णपटातील जांभळ्या रंगाच्या पलीकडील अदृश्य) प्रकाशाकरिता अनुस्फुरक (जंबुपार प्रकाश पडल्यावर दृश्य प्रकाश उत्सर्जित करण्याचा) परिणाम दाखवीत असल्यामुळे सुवाह्य जंबुपार प्रकाश उद्गमाच्या साहाय्याने त्यांचा शोध लावणे पण शक्य होते. सर्वेक्षणाची त्वरा वाढवावयाची असल्यास किरणोत्सर्गी द्रव्याचे अभिज्ञान करणाऱ्या अधिक संवेदनक्षम अशा उपकरण योजना [उदा., चमक गणित्र ⟶ कण अभिज्ञातक] मोटारगाडी वा विमान यासारख्या वाहनात ठेवून हे वाहन इष्ट विभागात फिरवून या क्षेत्रफळाची त्वरित पाहणी करता येते.
भारतात मोठ्या प्रमाणात युरेनियम असणारी धातुके आढळलेली नाहीत. जी धातुके सापडली आहेत ती बहुतेक सर्व कमी दर्जाची असून ती मुख्यत: बिहार, राजस्थान, तामिळनाडू, आसाम, मेघालय, उत्तर प्रदेश, हिमाचल प्रदेश या भागांत उपलब्ध झाली आहेत. भारतातील अणुऊर्जा प्रकल्पांना लागणारे युरेनियम पुरविण्यासाठी ऑक्टोबर १९६७ मध्ये बिहारमधील जादुगुडा येथे केंद्र सरकारच्या अणुऊर्जा विभागाने युरेनियम कॉर्पोरेशन ऑफ इंडिया लि. ही संस्था स्थापन केली. रोज सु. १,००० टन धातुक खाणीतून काढणे, त्यावर प्रक्रिया करून युरेनियम मिळविणे, तांबे व मॉलिब्डेनम संहत स्वरूपात (प्रमाण वाढविलेल्या स्वरूपात) आणि मॅग्नेटाइट उपपदार्थ म्हणून मिळविणे ही कामे या संस्थेतर्फे चालविण्यात येणाऱ्या प्रकल्पात करण्यात येतात. तेथे १९७९ – ८० मध्ये संहत स्वरूपात तांबे ३४० टन व मॉलिब्डेनम २८ टन आणि ५·९६ कोटी रु. किंमतीचे युरेनियम तयार झाले. मोनॅझाइट या थोरियमाच्या धातुकाचे प्रचंड साठे केरळ (त्रावणकोर किनारा), रांची पठार (बिहार) व प. बंगाल येथे सापडले आहेत. काही विशिष्ट प्रक्रियांच्या द्वारे उपलब्ध थोरियमाचे भंजनक्षम युरेनियम (२३३) मध्ये रूपांतरण करणे शक्य असते [⟶ थोरियम]. हे रूपांतरण करण्याकरिता भारतामध्ये कल्पकम (तामिळनाडू) येथे एक प्रकल्प कार्यान्वित करण्यात येत आहे.
धातुविज्ञान : युरेनियमाच्या धातुकांचे विविध प्रकार असल्याने व त्यांतील युरेनियमाची संहती (प्रमाण) निरनिराळी असल्याने त्यांपासून युरेनियम मिळविण्याच्या अनेक पद्धती आहेत. धातुकावर करण्यात येणाऱ्या प्राथमिक संस्कारात धातुक भाजणे, भौतिक वा रासायानिक संकेंद्रण (धातुकातील अपद्रव्ये काढून टाकून शुद्ध धातुकाचे प्रमाण वाढविण्याची क्रिया) अथवा या क्रियांचा एकत्रित उपयोग करणे यांचा समावेश होतो. रासायनिक संकेंद्रण हे प्राथमिक संस्कार म्हणून सर्वाधिक उपयोगात आहे. यात सामान्यत: अम्लीय अथवा कार्बोनेट अपक्षालन (अम्लात वा कार्बोनेटाच्या विद्रावात विरघळणारी खनिजे विरघळविण्याची क्रिया) सुरुवातीस करतात. अम्लीय अपक्षालनासाठी विरल (विद्रावातील प्रमाण कमी असलेले) सल्फ्यूरिक अम्ल वापरतात व त्यामुळे युरेनियम हे युरेनिल आयन (विद्युत् भारित रेणू) स्वरूपात विद्रावात जाते. कार्बोनेट अपक्षालनात सोडियम कार्बोनेटाच्या विक्रियेमुळे जलविद्राव्य (पाण्यात विरघळणाऱ्या) [UO2 (CO3)3]4- हा आयन तयार होतो. कोणत्याही अपक्षालन पद्धतीपासून युरेनियमाची प्राप्ती होण्यासाठी अमोनिया वा सोडियम हायड्रॉक्साइड यांच्याबरोबर विक्रिया करून अमोनियम युरेनेट वा सोडियम युरेनेट यांच्या अवक्षेपाच्या (न विरघळणाऱ्या साक्याच्या) रूपात ते मिळवितात. भौतिक आणि रासायनिक पद्धतीने मिळालेल्या संकेंद्रित धातुकावर मग रासायनिक संस्कार करून युरेनिल नायट्रेटाचा विद्राव मिळवितात व तो आणखी शुद्ध करण्यासाठी विद्रावक निष्कर्षणाची [⟶ निष्कर्षण] पद्धत वापरतात. याकरिता सध्या ट्रायब्युटिल फॉस्फेट वापरतात. युरेनियम पाण्याच्या साहाय्याने काढून घेतात आणि अतिशय शुद्ध स्वरूपातील युरेनियम हे नायट्रेट स्फटिकांच्या अथवा विद्रावातून अवक्षेपाच्या रूपात मिळवितात. नायट्रेट इतर संयुगे (उदा., ऑक्साइडे) तयार करण्यासाठी प्रारंभिक द्रव्य म्हणून वापरतात. मोठ्या प्रमाणावरील प्रक्रियेमध्ये नायट्रेटाच्या ऊष्मीय अपघटनाने (रेणूचे तुकडे करण्याच्या क्रियेने) युरेनियम ट्राय – ऑक्साइड (UO3) मिळवितात आणि मग त्याचे हायड्रोजनाच्या साहाय्याने ⇨क्षपण करून युरेनियम डाय – ऑक्साइड (UO2) मिळवितात. युरेनियम टेट्राफ्ल्युओराइड (UF4) हे युरेनियम डाय – ऑक्साइडावर हायड्रोजन फ्ल्युओराइड वायूची विक्रिया करून मिळवितात.
युरेनियम धातुकाचे अंशतः शुद्धीकरण करण्याकरिता सूक्ष्मजंतूंचा पण उपयोग करून घेण्यात आला आहे. काही खाणींमध्ये युरेनियम व पायराइट धातुके अम्लयुक्त पाण्यासमवेत आढळतात. थायोबॅसिलस फेरोऑक्सिडान्स या सूक्ष्मजंतूंना असे पाणी अनुकूल ठरते. हे जंतू पायराइटावर हल्ला करून त्यांचे सल्फ्यूरिक अम्ल व फेरिक लोखंडामध्ये रूपांतरण करतात. त्यामुळे अविद्राव्य (न विरघळणाऱ्या) युरेनियम धातुकाचे युरेनिल सल्फेटामध्ये रूपांतर होते. यापासून U3O8 हे ऑक्साइड मिळविणे सुलभ असते. सूक्ष्मजंतूंवर अशा प्रकारे आधारित असा एक प्रकल्प कॅनडामध्ये कार्यान्वित करण्यात आला आहे.
युरेनियम धातू तिच्या संगलित (वितळविलेल्या) हॅलाइडांचे विद्युत् विच्छेदन (विद्युत् प्रवाहाच्या साहाय्याने घटक अलग करण्याची क्रिया) करून अथवा अधिक विक्रियाशील धातूच्या साहाय्याने क्षपण करून मिळवितात. UO2 ची कॅल्शियमाबरोबर विक्रिया केल्यास चांगल्या दर्जाची धातू मिळते. सोडियम क्लोराइड व कॅल्शियम क्लोराइड संगलित रूपात ठेवलेल्या कुंडात UF4 चे विद्युत् विच्छेदन करून कित्येक टन अतिशय शुद्ध धातू मिळविण्यात आलेली आहे. यात मॉलिब्डेनम ऋणाग्रावर युरेनियम धातू बारीक कणांच्या रूपात साचते. UO2 च्या कॅल्शियम क्षपणात घटकांचे मिश्रण करून ते अक्रिय (रासायनिक दृष्ट्या विक्रियाशील नसलेल्या)वातावरणात ठेवून सु. १,०००० से. पर्यंत तापवितात. यामुळे बारीक कणरूपातील युरेनियम व कॅल्शियम ऑक्साइड मिळतात. या प्रक्रियेत कॅल्शियमाऐवजी कॅल्शियम हायड्रॉक्साइड वापरता येते. विद्युत् विच्छेदनाने वा कॅल्शियम – UO2 प्रक्रियेने मिळालेल्या धातूचे अपक्षालन करून तीवर दाब देऊन आणि तापपिंडन करून (साच्यात दाब देऊन आकार दिल्यावर मग भट्टीत भाजून) वा वितळवून घनरूपातील युरेनियम मिळते. संगलित डोलोमाइट ऑक्साइडयुक्त अस्तर असलेल्या बंदिस्त पोलादी पात्रात बारीक कणमय UF4 चे कॅल्शियम वा मॅग्नेशियम याबरोबर धातवीय – ऊष्मीय क्षपण करून उत्तम दर्जाचे युरेनियम सर्वाधिक प्रमाणात तयार करण्यात आले आहे.यात तयार झालेल्या धातुपिंडाचा आकार क्षपणक पात्राच्या आकारावर अवलंबून असतो.
युरेनियम धातूला ५३५° – ६५०° से. या तापमान कक्षेत सुलभपणे आकार देता येतो. यासाठी लाटण, घडाई वा बहि:सारण (तप्त मऊसर धातू मुद्रेच्या छिद्रातून रेटून तिला इष्ट आकार देण्याची क्रिया) यांसारख्या क्रिया वापरल्या जातात. या क्रिया करताना धातूची रासायनिक विक्रियाशीलता आणि तिची बहुरूपी रूपांतरणे (रासायनिक गुणधर्म तेच पण तापमानानुसार भौतिक गुणधर्म भिन्न असलेल्या रूपात होणारी रूपांतरणे) लक्षात घ्यावी लागतात. लाटण या बहिःसारण क्रियेने कच्चा आकार दिल्यावर अंतिम आकार देण्यासाठी नेहमीच्या यांत्रिक हत्यारांचा योग्य शीतनक द्रव्यासह उपयोग करतात. युरेनियमाच्या मिश्रधातू तयार करण्यासाठी घटक धातू एकत्रितपणे वितळवितात. मात्र त्यानंतरच्या धातुवैज्ञानिक प्रक्रिया अक्रिय वायुयुक्त पात्रात कराव्या लागतात कारण युरेनियमाच्या बऱ्याचशा मिश्रधातूंवर ऑक्सिजनाचा वा आर्द्रतेचा परिणाम होतो. अणुकेंद्रीय विक्रियकात वापरण्यात येणाऱ्या युरेनियमयुक्त इंधन घटकांच्या वर्णनाकरिता ‘अणुकेंद्रीय अभियांत्रिकी’ ही नोंद पहावी.
नैसर्गिक अणुकेंद्रीय विक्रियक : निसर्गात सापडणाऱ्या युरेनियमामध्ये भंजनक्षम युरेनियम (२३५) या समस्थानिकाचे प्रमाण ०·७२% एवढे असते. एक प्रकारच्या अणुकेंद्रीय विक्रियकामध्ये स्वयंपोषक विक्रिया मिळविण्याकरिता संपन्न युरेनियम [ज्यामध्ये युरेनियम (२३५) चा अंश ३% पर्यंत वाढविला आहे] व मंदायक (न्यूट्रॉनांचा वेग कमी करणारे द्रव्य) म्हणून पाणी यांचा वापर केला जातो [⟶ अणुकेंद्रीय अभियांत्रिकी]. दोन अब्ज वर्षांपूर्वी युरेनियम (२३५) या द्रव्याची निसर्गात टक्केवारी तीन एवढी होती असा अंदाज करण्यात आलेला आहे. पृथ्वीवरील खडकांचे आयुष्यमान पण सुमारे याच कोटीचे आहे. त्यामुळे पृथ्वीवर जेव्हा खडक निर्माण झाले त्या वेळी काही ठिकाणी अणुकेंद्रीय विक्रियक स्वयंसिद्धपणे कार्यान्वित होण्याकरिता लागणारी परिस्थिती निर्माण झाली असावी, असे मानता येते. पश्चिम आफ्रिकेतील गाबाँ या देशातील ऑक्लो युरेनियम खाणीत असा एक नैसर्गिक अणुकेंद्रीय विक्रियक काही दशलक्ष वर्षांपूर्वी कार्य करावयास लागून (शक्ती पातळी ≈ १० – १०० किलोवॉट) तो त्यानंतर पाच लाख वर्षांपर्यंत चालू होता, असे दर्शविणारा पुरावा उपलब्ध आहे. हा निष्कर्ष काढण्याकरिता दोन प्रकारचा पुरावा सापडतो. युरेनियम (२३५) स्वयंस्फूर्त भंजनक्रियेद्वारे ऱ्हास झाल्यामुळे सध्या तेथे सापडणारे युरेनियम (२३५) चे प्रमाण नेहमीच्या ०·७२ या टक्केवारीपेक्षा बरेच कमी प्रमाणात आढळते (०·४४ ते ०·६९%). अणुभंजन झाल्यानंतर तेथे अनेक किरणोत्सर्गी मूलद्रव्ये तयार होतात. त्यामुळे विघटनाच्या साखळी विक्रियेमुळे ८० ते १८० यांमधील द्रव्यमानांक असलेली अनेक मूलद्रव्ये मोठ्या प्रमाणात सापडतात. इतर ठिकाणी ही मूलद्रव्ये या प्रमाणात मिळत नाहीत. रुथेनियम हे एक अशापैकी महत्त्वाचे असे उत्पादन मूलद्रव्य आहे. भंजन अणुकेंद्रीय विक्रियक हा न्यूट्रॉनांच्या उत्सर्जनामुळेच स्वयंपोषक स्वरूप धारण करतो. प्रत्येक भंजन विक्रियेत सरासरीने २·५ न्यूट्रॉन उत्सर्जित केले जातात. त्यांपैकी कमीत कमी एक न्यूट्रॉन तरी भंजनक्षम युरेनियम (२३५) मध्ये शोषला गेला पाहिजे. उरलेले १·५ न्यूट्रॉन युरेनियम (२३८) मध्ये तरी शोषले जातात किंवा ते अवकाशात निसटून जातात. उत्तर ऑस्ट्रेलियामध्ये जेथे सध्या युरेनियमाचे समृद्ध साठे सापडतात, त्या ठिकाणी पूर्वी एक नैसर्गिक अणुकेंद्रीय विक्रियक कार्य करीत असावा असे तेथे विपुल प्रमाणात सापडणाऱ्या रुथेनियम मूलद्रव्याने सूचित होते. ज्या ठिकाणी सध्या युरेनियम भरपूर प्रमाणात सापडते तेथे प्राचीन काळी नैसर्गिक अणुकेंद्रीय विक्रियक असावेत, अशी एक कल्पना रूढ आहे. जगातील ज्ञात समृद्ध युरेनियम साठे कँब्रियनपूर्व काळी (सु. ६० कोटी वर्षांपूर्वीच्या काळी) निर्माण झालेल्या खडकांजवळ सापडतात ही गोष्ट या संदर्भात लक्षात घेण्याजोगी आहे. उष्णता परिणाम, रासायनिक विनाश, झीज इ. अनेक नैसर्गिक क्रियांच्या योगे हे साठे विखुरले जातात, अशी एक मीमांसा देण्यात आली आहे. ज्या खडकांमध्ये अशा प्रकारचे नैसर्गिक अणुकेंद्रीय विक्रियक कार्य करीत होते किंवा ज्या खडकांमध्ये युरेनियम पुरेशा प्रमाणात उपस्थित होते अशा खडकांमध्ये सतत उष्णता निर्माण होत होती, हे उघड आहे. या उष्णतेमुळे खडक काही वेळा अंशत: वितळल्यामुळे (किंवा ज्वालामुखीच्या उद्रेकामुळे) युरेनियम द्रव्य पृथ्वीच्या पृष्ठभागाखालील विभागातून पृष्ठभागाजवळ येऊन ते विखुरले जाण्याचीही शक्यता दिसते. सध्या पृथ्वीवरील कोणत्याही एका ठिकाणी नैसर्गिक अणुकेंद्रीय विक्रियक चालू असण्याचा संभव मात्र अत्यंत कमी दिसतो.
युरेनियमाचे संपन्नीकरण : नमुना द्रव्यामधील युरेनियम (२३५) या समस्थानिकाचे प्रमाण वाढविण्याच्या क्रियेस संपन्नीकरण असे म्हणतात. या प्रक्रियेमध्ये या समस्थानकाची टक्केवारी तीनपेक्षा कितीही जास्त मूल्याची असू शकते. अण्वस्त्रे तयार करण्याकरिता हे मूल्य अतिशय उच्च प्रतीचे असावे लागते. संपन्नीकरणाकरिता वापरण्यात येणाऱ्या काही महत्त्वाच्या पद्धतींचे वर्णन येथे दिले आहे.
वायुरूप विसरण : एका सच्छिद्र पडदीच्या एका बाजूस वायुमिश्रण व दुसऱ्या बाजूस निर्वात निर्माण केला, तर या पडदीमधून वायू विसरण पावतो (छिद्रातून वायूचे रेणू पलीकडे जातात). वायूच्या विसरणाची त्वरा वायूच्या 1 / √ घनताया राशीवर अवलंबून असल्यामुळे मिश्रणामधील हलका वायू घटक जास्त त्वरेने विसरण पावून पडदीच्या दुसऱ्या बाजूस त्याचे संपन्नीकरण होते, या तत्त्वाचा उपयोग या पद्धतीमध्ये केला आहे.
युरेनियम (२३५) व युरेनियम (२३८) हे दोन समस्थानिक हेक्झॅफ्ल्युओराइड या वायूच्या स्वरूपात वापरले जातात. या दोन प्रकारच्या अणूंकरिता या वायुरेणूंचे ग्रॅम रेणुभार (रेणूतील अणूंच्या ग्रॅममध्ये मांडलेल्या अणुभारांची बेरीज) अनुक्रमे ३४९ व ३५२ एवढे होतात. त्यामुळे त्यांच्या विसरण त्वरेत कमी मूल्याचा का होईना पण स्पष्ट असा फरक असतो.संपीडकाच्या (वायूचा दाब वाढविण्याकरिता वापरण्यात येणाऱ्या यंत्राच्या)साहाय्याने युरेनियम हेक्झॅफ्ल्युओराइड वायूचे घनफळ आकुंचित करून त्याचा दाब वाढविला जातो. या क्रियेमुळे जी उष्णता निर्माण होते ती शीतनकाद्वारा काढून घेतली जाते. थंड केलेले भरपूर दाबाचे वायुमिश्रण यानंतर सच्छिद्र नलिकेत सोडले जाते. ही नलिका तापपिंडित निकेल चूर्णांची केलेली असते. नलिकेच्या बाहेर निर्वात पंपाच्या द्वारे निर्वात निर्माण केला म्हणजे नलिकेमधून वायूचे विसरण सुरू होऊन हलका युरेनियम (२३५) युक्त वायू बाहेर जास्त त्वरेने जात राहतो व त्यामुळे त्याचे संपन्नीकरण होते. नलिकेच्या आत व बाहेर असणाऱ्या वायुदाबांत बराच फरक असल्यामुळे नलिकेमधील सूक्ष्म छिद्रांचे आकारमान पण पुरेसे लहान ठेवावे लागते. या दोन वायू घटकांच्या घनतेमधील फरक कमी असल्यामुळे एका विसरण टप्प्याद्वारे मिळणारा महत्तम विलगीकरण गुणांक १·००४३ एवढाच असतो. इष्ट मूल्याचे संपन्नीकरण प्राप्त करून घेण्याकरिता असे कित्येक हजार विसरण टप्पे एकसरीत जोडले पाहिजेत, हे उघड आहे. ओक रिज् (अमेरिका) येथे जोडून तयार केलेल्या अशा उपकरणात चार हजार टप्पे होते. ही पद्धत सर्वांत कार्यक्षम असल्यामुळे हिचा उपयोग सर्वाधिकपणे केला जातो.
या योजनेची उभारणी करण्यामध्ये अभियांत्रिकीय अडचणी कमी प्रमाणात येत असल्यामुळे या पद्धतीचा उपयोग युरेनियमाचे संपन्नीकरण करण्याकरिता अमेरिकेत मोठ्या प्रमाणात केला गेला.
केंद्रोत्सारी यंत्रयोजना : दूधावरील मलई काढण्याकरिता वापरल्या जाणाऱ्या परिभ्रमी मलई यंत्रामधील केंद्रोत्सारण तत्त्वाचाच [⟶ केंद्रोत्सारण] उपयोग या यंत्रात केलेला असतो. अणुद्रव्याचे विलगीकरण करण्याकरिता जे यंत्र वापरले जाते, त्याचा परिभ्रमी वेग मलई यंत्राच्या वेगापेक्षा अनेक पटींनी जास्त असतो. हे शक्य होण्याकरिता यामध्ये काही विशेष यांत्रिक योजना वापरलेल्या असतात. या पद्धतीमध्ये युरेनियम (२३५) या युरेनियम (२३८) हे समस्थानिक युरेनियम हेक्झॅफ्ल्युओराइड या वायूच्या स्वरूपात एका उच्च गतीने फिरणाऱ्या दंडगोलाच्या भोवतालच्या क्षेत्रात सोडले जातात. मिश्रणातील जड वायुघटक परिधीजवळ तर हलका वायुघटक दंडगोलाच्या अक्षाजवळ असे निरनिराळ्या ठिकाणी केंद्रित व्हावेत अशी अपेक्षा करता येते पण यामध्ये पुढील कारणाकरिता थोडा बदल होतो. उपकरणातील घूर्णकाच्या (फिरणाऱ्या भागाच्या) एका टोकास पोलादाच्या सुईचा आधार दिलेला असतो, तर त्याचे दुसरे टोक चुंबकीय क्षेत्राच्या नियंत्रणाद्वारे एका जागी रोखून ठेवलेले असते. घूर्णक हवेत न फिरता त्याचे परिभ्रमण उच्च निर्वातामध्ये केले जाते. या सर्व उपायांमुळे घर्षणाचे प्रमाण कमी होते व घूर्णकाला उच्च परिभ्रमी गती देता येते.
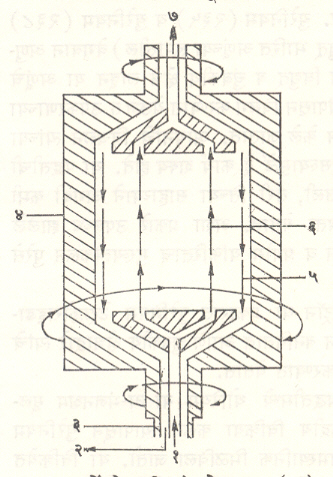 ही गती विद्युत् शक्तीद्वारा दिली जाते. या सर्व योजनेमुळे घूर्णकाच्या दोन टोकांजवळ असणाऱ्या वायूच्या तापमानात थोडा फरक पडत असल्यामुळे परिभ्रमी वायुस्तंभ काही प्रमाणात विक्षोभित होऊन त्यामध्ये उदग्र (उभ्या) अक्षीय दिशेत अभिसरण गती प्रवर्तित होते. परिणामी मूळ वायू हा फिरणाऱ्या घूर्णकाच्या मध्यभागी पुरवला असता, संपन्न केलेला वायू उपकरणाच्या वरच्या भागात एकत्रित होतो व तो तेथून काढून घेता येतो. घूर्णकाला पुरविलेला वायू एकाच समान गतीने परिभ्रमण करीत नाही, हे या पद्धतीच्या संदर्भात लक्षात ठेवण्याजोगे आहे. या पद्धतीचा उपयोग एकेकाळी अमेरिका व जर्मनी या देशांत करण्यात येत होता, पण सध्या या कार्याकरिता वायुरूप विसरण पद्धत अधिक पसंत केली जाते.
ही गती विद्युत् शक्तीद्वारा दिली जाते. या सर्व योजनेमुळे घूर्णकाच्या दोन टोकांजवळ असणाऱ्या वायूच्या तापमानात थोडा फरक पडत असल्यामुळे परिभ्रमी वायुस्तंभ काही प्रमाणात विक्षोभित होऊन त्यामध्ये उदग्र (उभ्या) अक्षीय दिशेत अभिसरण गती प्रवर्तित होते. परिणामी मूळ वायू हा फिरणाऱ्या घूर्णकाच्या मध्यभागी पुरवला असता, संपन्न केलेला वायू उपकरणाच्या वरच्या भागात एकत्रित होतो व तो तेथून काढून घेता येतो. घूर्णकाला पुरविलेला वायू एकाच समान गतीने परिभ्रमण करीत नाही, हे या पद्धतीच्या संदर्भात लक्षात ठेवण्याजोगे आहे. या पद्धतीचा उपयोग एकेकाळी अमेरिका व जर्मनी या देशांत करण्यात येत होता, पण सध्या या कार्याकरिता वायुरूप विसरण पद्धत अधिक पसंत केली जाते.
वायुरूप विसरण पद्धतीपेक्षा केंद्रोत्सारी योजनेमध्ये मिळणारा विलगीकरण गुणांक जास्त मूल्याचा असतो. हा गुणांक परिभ्रमण वेगाच्या चतुर्थ घाताप्रमाणे बदलतो असे दाखविता येते. सुरुवातीच्या काळात या पद्धतीमध्ये काही अभियांत्रिकीय स्वरूपाच्या अडचणी निर्माण झाल्यामुळे या पद्धतीचा वापर मार्गदर्शी संयंत्राच्या या टप्प्यापुढे गेला नाही. अलीकडील काळात जर्मनी व नेदर्लंड्स येथे झालेल्या नवीन संशोधनावरून असे दिसते की, लघू उत्पादनाकरिता तरी ही पद्धत सर्वांत अधिक कार्यक्षम व काटकसरीची अशी आहे.
ऊष्मीय विसरण : या उपकरणामध्ये एक उदग्र नलिका असून तिच्या बरोबर मध्यभागी विजेच्या प्रवाहाच्या साहाय्याने तप्त केलेली एक धातूची तार उभी ठेवलेली असते. युरेनियम हेक्झॅफ्ल्युओराइड वायुमिश्रण जेव्हा त्यामध्ये सोडले जाते तेव्हा तेथे दोन प्रकारचे परिणाम घडून येतात : (१) ऊष्मीय विसरणामुळे नलिकेच्या परिधीजवळच्या सापेक्षतेने थंड तापमानाच्या विभागात जड समस्थानिक घटकाचा केंद्रित होण्याकडे कल असतो. याउलट हलका समस्थानिक वायुघटक मध्यभागी असलेल्या उष्ण तारेच्या आसपास केंद्रित होताना आढळतो.(२) ऊष्मीय संनयन प्रक्रियेमुळे [⟶ उष्णता संनयन] तारेजवळचा वायू उष्ण होत असल्यामुळे तो उदग्र दिशेत सतत वर सरकत राहतो. नलिकेच्या वरच्या बाजूचा परिधीजवळचा सापेक्षतेने थंड असलेला वायू उलट दिशेने खाली नलिकेच्या बुडाकडे येत असतो. या दोन्ही प्रक्रियांच्या परिणामाने जड समस्थानिक वायू घटक नलिकेच्या बुडाशी केंद्रित होऊ लागतो, तर हलका समस्थानिक वायुघटक नलिकेच्या वरच्या बाजूस एकत्रित होऊ लागतो. अशा प्रकारे वरच्या बाजूचा वायुविभाग हा संपन्न होतो.
विद्युत् चुंबकीय क्षेत्र पद्धत : द्रव्यमान वर्णपट मापकामध्ये [⟶ द्रव्यमान वर्णपटविज्ञान] वापरल्या जात असलेल्या तत्त्वाचा उपयोग या पद्धतीमध्ये केलेला असतो. युरेनियम (२३५) व युरेनियम (२३८) यांच्या आयनीभूत (विद्युत् भारित अणूंच्या रूपातील) वेगवान अणुप्रवाहावर विशिष्ट तऱ्हेची विद्युत् व चुंबकीय क्षेत्रे लावून या अणूंचे विचलन करून ते एकमेकांपासून विलग करण्यात येऊन ते उपकरणाच्या निरनिराळ्या भागी एकत्र केले जातात. आयनांचे विचलन त्यांच्या द्रव्यमानांवर अवलंबून असल्यामुळे हे कार्य शक्य होते. या पद्धतीची कार्यक्षमता जरी उच्च असली, तरी तिच्या साहाय्याने अगदी कमी प्रमाणात मूलद्रव्ये मिळविता येतात. अशा प्रकारे उपलब्ध झालेले मूलद्रव्याचे नमुने संशोधन व प्रयोग यांकरिताच मुख्यत्वेकरून पुरेसे पडतात.
वरील पद्धतीच्या कॅलुट्रॉन या प्रकारात युरेनियम टेट्राक्लोराइडामधील मिश्र अणूंचे आयन बनवितात आणि चुंबकीय क्षेत्राद्वारे त्यांचे विचलन करून ते विलग करण्यात येतात.
प्रजनन पद्धत : या पद्धतीमध्ये थोरियम या अ – भंजनक्षम मूलद्रव्याच्या अणूवर अणुकेंद्रीय विक्रिया करून त्यापासून युरेनियम (२३३) हा भंजनक्षम समस्थानिक मिळविला जातो. या विक्रियेत थोरियम (२३२) वर मंदगती न्यूट्रॉनांचा मारा केला असता त्यांचे शोषण होऊन थोरियम (२३३) हा नवीन समस्थानिक तयार होतो. यामधून प्रथम गॅमा आणि त्यानंतर बीटा किरणांचे उत्सर्जन होते, तेव्हा त्याचे प्रोटॅक्टिनियम (२३३) या मूलद्रव्यात रूपांतरण होते. प्रोटॅक्टिनियम (२३३) मधून जेव्हा एका बीटा कणाचे उत्सर्जन होते. तेव्हा ते युरेनियम (२३३) मध्ये बदलते [⟶ प्रोटॅक्टिनियम]. अ – भंजनक्षम मूलद्रव्याचे प्रजनन प्रक्रियेद्वारे अणुकेंद्रीय विक्रियकामध्ये वापरण्यास योग्य अशा भंजनक्षम मूलद्रव्यात रूपांतरण केल्यामुळे मानवाच्या उपयोगाकरिता भंजनक्षम अशा युरेनियम मूलद्रव्याचा साठा काही शतपटीने वाढविता येतो. प्रजनन प्रक्रिया कार्यान्वित करण्याकरिता प्रखर न्यूट्रॉन उद्गमाची आवश्यकता असते. या कार्याकरिता शीघ्र प्रजनक जातीच्या विक्रियकाचा उपयोग केला जातो [⟶ अणुकेंद्रीय अभियांत्रिकी]. या पद्धतीमध्ये काही तज्ञांच्या मते दोन त्रुटी आहेत. नवीन मूलद्रव्य निर्माण करण्याकरिता लागणारा दीर्घकाळ व त्यानंतर भंजनक्षम द्रव्यास इतर द्रव्यापासून विलग करण्याकरिता लागणारे प्रयास व त्यावर होणारा खर्च ह्या त्या दोन त्रुटी होत.
लेसरद्वारा समस्थानिकांचे विलगीकरण : युरेनियम समस्थानिकाचे विलगीकरण करण्याकरिता ⇨ लेसर आधारित दोन निराळ्या पद्धती सुचविण्यात आल्या आहेत. यामध्ये तीन रंजकयुक्त लेसर उपकरण वापरले जाईल अशा प्रकारच्या लेसरमधून तीन निरनिराळ्या कंप्रतेच्या (दर सेकंदात होणाऱ्या कंपन संख्येच्या) फोटॉनांचे उत्सर्जन होते. या तीन फोटॉनांची ऊर्जा अशा मूल्याची असते की, या तीन फोटॉनांचे एकाचवेळी किंवा एकमेकांपासून एक अशा क्रमाने युरेनियम (२३३) अणूने शोषण केले, तर त्याचे आयनीकरण होईल पण युरेनियम (२३८) या अणूवर त्यांचा काही परिणाम होणार नाही, कारण या अणूचे आयनीकरण वर्चस् (अणूमधून एक इलेक्ट्रॉन काढून घेऊन तो अनंत अंतरावर नेण्यासाठी प्रती एकक विद्युत् भाराला लागणारी ऊर्जा) निराळे आहे. अशा प्रकारे युरेनियम (२३५) अणूचे विवेचकपणे आयनीकरण करून त्यास बाजूस काढता येईल.
दुसऱ्या सुचविलेल्या पद्धतीमध्ये युरेनियम हेक्झॅफ्ल्युओराइडामधील युरेनियम (२३५) या अणूला लेसर किरणाद्वारे उत्तेजित करून त्याचे विघटन केले जाते. युरेनियम (२३८) वर मात्र लेसर फोटॉनाचा काही परिणाम होत नाही. यानंतर रूढ रासायनिक पद्धतीचा उपयोग करून युरेनियम (२३५) समस्थानिक मूलद्रव्याला वेगळा करता येतो. या संकल्पनेप्रमाणे कार्य करणारे मार्गदर्शी संयंत्र १९८७ च्या सुमारास कार्यान्वित व्हावे अशी अपेक्षा आहे.
खर्चाच्या दृष्टीने पाहता ही पद्धत सर्वांत काटकसरीची ठरावी अशीही अपेक्षा आहे. एका ठराविक राशीच्या युरेनियम द्रव्याचे संपन्नीकरण करण्याकरिता वायुरूप विसरण पद्धत वापरून जर ८७ डॉलर खर्च करावा लागला, तर याच कार्याकरिता केंद्रोत्सारी यंत्र पद्धती वापरली असता सु. ६० – १०० डॉलर एवढा खर्च येतो. लेसर पद्धती वापरली असता हेच कार्य १८ – ३० डॉलरमध्ये करता येईल, असा अंदाज करण्यात आला आहे.
आयनद्रायू विलगीकरण पद्धत : (आयनद्रायू हा जवळजवळ सारख्या संख्येने असलेल्या मुक्त धन व ऋण विद्युत् भारांनी – धन आयन व इलेक्ट्रॉन यांनी – बनलेला पूर्णपणे आयनीकरण झालेला वायू असतो).
विद्युत् भार / द्रव्यमान या गुणोत्तराकरिता एक विशिष्ट मूल्य असलेले आयनच फक्त सायक्लोट्रॉन [⟶ कणवेगवर्धक] या गुणोत्तराकरिता एक विशिष्ट मूल्य असलेले आयनच फक्त सायक्लोट्रॉन [⟶ कणवेगवर्धक] या उपकरणापासून ऊर्जा घेऊ शकतात. निरनिराळ्या प्रकारचे आयन या उपकरणाद्वारे प्रवेगित करावयाचे असतील, तर त्याकरिता तद्नुरूप, चुंबकीय क्षेत्रमूल्य व रेडिओ कंप्रता विद्युत् क्षेत्राचे मूल्य बदलावे लागते. त्यामुळे सायक्लोट्रॉन निवडक्षमतेने फक्त युरेनियम (२३५) या समस्थानिकाच्या अणूंचेच आयन प्रवेगित करील अशी व्यवस्था करून युरेनियम (२३५) चे अणू विलग करता येतात. या पद्धतीने मिळणाऱ्या द्रव्याचे मान अर्थातच कमी प्रमाणाचे असते.
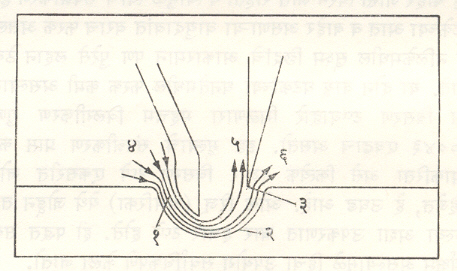 प्रोथ (तोटी) पद्धत : आ. २ मध्ये या योजनेचे स्वरूप स्पष्ट केले आहे. यामध्ये प्रोथ पट्टिका (१), वक्र भित्तिका (२) व तीक्ष्ण धारा (३) हे तीन महत्त्वाचे असे भाग असतात. उपकरणाच्या डाव्या बाजूकडून युरेनियम हेक्झॅफ्ल्युओराइड व हीलियम वायू यांच्या मिश्रणाचा पुरवठा केला जातो. प्रोथ पट्टिकेच्या उजव्या बाजूस (निर्वात पंपाद्वारे) कमी दाबाचा अवकाश निर्माण केलेला असतो. दाब प्रवणतेच्या अशा प्रकारे निर्माण केलेल्या विशिष्ट आकृतिबंधाने वायुमिश्रण हे वक्र प्रोथमार्गे प्रवास करते. वक्र गतिमार्गावर चालणाऱ्या वायुकणांवर केंद्रोत्सारी प्रेरणा कार्य करते व तिचा परिणाम कणाच्या द्रव्यमानावर अवलंबून रहात असल्यामुळे या गतिमार्गावर जड वायुघटकाचे संपन्नीकरण वक्र भित्तिकेच्या लगतच्या भागात होते. तर मिश्रणातील हलका वायुघटक आतील भागातून मार्गक्रमण करणाऱ्या प्रवाहात प्रामुख्याने आढळतो. तीक्ष्ण धारेमुळे वायुप्रवाहाचे दोन विभाग पडतात. (५) या विभागात UF6 च्या सापेक्ष हीलियम वायूचे प्रमाण वाढते (कारण हीलियम वायू जास्त हलका आहे), तर UF6 मध्ये युरेनियम (२३८) च्या सापेक्ष युरेनियम (२३५) चे प्रमाण वाढते. दुसऱ्या (६) या प्रवाहात याच्या बरोबर उलटी अशी परिस्थिती आढळते. हीलियम वायू मिसळल्यामुळे UF6 वायूचा वेग वाढतो. ही पद्धत वायुरूप विसरण पद्धतीच्या सापेक्ष सु. तिपटीने अधिक कार्यक्षम आहे.
प्रोथ (तोटी) पद्धत : आ. २ मध्ये या योजनेचे स्वरूप स्पष्ट केले आहे. यामध्ये प्रोथ पट्टिका (१), वक्र भित्तिका (२) व तीक्ष्ण धारा (३) हे तीन महत्त्वाचे असे भाग असतात. उपकरणाच्या डाव्या बाजूकडून युरेनियम हेक्झॅफ्ल्युओराइड व हीलियम वायू यांच्या मिश्रणाचा पुरवठा केला जातो. प्रोथ पट्टिकेच्या उजव्या बाजूस (निर्वात पंपाद्वारे) कमी दाबाचा अवकाश निर्माण केलेला असतो. दाब प्रवणतेच्या अशा प्रकारे निर्माण केलेल्या विशिष्ट आकृतिबंधाने वायुमिश्रण हे वक्र प्रोथमार्गे प्रवास करते. वक्र गतिमार्गावर चालणाऱ्या वायुकणांवर केंद्रोत्सारी प्रेरणा कार्य करते व तिचा परिणाम कणाच्या द्रव्यमानावर अवलंबून रहात असल्यामुळे या गतिमार्गावर जड वायुघटकाचे संपन्नीकरण वक्र भित्तिकेच्या लगतच्या भागात होते. तर मिश्रणातील हलका वायुघटक आतील भागातून मार्गक्रमण करणाऱ्या प्रवाहात प्रामुख्याने आढळतो. तीक्ष्ण धारेमुळे वायुप्रवाहाचे दोन विभाग पडतात. (५) या विभागात UF6 च्या सापेक्ष हीलियम वायूचे प्रमाण वाढते (कारण हीलियम वायू जास्त हलका आहे), तर UF6 मध्ये युरेनियम (२३८) च्या सापेक्ष युरेनियम (२३५) चे प्रमाण वाढते. दुसऱ्या (६) या प्रवाहात याच्या बरोबर उलटी अशी परिस्थिती आढळते. हीलियम वायू मिसळल्यामुळे UF6 वायूचा वेग वाढतो. ही पद्धत वायुरूप विसरण पद्धतीच्या सापेक्ष सु. तिपटीने अधिक कार्यक्षम आहे.
संपन्नीकरण प्रक्रियेत बहुतेक वेळा अंतिम उत्पादन युरेनियम हेक्झॅफ्ल्युओराइड या स्वरूपात मिळते. अणुकेंद्रीय विक्रियकांकरिता युरेनियम UO2 या ऑक्साइडाच्या स्वरूपात वापरले जाते. युरेनियम हेक्झॅफ्ल्युओराइडाचे UO2 मध्ये रूपांतर करण्याकरिता पुढील टप्पे वापरले जातात : (१) UF6 चे जलीय विच्छेदन करून (पाण्याच्या विक्रियेने रेणूचे तुकडे पाडून) त्याचे युरॅनिल फ्ल्युओराइड या विद्रावात रूपांतरण केले जाते.(२) या विद्रावाचे संहत अमोनियम हायड्रॉक्साइडाबरोबर मिश्रण करून त्यापासून अमोनियम डाययुरेनेट अवक्षेपाच्या स्वरूपात मिळविले जाते.(३) हा अवक्षेप भाजून त्यापासून प्रथम UO3 व त्यापासून क्षपण क्रियेने UO2 तयार करण्यात येते.
संपन्न युरेनियमाची बाजारातील उपलब्धता : १९४७ – ६० या कालखंडात अमेरिकेचा अणुऊर्जा कार्यक्रम जोरात कार्यान्वित होत असल्यामुळे आंतरराष्ट्रीय बाजारपेठेत युरेनियमाला चांगला भाव होता. त्यानंतर मात्र या भावात घसरगुंडी होऊन त्यामध्ये ६०% पेक्षा जास्त घट झाली (१९८०). सध्या जगात संपन्न युरेनियमाचा भरपूर साठा असून हा साठा सारखा वाढत आहे. याला दोन कारणे आहेत : (१) जपान, ब्राझील यांसारख्या देशांनी युरेनियम संपन्नीकरणाचे प्रकल्प सुरू केले आहेत.(२) अमेरिकन धातुकापेक्षा जास्त समृद्ध असे साठे कॅनडा, ऑस्ट्रेलिया इ. देशांत सापडले आहेत.
UF6 या स्वरूपातील संपन्न युरेनियमाकरिता जुलै १९६२ मध्ये असलेल्या किंमती कोष्टक क्र.२ मध्ये दिल्या आहेत.
कोष्टक क्र. २. संपन्न युरेनियमाच्या किंमती (जुलै १९६२).
|
वजनानुसार युरेनियम (२३५) प्रमाण |
किंमत (डॉलर प्रती किग्रॅ.) |
|
०·०१० |
४७·७० |
|
०·०३० |
२५४·३० |
|
०·१० |
१,०६२·०० |
|
०·२० |
२,२५२·०० |
भौतिक गुणधर्म : युरेनियमाची तापमानानुसार जी तीन प्रकारची बहुरूपे आहेत त्यांतील आल्फा (α) युरेनियम (२५° – ६६८° से.) समचतुर्भुजी स्फटिकी असून त्यात चार अणूंचे एकक असते. त्याची घनता १९·०४ ग्रॅ./सेंमी.३ अशी आहे. बीटा (β) युरेनियम (६६८° – ७७५° से.) चतुष्कोणीय स्फटिकी असून त्यात ३० अणूंचे एकक असते. त्याची घनता ७२०° से.ला १८·१३ ग्रॅ./सेंमी.३ अशी आहे. गॅमा (γ) युरेनियम (७७५° – ११३२° से.) शरीरकेंद्रित घनीय स्फटिकी असून त्यात दोन अणूंचे एकक असते. त्याची घनता ८०५° से. ला १८·०६ ग्रॅ./सेंमी.३ अशी आहे.(स्फटिकांच्या आकारासंबंधीचे स्पष्टीकरण ‘स्फटिकविज्ञान’ या नोंदीत पहावे). कोठी तापमानाला (सर्वसाधारण तापमानाला) बीटा युरेनियम थोडेसे क्रोमियम घातल्यास स्थिर होऊ शकते, तसेच गॅमा युरेनियम मॉलिब्डेनमाने स्थिर होते. कोठी तापमानाला गॅमा युरेनियमाच्या स्फटिकीय संरचनेचे स्वरूप अनन्य असल्यामुळे त्याचे बऱ्याचशा धातूंबरोबर ⇨घन विद्राव होत नाहीत पण मॉलिब्डेनम व निओबियम यांच्याशी फक्त संयुगे तयार न होता, विपुल प्रमाणात घन विद्रावही तयार होतात. ॲल्युमिनियम, बेरिलियम, बिस्मथ, कॅडमियम, कोबाल्ट, गॅलियम, जर्मेनियम, सोने, इंडियम, लोह, शिसे, मँगॅनीज, पारा, निकेल, कथिल, टिटॅनियम, जस्त व झिर्कोनियम या मूलद्रव्यांची युरेनियमाशी एक किंवा अधिक आंतरधातवीय संयुगे [इलेक्ट्रॉनीय संयुगे ⟶ मिश्रधातु] तयार होतात. क्रोमियम, मॅग्नेशियम, चांदी, टँटॅलम, थोरियम, टंगस्टन व व्हॅनेडियम तसेच कॅल्शियम, सोडियम व काही विरल मृत्तिका मूलद्रव्ये (अणुक्रमांक ५८ ते ७१ असलेली मूलद्रव्ये) यांची युरेनियमाशी आंतरधातवीय संयुगे किंवा घन विद्राव तयार होत नाहीत. युरेनियमाच्या मिश्रधातू अणुकेंद्रीय तंत्रविद्येत महत्त्वाच्या आहेत.
रासायनिक गुणधर्म : युरेनियमाच्या ऑक्सिडीकरण अवस्था [⟶ ऑक्सिडीभवन] +३, +४, +५ व +६ अशा आहेत. त्यांचे जलीय विद्रावातील आयन U3+, U4+, UO21+ आणि UO22+ असे मांडले जातात. त्यातील U4+ व U6+ (UO22+) हे आयन स्थिर असून प्रायोगिक दृष्ट्या महत्त्वाचे आहेत. U3+ आयन क्षपणकारक आहेत. त्यांचे सहजी ऑक्सिडीकरण होऊन U4+ आयन तयार होतात.जलीय U3+ आयनामुळे पाण्याचे अपघटन (रेणूचे तुकडे होण्याची क्रिया) होऊन ०° से. ला सुद्धा हायड्रोजन निघतो. U5+ आयनांचे असमान विभाजन होऊन U4+ व U6+ चे आयन तयार होतात. U4+ व U6+ या अवस्थांचे एकमेकांत रूपांतरण शक्य होते. याचा उपयोग खनिजापासून युरेनियमाचे निष्कर्षण करण्याकडे होतो. U4+ संयुगांच्या विद्रावांचा रंग हिरवा असतो व U6+ संयुगांच्या विद्रावांचा रंग पिवळा असतो. या रंग बदलांचा घनफळात्मक विश्लेषणांत उपयोग करता येतो. U3+ चे विद्राव U4+ किंवा UO22+ विद्रावांच्या विद्युत् क्षपणाने मिळवता येतात. UO21+ या ऑक्सिडीकारक अवस्थेतील आयन अस्थिर आहेत व त्यांचे असमान विभाजन होऊन U4+ व UO22+ असे आयन तयार होतात. मात्र काही घन अवस्थेतील UF5, UCI5 यांसारखी संयुगे स्थिर आहेत. U3+ संयुगे पाण्यामध्ये गडद तांबड्या रंगाचे विद्राव तयार करतात. त्यांचे पाण्याने ऑक्सिडीकरण होते.
U (IV) व U (VI) ह्या ऑक्सिडीकारक अवस्था महत्त्वाच्या आहेत. त्या दृष्टीने युरेनियमाच्या रासायनिक गुणधर्मांचा संबंध UO2 व UO3 या अनुक्रमे युरेनियम डाय – ऑक्साइड व युरेनियम ट्राय – ऑक्साइड यांच्याशी निगडित आहे. UCI4, U (SO4)2 . 9H2O यांसारखी संयुगे UO2 पासून तयार करता येतात तर UO2 (NO3)2 . 6H2O, UO2CI2 आणि UO2 SO4 . nH2O यांसारखी युरेनिल संयुगे UO3 पासून मिळतात. यात UO2+2 हा युरॅनिल मूलक असतो. षट्संयुजी युरेनियमाचा युरॅनिल आयन (UO22+) सर्वांत अधिक स्थिर आहे. या आयनाचे जलीय विच्छेदन होऊन UO2OH+ असा आयन मिळतो आणि आणखी पुढे जलीय विच्छेदन झाल्यास UO2[(OH)2 UO2]n2+ अशा तऱ्हेचे बहुवारिकी आयन (साध्या आयनांच्या संयोगाने बनणारे जटिल आयन) तयार होतात.
युरेनियम रासायनिक दृष्ट्या विक्रियाशील आहे. त्याची बहुतेक अधातू (उदा., बोरॉन, कार्बन, हायड्रोजन, क्लोरीन वगैरे) व त्यांची द्वैती संयुगे (उदा., अमोनिया, मिथेन, नायट्रोजन डाय – ऑक्साइड वगैरे) याबरोबर विक्रिया होते, चूर्ण स्वरूपात युरेनियम ज्वालाग्राही आहे.
संयुगे : हायड्राइड : (UH3). २५०° से. तापमानाला संपुंजित युरेनियमाची हायड्रोजनाबरोबर विक्रिया होऊन युरेनियम हायड्राइड तयार होते. तसेच हायड्रोजनाचे समस्थानिक ड्यूटेरियम (D), ट्रिटियम (T) यांच्या बरोबरच्या विक्रियेने UD3 व UT3 अशी ड्यूटेराइड व ट्रिटाइड तयार होतात. ही विक्रिया व्युत्क्रमी असल्याने ४५०० से. ला H2, D2 व T2 हे परत मिळतात व युरेनियमाची ज्वालाग्राही उत्तम सूक्ष्म पूड मिळते. संपुंजित युरेनियमाची पूड तयार करणे, D2 व T2 यांचा ड्यूटेराइड व ट्रिटाइड या स्वरूपात साठा करणे यांसाठी ही विक्रिया उपयोगी पडते.
युरेनियम हाइड्राइडाचे आल्फा व बीटा असे दोन स्फटिकी प्रकार आहेत. आल्फा प्रकार कमी तापमानाला मिळतो व बीटा प्रकार २५०° से.च्या वरच्या तापमानाला मिळतो. युरेनियम हायड्राइड विक्रियाशील असल्यामुळे युरेनियमची हॅलाइडे, कार्बाइडे, नायट्राइडे इं. संयुगे तयार करण्याकरिता त्याचा उपयोग होतो.
ऑक्साइडे : युरेनियम व ऑक्सिजन यांची संयुगे वैशिष्ट्यपूर्ण आहेत. तपकिरी रंगाचे युरेनियम डाय – ऑक्साइड (UO2), हिरवट काळ्या रंगाचे ट्राययुरेनियम ऑक्टॉक्साइड (U3O8) व पिवळ्या रंगाचे युरेनियम ट्राय – ऑक्साइड (UO3) ही ऑक्साइडे बऱ्याच दिवसांपासून माहीत आहेत. त्यांशिवाय युरेनियम मोनॉक्साइड (UO) व युरेनियम पेंटॉक्साइड (U2O5) हीही ऑक्साइडे तयार होतात.
युरेनियम व ऑक्सिजन यांची संयुगातील प्रावस्था जटिल स्वरूपाची आहे. त्यामुळे युरेनियम डाय – ऑक्साइड (UO2) ते युरेनियम ट्राय – ऑक्साइड (UO3) यांमध्ये कोणत्याही प्रमाणाची ऑक्साइडे तयार होऊ शकतात. त्यांचे परिमाणात्मक सूत्र UO2 ± x असे मांडता येईल (x<१). त्यांचे स्फटिक निरनिराळ्या आकारांचे असतात.
युरेनियम डाय – ऑक्साइड : (UO2).UO3 किंवा U3O8 या ऑक्साइडांचे हायड्रोजन किंवा कार्बन मोनॉक्साइड (CO) या क्षपणकारकाने ४००° – ६००° से.ला क्षपण केल्यास UO2 तयार होते. युरेनियम डाय – ऑक्साइड व प्लुटोनियम डाय – ऑक्साइड यांच्या मिश्रणाने बनविलेल्या गोळ्या अणुकेंद्रीय विक्रियकात इंधन म्हणून उपयोगी पडतात. युरेनियम डाय – ऑक्साइड संहत सल्फ्यूरिक अम्लात विरघळून युरॅनिक सल्फेट [U(SO4)2] तयार होते. यापासून दुहेरी लवणे देखील तयार होतात उदा.,K2U (SO4)3.2H2O. युरेनियम डाय-ऑक्साइडावर संहत नायट्रिक अम्लाची विक्रिया होऊन युरॅनिल नायट्रेट [UO2(NO3)2]. 3H2O तयार होते. मॅग्नेशियमासारख्या धातूने UO2 चे क्षपण होऊन युरेनियम धातू तयार होते. UO2 च्या स्फटिकामध्ये त्याच्या सूत्राप्रमाणेच ऑक्सिजन असेल असे नाही. जास्तीत जास्त UO2.15 पर्यंत किंवा कदाचित याही पेक्षा जास्त असू शकेल. घट्ट बनवलेल्या युरेनियम डाय-ऑक्साइडावर ३००° से. च्या खाली हवा अगर पाणी यांची विक्रिया होत नाही, ते चांगलेच स्थिर आहे. त्यावर अधितापनित (उकळबिंदूच्याही वर तापविलेल्या) बाष्पाचीही विक्रिया होत नाही. या बाबतीत ते अक्रिय समजले जाते. युरेनियम डाय – ऑक्साइडाचा वितळबिंदू ३,०००° से.च्या जवळपास आहे. त्याची घनता १०·९७ ग्रॅ./सेंमी.3 आहे. UO2 हे उच्चतापसह (उच्च तापमान सहन करणारे) आहे.
ट्राययुरेनियम ऑक्टॉक्साइड : (U3O8). हे ऑक्साइड युरेनियमाचे ऑक्सिजनामध्ये प्रज्वलन केले असता मिळते. युरेनियमाच्या कोणत्याही ऑक्साइडाचे ७५०° से.ला प्रज्वलन केल्यास U3O8 तयार होते. याचा रंग हिरवा ते काळा असू शकतो. त्याच्या स्फटिकाची संरचना समचतुर्भुजी असते. त्याची घनता ८·४ ग्रॅ./सेंमी.3 आहे. ६५०° ते ९००° से. या दरम्यान ऊष्मीय दृष्ट्या ते स्थिर असते. १,०००° से.ला त्यातून ऑक्सिजन बऱ्याच जलद रीत्या बाहेर पडतो. मात्र त्याचे UO2 मध्ये पूर्ण रूपांतर २,०००° से.च्या खाली होत नाही. शेवटी उच्च तापमानाला त्यापासून UO2 मिळते. U3O8 चे मिथेन,गंधक व हायड्रोजन सल्फाइड यांनी क्षपण होऊन UO2 मिळते. तसेच U3O8 चे एथिल अल्कोहॉलाची वाफ व कार्बन यांनीही उच्च तापमानाला क्षपण होऊन UO2 तयार होते. UO3 च्या ऑक्साइडाच्या ऊष्मीय अपघटनाने ६५०° से.च्या वरच्या तापमानाला U3O8 मिळते. U3O8 ची डायहायड्रोफ्ल्युओरिक अम्ल व हायड्रोक्लोरिक अम्ल यांच्याशी विक्रिया होऊन चतु:संयुजी व षट्संयुजी हॅलाइडे तयार होतात.
युरेनियम ट्राय – ऑक्साइड : (UO3). युरॅनिल नायट्रेट [UO2.(NO3)2] २५०° से.ला तापवल्यास UO3 तयार होते.याचा रंग नारिंगी आहे. त्याचे षट्कोणी स्फटिक मिळतात. शुद्ध UO3 हे युरेनियम पेरॉक्साइडा (UO4) पासून मिळते. युरेनियम ट्राय – ऑक्साइड हे अस्फटिकी स्वरूपात व कमीत कमी सहा निरनिराळ्या स्फटिकी स्वरूपांत आढळते. त्यातील गॅमा प्रकार सर्वांत स्थिर आहे. युरेनियम व ऑक्सिजन यांच्या संयुगातील प्रावस्थेचे हे एक उदाहरण आहे [⟶ घन अवस्था रसायनशास्त्र]. युरेनियम ट्राय – ऑक्साइडाची पाण्याबरोबर विक्रिया होऊन त्याच्यापासून UO2(OH)2.H2O व तीन स्फटिकी (α, β, γ) UO2 (OH)2 व U3O8 (OH)2 अशी युरॅनिल हायड्रॉक्साइडे तयार होतात. UO3 हे उभयधर्मी (अम्लाचे व क्षारकाचे – अम्लाशी विक्रिया झाल्यास लवणे देणाऱ्या पदार्थाचे – गुणधर्म असलेले) असल्यामुळे या हायड्रॉक्साइडांना अम्ले असे पण म्हणता येईल. त्यांची सूत्रे H2UO4 व H2U3O10 अशी लिहिता येतील. ही सर्व संयुगे पिवळ्या किंवा नारिंगी रंगाची आहेत. उभयधर्मी UO3 ऑक्साइडाची क्षाराबरोबर (अल्कलीबरोबर) विक्रिया केल्यास युरेनेटे मिळतात.
युरेनियम मोनॉक्साइड (UO) व पेंटॉक्साइड (U2O5) : मोनॉक्साइड सध्या तरी फारसे महत्त्वाचे नाही. ते अतिशय शुद्ध अशा युरेनियम धातूच्या पृष्ठभागावर पातळ थराच्या स्वरूपात असते. त्याचे अस्तित्व क्ष – किरणांनी पडताळून पाहिले गेले आहे. त्याचा रंग तपकिरी ते काळा असतो. ते २,०००° से.च्यावर तापवले असता त्यापासून युरेनियम डाय – ऑक्साइड व युरेनियम धातू मिळतात. ट्राय युरेनियम ऑक्टॉक्साइड कार्बन डाय – ऑक्साइडाच्या वातावरणात १,१२२° से.ला तापवल्यास युरेनियम पेंटॉक्साइड मिळते.
वर उल्लेखिलेल्या ऑक्साइडांशिवाय युरेनियमाची U4O9, U2O7, U4O7 आणि U6O17 अशीही ऑक्साइडे आहेत.
पेरॉक्साइड : युरॅनिल नायट्रेट [UO2 (NO3)2] वर हायड्रोजन पेरॉक्साइडाची विक्रिया केल्यास युरेनियम पेरॉक्साइड [UO4.2H2O] मिळते. युरॅनिल लवणामध्ये क्षारीय हायड्रॉक्साइड, हायड्रोजन पेरॉक्साइड आणि सोडियम पेरॉक्साइड घातल्यास विद्राव्य पेरॉक्सि – युरेनेटे तयार होतात.उदा., Na2UO6·4H2O आणि Na4UO8·8H2O.
युरेनेटे व डाययुरेनेटे : या संयुगांचा ऑक्साइडाशी घनिष्ट संबंध आहे. सोडियम डाय – युरेनेट (Na2U2O7·6H2O) याला बाजारात ‘युरेनियम यलो’ असे म्हणतात. ते मृत्तिका पात्रे रंगवण्याकरिता आणि पिवळी अनुस्फुरक काच बनविण्याकरिता वापरतात. सोडियम युरेनेट (Na2UO4) तयार करणे हे सोडियम डाय – युरेनेट तयार करण्यापेक्षाही अवघड आहे. ही संयुगे क्रोमेटे व डायक्रोमेटे यांसारखी आहेत परंतु त्याचे ऑक्सिडीकारक गुणधर्म कमी आहेत.
युरेनियम नायट्राइडे व कार्बाइडे : युरेनियम व नायट्रोजन यांची सरळ विक्रिया होऊन नायट्राइडांची विस्तृत श्रेणी तयार होते.UN, U2N3 व UN2 अशी नायट्राइडे होतात.UN2 हे उच्च दाबाखाली तयार करावे लागते.
युरेनियमाची मोनोकार्बाइड (UC), सेस्क्वी कार्बाइड (U2C3) व डायकार्बाइड (UC2) अशी तीन कार्बाइडे तयार होतात. ती वितळलेल्या युरेनियम किंवा ऑक्साइड यांच्याशी ग्रॅफाइटाची विक्रिया करून मिळतात. युरेनियमाची कार्बाइडे तशी अक्रिय व अर्धधातवीय आहेत. युरेनियम मोनोनायट्राइड हवेच्या अनुपस्थितीत २,०००° से. च्या वरच्या तापमानाला देखील स्थिर आहे. मोनोकार्बाइड हेसुद्धा उच्चतापसह आहे. कार्बाइडे आणि नायट्राइडे यांचे हवेमध्ये प्रज्वलन केल्यास दोन्हीपासून U3O8 मिळते.
हॅलाइडे : युरेनियम हॅलाइडे हा एक युरेनियम संयुगांचा महत्त्वाचा गट आहे. युरेनियम टेट्राफ्ल्युओराइड (UF4) हे संयुग युरेनियम धातू व युरेनियम हेक्झॅफ्ल्युओराइड यांच्या प्राप्तीचे मध्यस्थ संयुग आहे. शिवाय UF4 पासून इतर फ्ल्युओराइडे तयार करता येतात. युरेनियमाची पुढील हॅलाइडे मिळविण्यात आलेली आहेत : UF3, UF4, UF5, UF6, U2F9, U4F17, UCI3, UCI4, UCI5, UCI6, UBr3, UBr4, UI3, UI4. युरेनियम हेक्झॅफ्ल्युओराइडचा वितळबिंदू ६४° से. व उकळबिंदू ५६° से. असा आहे. (१,१४० मिमी. पाऱ्याच्या स्तंभाइतका दाब असताना). ते साठवण्याकरिता ज्यावर त्याची विक्रिया होणार नाही अशी पात्रे लागतात. तांबे, निकेल, ॲल्युमिनियम, मोनेल किंवा ज्यामध्ये फ्ल्युओरीन अणू आहेत. अशी टेफ्लॉनासारखी बहुवारिके यांची पात्रे करून त्यात UF6 ची साठवण केली जाते. युरेनियम हेक्झॅफ्ल्युओराइड सामान्य स्थितीत घनरूप असून त्याचा बाष्पदाब कोठी तापमानाला १२० मिमी. आहे. त्याचे सहज रीत्या संप्लवन (द्रवरूपात न जाता एकदम बाष्पात रूपांतर) होऊ शकते. युरेनियम संयुगांमध्ये हे सर्वाधिक बाष्पनशील (बाष्परूपात उडून जाणारे) आहे.UF6 चा रेणुभार जास्त असूनदेखील वायुरूप UF6 हा एक आदर्श वायू [⟶ द्रव्याचा गत्यात्मक सिद्धांत] आहे. युरेनियम हेक्झॅफ्ल्युओराइडाचा युरेनियमाचे समस्थानिक अलग करण्याकरिता उपयोग होतो.
युरेनियम हॅलाइडांची ऑक्सिजनाशी विक्रिया होऊन प्रथम युरॅनिल संयुगे तयार होतात व शेवटी U3O8 मिळते. UO2F2, UOCI2, UO2CI8, UO2Br2 अशा तऱ्हेची ऑक्सिहॅलाइडे तयार होतात. ही सर्व जलविद्राव्य आहेत. त्यांची स्थिरता फ्ल्युओराइड ते आयोडाइड अशी कमी होत जाते.
युरॅनिल लवणे : युरॅनिल नायट्रेट हेक्झॅहायड्रेट [UO2(NO3)2·6H2O] हे विरल नायट्रिक अम्लाच्या विक्रियेने मिळते. संहत नायट्रिक अम्लाच्या विक्रियेने ट्रायहायड्रेट व वाफाळ नायट्रिक अम्लाने डायहायड्रेट तयार होते. युरॅनिल नायट्रेट हेक्झॅहायड्रेट हे ‘UNH’ या संक्षिप्त रूपाने ओळखले जाते. UO2+2 हा ऋणायन (विद्रावातून विद्युत् प्रवाह जाऊ दिल्यास ऋणाग्राकडे जाणारा आयन) असलेल्या लवणात नायट्रेट महत्त्वाचे आहे. त्याचा रंग पिवळा ते हिरवट पिवळा असतो. एकोणिसाव्या शतकाच्या मध्यापासून युरॅनिल नायट्रेटाचे एक वैशिष्ट्य माहीत झाले होते ते असे की, युरॅनिल नायट्रेटाच्या विद्रावाचे कार्बनी विद्रावकाने (विरघळणाऱ्या पदार्थाने उदा., डायएथिलईथर) निष्कर्षण करता येते. त्यामुळे युरेनियम बाकीच्या धातवीय आयनांपासून अलग करता येते. युरॅनिल नायट्रेट पाण्यामध्ये भरपूर प्रमाणात विद्राव्य आहे. युरॅनिल सल्फेट [UO2SO4·3H2O] हेही पाण्यात विद्राव्य आहे. क्षारीय सल्फेटाबरोबर दुहेरी सल्फेटे तयार होतात. उदा., K2UO2 (SO4)2·2H2O. कार्बनी अम्लाबरोबर युरॅनिल लवणे तयार होतात उदा., युरॅनिल फॉर्मेट [UO2·(HCOO) 2·H2O], युरॅनिल ॲसिटेट [UO2 (CH3COO)2· 2H2O] आणि युरॅनिल ऑक्झॅलेट [UO2C2O4·3H2O].
परिमाणात्मक निश्चिती : युरेनियमाच्या परिमाणात्मक निश्चिततेच्या बऱ्याच पद्धती उपलब्ध आहेत. स्थूलमानीय राशीचे भारात्मक व घनफळात्मक पद्धतीने विश्लेषण करता येते. भारात्मक पद्धतीत हवेत किंवा ८ – हायड्रॉक्सि – क्विनोलेटाबरोबर प्रज्वलन करून U3O8 मिळते. त्याचे वजन करून युरेनियमाचे परिमाण काढता येते. घनफळात्मक पद्धतीत प्रथम शिशाने किंवा जस्ताने क्षपण करून मग पोटॅशियम डायक्रोमेट, सेरिक सल्फेट, पोटॅशियम ब्रोमेट किंवा पोटॅशियम परमँगॅनेट यांसारख्या ऑक्सिडीकारकांनी ⇨अनुमापन करून परिमाण काढता येते. युरेनियम सूक्ष्म मात्र असेल, तर त्याचे वर्णमापन, ध्रुवणलेखन, अनुस्फुरण वगैरे पद्धतींनी मापन करता येते [⟶ वैश्लेषिक रसायनशास्त्र] दिलेल्या नमुन्यातील समस्थानीय संघटन ⇨ द्रव्यमान वर्णपटविज्ञान पद्धतीने काढता येते.
अभिज्ञान : (अस्तित्व ओळखणे). किंचित अम्लित केलेल्या विद्रावात वाजवीपेक्षा अधिक पोटॅशियम आयोडाइड (KI) व सोडियम थायोसल्फेट (Na2S2O3) यांचे विद्राव घालून नंतर त्यातला एक थेंब गाळण कागदावर घेऊन त्यावर पोटॅशियम फेरोसायनाइड [K4Fe(CN)6] विद्रावाचा एक थेंब टाकल्यावर तपकिरी रंग आल्यास युरेनियमाचे अस्तित्व सिद्ध होते. ही कसोटी विशेषक आहे. या कसोटीची संवेदनक्षमता १०–४ मोलर युरेनियम इतकी आहे. (एक ग्रॅम रेणू एका लिटर विद्रावात विरघळविले असता एक मोलर विद्राव तयार होतो).
संदर्भ : 1. Cordfunke, E. H. P. The Chemistry of Uranium, Amsterdam, 1970.
2. Cowan, G. A. Nature’s Nuclear Reactor, Britannica, Year Book of Science and Future, Chicago, 1978.
3. Hogerton, J. F., Ed., Atomic Energy Handbook, New York, 1963.
4. Patton, F. S. and others, Enriched Uranium Processing, New York, 1963.
5. Seaborg, G. T. Corliss, W. R. Man and the Atom, New York. 1971.
6. Wilkinson, W. D. Uranium Metallurgy, New York, 1963.
चिपळोणकर, व. त्रिं. घाटे, रा. वि.
“