क्लोरीन : वायुरूप, अधातवीय (धातूहून निराळे गुणधर्म असलेले), हॅलोजन गटातील (फ्ल्यूओरीन, ब्रोमीन आणि आयोडीन यांच्या गटातील) एक मूलद्रव्य सूत्र Cl आवर्त सारणीतील (मूलद्रव्यांच्या विशिष्ट पद्धतीने केलेल्या कोष्टकरूप मांडणीतील) गट ७ अणुक्रमांक (अणुकेद्रांतील प्रोटॉनांची संख्या) १७ अणुभार ३५·४५७ स्थिर समस्थानिक (एकाच अणुक्रमांकाचे पण भिन्न अणुभार असलेले त्याच मूलद्रव्याचे प्रकार) ३५ व ३७ किरणोत्सर्गी (कण वा किरण बाहेर फेकण्याचा गुणधर्म असलेले) समस्थानिक ३३, ३४, ३६, ३८, ३९ व ४० विद्युत् विन्यास (इलेक्ट्रॉनांची अणूतील मांडणी ) २, ८, ७ घनता ३·२१४ ग्रॅ./लि. (०० से. तापमान व १ वातावरण दाब असताना) द्रवरूप क्लोरिनाचा उकळबिंदू -३४·१५० से. आणि घनरूप क्लोरिनाचा वितळबिंदू- १०१० से. क्रांतिक तापमान (जास्तीत जास्त दाब असताना वायूचे द्रवात रूपातंर होण्याचे तापमान) १४४° से. क्रांतिक दाब ७६ वातावरणे क्रांतिक घनफळ १·७६३ ग्रॅ./ मिलि. व क्रांतिक घनता ०·५७३ ग्रॅ./मिलि. असते.
कोठी तापमानास (सर्वसाधारण तापमानास) हा पोपटी हिरव्या रंगाच्या वायुरूपात असून त्याचा रेणू द्विआण्विक (दोन अणूंचा बनलेला) Cl2 असा असतो.
इतिहास : हा वायू १७७४ मध्ये के डब्ल्यू. शेले यांनी हायड्रोक्लोरिक अम्ल व मँगॅनीज डाय-ऑक्साइड यांच्या विक्रियेने प्रथम तयार केला. त्यांनी त्याला ‘डिफ्लॉजिस्टिकेटेड म्युरिॲटिक अम्ल-वायू’ असे नाव दिले, कारण त्या काळी हायड्रोक्लोरिक अम्लाला म्युरिॲटिक अम्ल असे म्हणत. बर्थेलॉट (बेर्तॉले) यांनी १७८५ मध्ये असे प्रतिपादन केले की, हा वायू म्युरिॲटिक अम्लावर मँगॅनीज डाय-ऑक्साइड या ऑक्सिडीकारकाची [→ ऑक्सिडीभवन] विक्रिया होऊन तयार होतो, तेव्हा त्यामध्ये ऑक्सिजन असला पाहिजे म्हणजे म्हणून त्याला ‘ऑक्सिम्युरिॲटिक अम्ल’ ही संज्ञा देणे सयुक्तिक होईल. परंतु १८१० मध्ये डेव्ही यांनी असे दाखविले की, ऑक्सिम्युरिॲटिक अम्लाचे अपघटन (मूळ रेणूंचे लहान रेणूंत अथवा अणूंत रूपांतर) केले, तर ऑक्सिजन असलेले संयुग मिळत नाही. म्हणून हा वायू एक मूलद्रव्य आहे आणि म्युरिॲटिक अम्ल हे संयुग हायड्रोजन व हे मूलद्रव्य यांपासून बनलेले आहे.
या वायूचा रंग पोपटी असतो म्हणून पोपटी रंग या अर्थाच्या ‘क्लोरस’ या ग्रीक शब्दावरून त्याला त्यांनी क्लोरीन हे नाव दिले.
क्लोरीन विक्रियाशील असल्यामुळे तो सामान्यतः शुद्ध स्वरूपात आढळत नाही. फक्त ज्वालामुखीतून बाहेर पडणाऱ्या अति-उष्ण वायू मिश्रणात तो दिसून येतो. पृथ्वीच्या कवचामध्ये क्लोरिनाचे प्रमाण ०.०५५ टक्का आहे. समुद्रातील लवणे व खनिज मीठ (सैंधव) यांत तो विद्राव्य (विरघळणाऱ्या) क्लोराइडांच्या रूपांत विपुलतेने आणि हॉर्न सिल्व्हर (सिल्व्हर क्लोराइड) या अविद्राव्य लवणाच्या रूपात अल्प प्रमाणात आढळतो. क्लोराइडांच्या रूपांत क्लोरीन प्राण्यांना आवश्यक आहे. मूलद्रव्य या रूपात जी रसायने टनावारी इतक्या मोठ्या प्रमाणात वापरली जातात त्यांमध्ये क्लोरिनाचा समावेश होतो.
एकोणिसाव्या शतकाच्या अखेरीस एकदिश विद्युत् जनित्राचा पूर्णपणे विकास झाला व तेव्हापासून मिठाच्या जलीय विद्रावाचे विद्युत् विच्छेदन करून (विद्युत् प्रवाहाने रेणूचे तुकडे करून) दाहक (कॉस्टीक) सोडा आणि त्याबरोबर क्लोरीन उत्पादन करण्याची पद्धत औद्योगिक दृष्ट्या साध्य झाली. या पद्धतीने मिळणारा क्लोरीन स्वस्त पडतो आणि तो जास्त शुद्धही असतो.
उत्पादन : मिठाच्या विद्रावातून एकदिश विद्युत् प्रवाह जाऊ दिला म्हणजे धन विद्युत् भारित सोडियम आयन (विद्युत् भारित अणू) (Na+) ऋणाग्राकडे व ऋण विद्युत् भारित क्लोराइड आयन (Cl–) धनाग्राकडे जाऊ लागतात. तेथे पोहोचल्यावर त्यांचे विद्युत् भार नष्ट होऊन त्यांचे रेणू बनतात. क्लोरीन उत्पादन करताना हे रेणू एकमेकांत मिसळून पुन्हा संयोग पावणार नाहीच, याची खबरदारी घ्यावी लागते. त्याकरिता काही यंत्रसंचामध्ये त्यांना वेगवेगळे ठेवण्यासाठी ॲस्बेस्टसाचा पडदा वापरतात, तर काहींमध्ये त्याकरिता पाऱ्याचा उपयोग करतात.
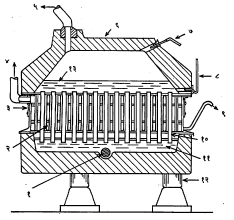
पडद्याची योजना असलेल्या ‘हूकर-घट’ नामक यंत्रसंचामध्ये साधारण घनाकृती असा पोलादी किंवा काँक्रिटाचा घट असून त्याला काढता घालता येईल असे काँक्रिटाचे झाकण असते (आ. १). घटात विद्राव भरण्याकरिता आणि क्लोरीन बाहेर पडण्याकरिता या झाकणास नळ्या बसविलेल्या असतात. घटाच्या तळभागात शिशाचा थर असतो आणि त्यात अनेक धनाग्रे बसविलेली असतात. ती ग्रॅफाइटाच्या ठोकळ्यांची बनविलेली असून एका रांगेत व एकासमोर एक येतील आणि दोन ठोकळ्यांच्या मधे काही जागा मोकळी राहील अशी त्यांची मांडणी केलेली असते. या मोकळ्या जागेतून मिठाचा विद्राव वाहतो. शिवाय याच जागेत ऋणाग्रांची मालिका बसावी अशी योजना असते. ऋणाग्रे लांब जाड पट्ट्यांच्या आकाराची असून ती जाड तारांच्या जाळ्यांपासून बनविलेली असतात. त्यांच्या पृष्ठभागावर ॲस्बेस्टसाच्या धाग्यांचा थर दिलेला असतो. हा थर म्हणजेच या घटातील पडदा होय.
ऋणाग्रे एका पोलादी सांगाड्यावर बसविलेली असतात. सांगाडा घटात बसविला म्हणजे धनाग्रांच्या मधील मोकळ्या जागेत ऋणाग्रे बसतात. नंतर झाकण बसवून मिठाचा विद्राव आत सोडला म्हणजे तो प्रथम धनाग्राजवळ येतो व तेथून पडद्यातून झिरपून ऋणाग्रापाशी जातो. विद्युत् विच्छेदनाने निर्माण झालेला क्लोरीन धनाग्रांशी मुक्त होतो व झाकणातील नळीतून बाहेर पडतो. त्यावेळी त्याचे तापमान सु. ८५° से. असते व त्यामध्ये पाण्याची वाफ, कार्बन डाय-ऑक्साइड, हायड्रोजन व हवा यांती भेसळ असते. ऋणाग्रांशी निर्माण झालेल्या सोडियमापासून पाण्याच्या विक्रियेने दाहक सोडा बनतो.
ज्या यंत्रसंचात पारा वापरतात त्यातील पात्राचे दोन विभाग असतात (आ. २). पहिला विभाग (‘ब्राइन’ उपघट) म्हणजे एक अरुंद व लांब अशी झाकण असलेली पोलादी टाकी असते. तिचा तळ थोडा उतरता असतो. टाकीच्या बाजू आणि झाकण यांवर एबोनाइटाचे किंवा रबरी अस्तर असते. टाकीच्या तळाशी पारा असतो. तो व मिठाचा विद्राव एकाच दिशेने वाहतात. झाकणाच्या आतील बाजूला ग्रॅफाइटाच्या ठोकळ्यांची अनेक धनाग्रे लावलेली असतात. पाऱ्याचा थर हाच येथे ऋणाग्राचे कार्य करतो. विद्युत् विच्छेदन होऊन निर्माण झालेला क्लोरीन झाकणात असलेल्या नळीच्या मार्गाने बाहेर पडतो. याच वेळी निर्माण झालेला सोडियम पाऱ्याशी मिश्र होऊन सोडियम-पारदमेल (सोडियम व पारा यांचे संयुग) बनते. ते यंत्रसंचातील दुसऱ्या विभागात (‘सोडा’ उपघट) नेले जाते. तेथे पाण्याशी त्याची विक्रिया होते व दाहक सोडा व हायड्रोजन निर्माण होतो आणि ते वेगळे काढले जातात. बाहेर पडणाऱ्या क्लोरिनाचे तापमान सु. ७०० से. असते व त्यात वरील प्रमाणेच भेसळही असते.
घटातून बाहेर पडणारा क्लोरीन साठा करण्यापूर्वी थंड करावा लागतो. तसेच त्यातील भेसळही दूर करावी लागते. त्याकरिता घटातून मिळणारा वायुप्रवाह शीतक नळ्यांच्या किंवा शीतक मनोऱ्यांच्या योगाने थंड करतात. त्यानंतर त्यातील जलांश काढून टाकण्यासाठी तो वायुप्रवाह शुष्कक मनोऱ्यातून घालविला जातो. या मनोऱ्यामध्ये क्लोरिनाचा प्रवाह खालून वर जात असतो व संहत (विद्रावात जास्त प्रमाण असलेले) सल्फ्यूरिक अम्ल वरून खाली पडत असते. त्यामुळे क्लोरिनामधील जलांश शोषून घेण्याचे कार्य सुकर होते. घटातून मिळालेल्या क्लोरिनात मिठाच्या विद्रावाचाही किंचित अंश असतो. मनोऱ्यातील सल्फ्यूरिक अम्लाच्या योगाने त्याचे सोडियम सल्फेटात रूपांतर होऊन त्याचे अत्यंत सूक्ष्म कण क्लोरिनाबरोबर येण्याचा संभव असतो. म्हणून अखेरीस हा वायुप्रवाह काचेच्या तंतूंनी भरलेल्या गाळणपात्राच्या योगाने गाळून घेतात व नंतर दाबयंत्राच्या साहाय्याने क्लोरीन द्रवरूप करून साठवितात. दाबयंत्राचे अनेक प्रकार आहेत. त्यांपैकी सल्फ्यूरिक अम्लाचे ‘सील’ असलेली दाबयंत्रे विशेष प्रचारात आहेत.

द्रवीकरण करण्यापूर्वी फ्रिऑन वायूचा उपयोग केलेल्या उष्णता विनिमयकाच्या (एका पदार्थाची उष्णता काढून घेऊन दुसऱ्या पदार्थाला देणाऱ्या प्रयुक्तीच्या) योगाने क्लोरिनाचे तापमान २०० से. इतके खाली आणतात व २ ते ३ वातावरणे इतका दाब देऊन क्लोरीन द्रवरूप बनवितात. द्रवरूप क्लोरीन मोठ्या दंडगोलाकार टाक्यांमध्ये साठविला जातो व त्यांमधून लहान-मोठ्या सिंलिंडरांत किंवा रेल्वेने पाठवावयाच्या टाक्यांत भरून ग्राहकांस पुरविला जातो.
इतर उत्पादन पद्धती : (१) मिठाच्या विद्रावाऐवजी पोटॅशियम क्लोराइडाच्या विद्रावाचे विद्युत् विच्छेदन केले असता क्लोरीन व दाहक पोटॅश मिळतात. दाहक पोटॅशाच्या उत्पादनाकरिता ही पद्धत वापरतात.
(२) मीठ जलविद्रावाच्या रुपात न वापरता ते वितळलेल्या स्थितीत घेऊन त्याचे विद्युत् विच्छेदन करण्याच्याही काही पद्धती उपलब्ध आहेत.
(३) मिठाऐवजी मॅग्नेशियम क्लोराइड घेऊन आणि वितळलेल्या स्थितीत त्याचे विद्युत् विच्छेदन करून मॅग्नेशियम धातू मिळविता येते. याच वेळी कोरडा असलेला क्लोरीनही निर्माण होतो.
क्लोरीन उत्पादनात यंत्रसंचाचे संक्षारण (रासायनिक क्रियेने नाश) होण्याची शक्यता असते म्हणून दमट क्लोरिनाशी संपर्क होत असेल तेथे रबरी अस्तर असलेले पोलाद, पॉलिव्हिनिल क्लोराइड, काच, अम्लरोधक पाषाण किंवा विटा, सिमेंट व टँटॅलम यांचा आणि कोरड्या क्लोरिनाशी संपर्क असेल तर पोलाद, गनमेटल, निष्कलंक पोलाद (स्टेनलेस स्टील), मोनेल धातू व हॅस्टॉलाय यांचा उपयोग करतात.
भारतात दाहक सोडा तयार करणाऱ्या कारखान्यांत क्लोरीन हा उपपदार्थ म्हणून मिळतो. सुरुवातीस हा वायू त्याचा वापर कमी असल्याने वाया जात असे. जसजसा क्लोरिनाचा उपयोग विविध धंद्यांत होऊ लागला, तसतसा वाया जाणाऱ्या क्लोरिनाचा उपयोग करण्यात येऊन दाहक सोड्याची किंमत कमी झाली. कॅल्शियम कार्बोनेटाचा उपयोग क्लोरीनवाहक म्हणून केला जातो. क्लोरीन निर्मितीच्या या दोन्ही पद्धती भारतात वापरल्या जातात.
रासायनिक गुणधर्म : उष्ण केलेल्या धातूवर याची विक्रिया होऊन क्लोराइडे बनवतात. उदा., सोडियमापासून सोडियम क्लोराइड. ज्या धातूंना वेगवेगळ्या संयुजा (इतर अणूंशी संयोग पावण्याची शक्ती दर्शविणारे अंक) असतात, त्यांच्यापासून सर्वांत उच्च संयुजा असलेले क्लोराइड बनते. उदा., लोहापासून फेरिक क्लोराइड (FeCl3), तांब्यापासून क्युप्रिक क्लोराइड (CuCl2). अनेक अधातूंशी क्लोरिनाचा प्रत्यक्ष रासायनिक संयोग होतो. हायड्रोजनापासून हायड्रोक्लोरिक अम्ल मिळते. नेहमीच्या तापमानास व सूर्यप्रकाश नसेल तर ही विक्रिया सावकाश होते, परंतु वायुमिश्रण तापविले तर ही विक्रिया होताना स्फोट होते. फॉस्फरस, आर्सेनिक व अँटिमनी यांपासून मुख्यतः ट्रायक्लोराइडे मिळतात. अक्रिय (रासायनिक विक्रियेत सहज भाग न घेणारे) वायू (हीलियम, आर्गॉन, निऑन इ.), नायट्रोजन, ऑक्सिजन आणि कार्बन यांच्याशी त्याचा प्रत्यक्ष संयोग होत नाही. त्यांची क्लोराइडे अप्रत्यक्षपणे मिळवावी लागतात.
|
क्लोरीन वायू अनेक संयुगांचे ऑक्सिडीकरण करतो. त्यामुळे हायड्रोजन सल्फाइडापासून सल्फर (गंधक), सल्फ्यूरस अम्लापासून आणि सोडियम थायोसल्फेटापासून सल्फ्यूरिक अम्ल बनते. फेरस (द्विसंयुजी लोह) आणि स्टॅनस (द्विसंयुजी कथिल) आयनांचे फेरिक (त्रिसंयुजी लोह) व स्टॅनिक (त्रिसंयुजी कथिल) आयनांत ऑक्सिडीकरण होते.
अमोनियाच्या ऑक्सिडीकरणाने नायट्रोजन निर्माण होतो. क्लोरीन अतिरिक्त असेल, तर या विक्रियेमुळे नायट्रोजन ट्रायक्लोराइड बनते.
| 2NH3 | + | 3Cl2 | → | N2 | + | 6HCl |
| अमोनिया | क्लोरीन | नायट्रोजन | हायड्रोक्लोरिक अम्ल |
| NH3 | + | 3Cl2 | → | NCl3 | + | 3HCl |
| अमोनिया | क्लोरीन | नायट्रोजन ट्रायक्लोराइड | हायड्रोक्लोरिक अम्ल |
पण अमोनिया अतिरिक्त असेल, तर अमोनियम क्लोराइड बनते.
| 4NH3 | + | Cl2 | → | 2NH4Cl | + | N2H4 |
| अमोनिया | क्लोरीन | अमोनियम क्लोराइड | हायड्राझीन |
आर्सेनाइटाचे ऑक्सिडीभवन होऊन आर्सेनेटे बनतात.
ब्रोमाइडापासून ब्रोमीन व आयोडाइडापासून आयोडीन मुक्त होते.
पोटॅशियम आयोडाइडावर होणाऱ्या विक्रियेचा उपयोग क्लोरिनाचे मापन करण्याकरिता करतात. कारण त्यामध्ये मुक्त झालेल्या आयोडिनाचे मापन सोडियम थायोसल्फेटाच्या ज्ञातमूल्य (ज्यामध्ये विरघळवलेला पदार्थ किती आहे हे ठाऊक आहे आशा) विद्रावाने करता येते.
क्लोरीन पाण्यात काही प्रमाणात विरघळतो. या विद्रावाचा रंग पिवळसर असून त्याला क्लोरिनाचा वास येतो. सूर्यप्रकाशात क्लोरिनाची पाण्यावर विक्रिया होऊन हायड्रोक्लोरिक अम्ल व हायपोक्लोरस अम्ल निर्माण होते. हायपोक्लोरस अम्लाचे अपघटन होऊन ऑक्सिजन मुक्त होतो. या ऑक्सिजनामुळे रंजकद्रव्याचे ऑक्सिडीभवन होऊन रंग नाहीसा होतो.
| Cl2 | + | H2O | → | HCl | + | HOCI |
| क्लोरीन अम्ल | पाणी | हायड्रोक्लोरिक अम्ल | हायपोक्लोरस अम्ल |
सोडीयम हायड्रॉक्साइडाच्या थंड व विरल विद्रावाशी क्लोरिनाची विक्रिया होऊन सोडियम हायपोक्लोराइट (NaOCI), सोडियम क्लोराइड व पाणी निर्माण होते. सोडियम हायड्रॉक्साइडाचा विद्राव उष्ण व संहत असेल, तर सोडियम क्लोरेट (NaClO3), सोडियम क्लोराइड व पाणी बनते.
क्लोरीन असंतृप्त (ज्यांमद्ये द्विबंध किंवा त्रिबंध आहेत अशा) हायड्रोकार्बनाशी समावेशन (इतर अणू अथवा अणुगट रेणूत सामावून घेणे) विक्रियेने व संतृप्त हायड्रोकार्बनाशी प्रतिष्ठापन (एक अणू अथवा अणुगट काढून त्याच्या जागी दुसरा बसविणे) पद्धतीने संयोग पावतो.
संयुगे : क्लोरिनाची ऑक्साइडे, हायपोक्लोराइटे, क्लोराइटे, क्लोरेटे, क्लोराइडे इ. संयुगे आहेत. त्यांतील महत्त्वाची खाली दिली आहेत.
क्लोरीन मोनॉक्साइड : Cl2O. कोरड्या मर्क्युरिक ऑक्साइडावर क्लोरीन प्रवाहित केल्यास क्लोरीन मोनॉक्साइड बनते. हे ऊष्माग्राही (उष्णता घेणारे), अत्यंत स्फोटक व प्रबल ऑक्सिडीकारक संयुग आहे. पाण्याशी त्याचा संयोग होऊन हायपोक्लोरस अम्ल बनते.
| 2HgO | + | 2Cl2 | → | HgO.HgCl2 | + | Cl2O |
| मर्क्युरिक ऑक्साइड | क्लोरीन | मर्क्युरिक ऑक्सिक्लोराइड | क्लोरीन मोनॉक्साइड |
क्लोरीन डाय-ऑक्साइड : ClO2. पोटॅशियम क्लोरेट, सल्फूरिक अम्लाबरोबर तापविले म्हणजे क्लोरीन डाय-ऑक्साइड बनते. हे पिवळ्या रंगाचे, ऊष्माग्राही व अत्यंत स्फोटक संयुग आहे. त्याचा उकळबिंदू ११० से. आहे.
क्लोरीन ट्रायऑक्साइड : Cl2O6. क्लोरीन डाय-ऑक्साइडावर ओझोनाची विक्रिया झाली म्हणजे क्लोरीन ट्रायऑक्साइड बनते. हा गडद तांबड्या रंगाचा द्रव असून तो उच्च तापमानाला हळूहळू अपघटन पावतो.
क्लोरीन हेप्टॉक्झाइड : Cl2O7. परक्लोरिक अम्लाचे (HClO4) फॉस्फरस पेंटॉक्साइडाने -१०० से. ला निर्जलीकरण केल्यास क्लोरीन हेप्टॉक्साइड बनते. हे एक वर्णहीन दाट द्रव असून ८३० से. ला उकळते. पाण्याशी विक्रिया होऊन यापासून परक्लोरिक अम्ल मिळते. हे ऊष्माग्राही आहे, परंतु इतर ऑक्साइडांपेक्षा जास्त स्थिर आहे. ते तापविले किंवा त्यावर आघात केला म्हणजे स्फोट होतो.
हायपोक्लोरस अम्ल (HOCl) व हायपोक्लोराइटे : पाण्यात मर्क्युरिक ऑक्साइड संधारित करून (सूक्ष्म कण तरंगते ठेवून) त्यातून क्लोरीन प्रवाहित केला म्हणजे हे अम्ल बनते. हे फक्त विद्रावरूपाने अस्तित्वात असते, पण याची लवणे म्हणजेच हायपोक्लोराइटे ही स्फटिकी संयुगे आहेत. हे एक दुर्बल अम्ल असून ऑक्सिडीकारक आहे.
हायपोक्लोराइटे ऑक्सिडीकारक व विरंजक (रंग नाहीसा करणारी) आहेत. विरंजक चूर्णामध्ये असलेले कॅल्शियम हायपोक्लोराइट तसेच मिठाच्या विद्रावाचे (प्लॅटिनम धनाग्र व लोखंड ऋणाग्र वापरून) विद्युत् विच्छेदन केल्याने मिळणारे सोडियम हायपोक्लोराइट, ही हायपोक्लोराइटे प्रसिद्ध आहेत.
हायपोक्लोराइटे तापविली असता क्लोरेटे व क्लोराइडे बनतात. उदा.,
| 3NaOCl | → | NaClO3 | + | 2NaCl |
| सोडियम हायपोक्लोराइट | सोडियम हायपोक्लोरेट | सोडियम क्लोराइड |
कोबाल्टस लवण उत्प्रेरक (विक्रियेत भाग न घेता विक्रियेची गती वाढविणारा पदार्थ) म्हणून वापरून हायपोक्लोराइटाचा विद्राव तापविल्यास ऑक्सिजन मुक्त होतो. हायपोक्लोराइट विरल अम्लाबरोबर तापविल्यास क्लोरीन निघतो. हायपोक्लोराइटाने लेड नायट्रेटाच्या विद्रावातून लेड डाय – ऑक्साइड अवक्षेपित होते (न विऱघळणारा साका तयार होतो). या विक्रियांनी हायपोक्लोराइटांचे अभिज्ञान (अस्तित्व ओळखणे) करता येते.
क्लोरस अम्ल (HClO2) आणि क्लोराइटे : क्लोरस अम्ल विद्रावाच्या रूपात आणि लवणांच्या रूपात आढळते. सोडियम क्लोराइट (NaClO2) हे एक प्रबल ऑक्सिडीकारक आहे. ते विरंजक म्हणून वापरतात.
हायपोक्लोराइटापेक्षा ते सौम्य आहे. यामध्ये ClO2– हा आयन असतो. यात क्लोरिनाची ऑक्सिडीकरण अवस्था +३ आहे [→ ऑक्सिडीभवन].
क्लोरिक अम्ल (HClO3) व क्लोरेटे : क्लोरिक अम्ल हे एक प्रबल अम्ल असून विद्रावरूपात अस्तित्वात असते. त्याच्या लवणास क्लोरेट म्हणतात. ही लवणेही प्रबल ऑक्सिडीकारक आहेत. पोटॅशियम, सोडियम आणि बेरियम यांची क्लोरेटे महत्त्वाची आहेत. क्लोरेटे ही धातूंच्या क्लोराइडांच्या विद्रावाचे योग्य परिस्थितीत विद्युत् विच्छेदन करून मोठ्या प्रमाणावर तयार करतात. याशिवाय कॅल्शियम क्लोराइडाच्या विद्रावातून क्लोरीन जाऊ दिल्यास कॅल्शियम क्लोरेट बनते. त्याची सोडियम सल्फेटाबरोबर विक्रिया करून सोडियम क्लोरेट बनवितात. क्लोरेट पांढरी स्फटिकी संयुगे असून पाण्यात विद्राव्य आहेत. उष्णतेने त्यांचे अपघटन होते. सोडियम क्लोरेट तणनाशक म्हणून व इतर क्लोरेटांच्या निर्मितीत वापरतात. पोटॅशियम क्लोरेट आगकाड्यांत, घसा सुजला असल्यास गुळण्यांसाठी व ऑक्सिडीकारक म्हणून वापरतात. पोटॅशियम आणि बेरियम क्लोरेट स्फोटक द्रव्ये आणि शोभेच्या दारूकामात वापरतात.
क्लोरेटे जलद तापविल्यास, त्यांवर आघात केल्यास किंवा ज्वलनशील पदार्थांच्या सान्निध्यात ठेवल्यास पेटतात किंवा त्यांचा अपघाती स्फोट होण्याची शक्यता असते म्हणून ती फार सावधगिरीने हाताळावी व वापरावी लागतात.
एखादे क्लोरेटे तापविले असता प्रथम परक्लोरेट आणि क्लोराइड बनते, नंतर तापमान वाढविले म्हणजे त्यामधून (१) धातूचे ऑक्साइड व क्लोरीन किंवा (२) धातूचे क्लोराइड व ऑक्सिजन बाहेर पडतो. यांपैकी कोणती विक्रिया घडेल, हे त्या धातूचे क्लोराइड स्थिर आहे किंवा ऑक्साइड स्थिर आहे, यावर अवलंबून असते. क्षारीय (सोडियम, पोटॅशियम यांसारख्या, अल्कली) धातू व क्षारीय मृत्तिका धातू (कॅल्शियम, स्ट्राँशियम, मॅग्नेशियम इ.) यांची क्लोराइडे स्थिर असल्यामुळे त्यांची क्लोरेटे तापविल्याने क्लोराइडे व ऑक्सिजन मिळतो. ही विक्रिया प्रयोगशाळेत ऑक्सिजन बनविण्यास उपयोगी पडते. मँगॅनीज डाय-ऑक्साइड हा उत्प्रेरक वापरल्यास ही विक्रिया कमी तापमानास घडून येते. कॉपर, झिंक व कॅडमियम यांच्या क्लोराइटांपासून तापविल्याने क्लोरीन व त्या त्या धातूंची ऑक्साइडे मिळतात, कारण त्यांची ऑक्साइडे स्थिर आहेत.
परक्लोरिक अम्ल (HClO4) व परक्लोरेटे : परक्लोरिक अम्ल हे एक अतिप्रबल अम्ल आणि ऑक्सिडीकारक आहे. निर्जलावस्थेत हे वर्णहीन, अत्यंत आर्द्रताशोषक आणि स्फोटक द्रव्य आहे. ते -११२० से. तापमानास गोठते. शुद्ध, संहत अम्ल स्थिर नाही. बेरियम आणि मॅग्नेशियम यांची परक्लोरेटे वायूचे निर्जलीकरण करण्याकरिता वापरतात.
परक्लोरिक अम्लाचा उपयोग वैश्लेषिक रसायनशास्त्रामध्ये, त्याचप्रमाणे, उत्प्रेरक म्हणून आणि स्फोटक द्रव्य म्हणून होतो. हे ६% ते ७२% विद्रावरूपाने विकले जाते.
हायड्रोक्लोरिक अम्ल : हायड्रोजन क्लोराइडच्या (HCl) जलीय विद्रावाला हायड्रोक्लोरिक अम्ल म्हणतात. त्याचा रासायनिक, खाद्यपदार्थ आणि इतर उद्योगांत मोठ्या प्रमाणावर उपयोग करतात [→ हायड्रोक्लोरिक अम्ल].
क्लोराइडे : हायड्रोक्लोरिक अम्लापासून मिळणाऱ्या आणि ज्यांच्यात क्लोरिन अणू -१ ऑक्सिडीकरण अवस्थेत आहे, अशा संयुगांना क्लोराइडे म्हणतात. ही कार्बनी व अकार्बनी असतात. अकार्बनी क्लोराइडे ही सहसंयुजी (ज्यांमध्ये जोडलेल्या अणूंनी इलेक्ट्रॉन समाईक वापरलेले असतात अशी), आयनी व जटिल स्वरूपाची असतात. सहसंयुजी क्लोराइडांचा वितळबिंदू आणि उकळबिंदू कमी असतो. ही संयुगे धातवीय (ॲल्युमिनियम क्लोराइड, स्टॅनिक क्लोराइड इ.) व अधातवीय (बोरॉन ट्रायक्लोराइड, कार्बन टेट्राक्लोराइड इ.) असतात. आयनी क्लोराइडांचा (सोडियम क्लोराइड, कॅल्शियम क्लोराइड, मॅग्नेशियम क्लोराइड) वितळबिंदू आणि उकळबिंदू उच्च असून ती द्रव स्थितीत उच्च विद्युत् संवाहक असतात. सहसंयुजी व आयनी क्लोराइडांमध्ये भेद करणे अवघड आहे. कारण बेरिलियम क्लोराइड, मर्क्युरिक क्लोराइड यांसारख्या क्लोराइडांमध्ये मोठ्या धनायनामुळे सहसंयुजी बंध तयार होतो. बहुतेक धातवीय क्लोराइडे जलविद्राव्य आहेत. क्षार (अल्कली) व क्षारीय धातू सोडून इतर धातु-आयनांबरोबर क्लोरिनाचे जटिल (गुंतागुंतीचे) आयन बनतात.
ॲल्युमिनियम क्लोराइड (AlCl3) हे चूर्णरूपी, शुभ्र व चिघळणारे षट्कोणी स्फटिकी असून त्याचा उपयोग स्टायरीन, क्युमेन इत्यादींच्या निर्मितीत उत्प्रेरक म्हणून, तसेच रंजक, निर्मलके (वस्तू स्वच्छ करणारे पदार्थ) औषधे व सौंदर्यप्रसाधने यांत करतात. टिटॅनियन टेट्राक्लोराइड (TiCl4) हे स्वच्छ व वर्णहीन द्रव असून लष्करी उपयोगासाठी त्याची निर्मिती केली जाते. फॉस्फरस ट्रायक्लोराइड (PCl3) व फॉस्फरस ऑक्सिक्लोराइड यांचा उपयोग कार्बनी संश्लेषणात (कृत्रिम रीतीने संयुगे तयार करण्यासाठी) विक्रियाकारक म्हणून करतात. फेरिक क्लोराइड (FeCl3) हे घन, काळे व षट्कोणी स्फटिकी असून त्याचा उपयोग उत्प्रेरक म्हणून शिवाय लवणे, रंगद्रव्ये, औषधे, रंजक इत्यादींच्या निर्मितीत, तसेच उद्योगधंद्यातील अपशिष्ट (वाया जाणाऱ्या) पदार्थांच्या आणि वाहितमल (वाहून नेलेले मैलापाणी) यांच्या संस्करणात करतात.
कार्बनी संयुगे : ॲलिफॅटिक संयुगे : (१) संतृप्त (ज्यांच्या संरचनेतील कार्बन अणू एकमेकांस एका बंधाने जोडलेले असतात अशी) : मिथेन किंवा मिथेनॉल आणि क्लोरीन यांच्यापासून मिथिल क्लोराइड मिळते. मिथेनाच्या क्लोरिनीकरणाने मिळणारे मिथिलीन क्लोराइड हे प्लॅस्टिक निर्मितीत व वातविलेप परिचालक (एखाद्या वायूमध्ये घन किंवा द्रव पदार्थ अत्यंत सूक्ष्म कणांच्या रूपात मिश्र आहे असे मिश्रण फवाऱ्याच्या रूपाने उडविता यावे याकरिता) माध्यम म्हणून वापरतात. तसेच ⇨क्लोरोफॉर्म शुद्धिहारक (शुद्ध घालविणारा, गुंगी आणणारा) म्हणून वापरतात. कार्बन टेट्राक्लोराइड हे मिथेन, नैसर्गिक वायू (खनिज इंधन वायू) किंवा ॲलिफॅटिक हायड्रोकार्बनांचे सरळ क्लोरिनीकरण करून मिळवितात.एथिलीन ग्लायकॉल निर्मितीत एथिलिन क्लोरोहायड्रीन हे संयुग वापरतात. ॲसिटिलिनाच्या क्लोरिनीकरणाने बनणाऱ्या टेट्राक्लोरोएथेनाचा उपयोग विद्रावक निर्मितीत करतात. व्हिनिल क्लोराइड प्लॅस्टिक निर्मितीत वापरतात.एथिल क्लोराइडाचा उपयोग एथिल सेल्युलोज निर्मितीत, प्रशीतनात व शुद्धिहरणासाठी करतात. क्लोरल कीटकनाशक म्हणून वापरतात. हेक्झॅक्लोरोएथेनाचा उपयोग मध्यस्थ (दुसऱ्या एखाद्या पदार्थाच्या निर्मितीतील एक टप्पा असलेले संयुग) व कीटकनाशक म्हणून प्रोपिलीन क्लोराइडाचा उपयोग मध्यस्थ, धूम्रकारी कीटकनाशक (ज्याच्या धुरीने कीटक मरतात असे संयुग) व विद्रावक म्हणून डायक्लोरोपेंटेनाचा उपयोग रबर, रेझीन व रंगलेप ह्या उद्योगांत विद्रावक म्हणून क्लोरीनयुक्त पॅराफिनांचा उपयोग प्लॅस्टिकीकारक, वंगण-समावेशक (वंगणात मिसळण्याचा पदार्थ) आणि वातावरण-प्रक्रियारोधक (वातावरणाच्या अनिष्ट प्रक्रियांना रोखणारा) व ज्वालारोधक म्हणून करतात. (२) अतृप्त (ज्यांच्या संरचनेतील कार्बन अणू एकमेकांना एकापेक्षा जास्त बंधांनी जोडलेले असतात अशी) : ट्रायक्लोरोएथिलिनाचा उपयोग धातूंवरील तेलकटपणा नाहीसा करण्यासाठी व निष्कर्षण विद्रावक (मिश्रणातून इष्ट पदार्थ विरघळवून काढून घेणारे) म्हणून करतात. परक्लोरोएथिलिनाचा उपयोग निर्जल धुलाईत केला जातो. व्हिनिलिडीन क्लोराइडाचा उपयोग सरान, जिऑन, वेलॉन यांसारख्या बहुवारिकांच्या (एकाच पदार्थाचे अनेक रेणू एकमेकांशी जोडून बनणाऱ्या संयुगांच्या) निर्मितीत व व्हिनिल क्लोराइडाचा उपयोग क्लोरोसील, व्हिनिलाइट, जिऑन, टायगॉन, वेलॉन व सरान यांच्या निर्मितीत करतात. मिथालील क्लोराइडाचा उपयोग धूम्रकारक म्हणून व क्लोरोप्रिनाचा उपयोग संश्लेषित रबर व प्लॅस्टिक यांच्या निर्मितीत करतात.
ॲलिसायक्लिक संयुगे : बेंझीन हेक्झॅक्लोराइडाचा उपयोग कीटकनाशक म्हणून व ‘क्लोरडान’ चा उपयोग कीटकनाशक म्हणून केला जातो.
ॲरोमॅटिक संयुगे : क्लोरोबेंझिनाचा उपयोग फिनॉल, डीडीटी, ॲनिलीन यांच्या निर्मितीत करतात. पॅराडायक्लोरोबेंझिनाचा उपयोग कीटकनाशक व दुर्गंधीनाशक तसेच रंजकमध्यस्थ म्हणून करतात. बेंझिल क्लोराइड, बेंझॉइल क्लोराइड व बेंझोट्रायक्लोराइड ह्यांचा उपयोग औषध व कीटकनाशके यांच्या निर्मितीत आद्य (सुरुवातीचा) पदार्थ म्हणून, सुवासिक पदार्थांचा एक घटक म्हणून, वंगण व रंजक निर्मितीत मध्यस्थ म्हणून करतात. क्लोरीनयुक्त बायफिनिलांचा उपयोग विद्युत् रोधनासाठी व द्रव-माध्यम म्हणून वंगण, रंगलेप, व्हार्निशे व प्लॅस्टिक यांत घटक पदार्थ म्हणून करतात. क्लोरीनयुक्त नॅप्थालिनांचा उपयोग रासायनिक वंगण आणि विद्युत् रोधनात करतात. पेंटाक्लोरोफिनॉल लाकूड संरक्षक व डायक्लोरोफिनॉल तणनाशक म्हणून वापरले जाते.
संकीर्ण संयुगे : फॉस्जीन(COCl2)हा विषारी वायू स्पंजी (फोम) रबर व इतर काही रबरप्रकारांसाठी लागणाऱ्या टोल्यूइन डायआयसोसायनेटाच्या निर्मितीसाठी वापरतात. मोनोक्लोरोॲसिटिक अम्लाचा उपयोग मध्यस्थ रसायन म्हणून रंजके, औषधे, सौंदर्यप्रसाधने, तणनाशके आणि किटकनाशके यांच्या निर्मितीत करतात. क्लोरो-अमाइनांचा उपयोग जंतुनाशके म्हणून आणि शस्त्रक्रियेत पूतिरोधक (सूक्ष्मजंतूंची वाढ थोपविणारे) म्हणून करतात.
उपयोग : विरंजक चूर्ण बनविण्यासाठी, तसेच पिण्याचे पाणी निर्जंतुक करण्यासाठी, शहराचे सांडपाणी समुद्रात अथवा नदीत सोडण्यापूर्वी, प्रदूषण (अस्वच्छ) होऊ नये म्हणून, त्यावर क्लोरिनाने रासायनिक उपचार केला जातो. तसेच कापडाच्या आणि कागदाच्या धंद्यांत विरंजक म्हणून याचा उपयोग होतो. परंतु यापेक्षा अनेक पटींनी मोठ्या प्रमाणात त्याचा उपयोग विविध रासायनिक पदार्थ बनविण्याकरिता होतो. त्यामध्ये एथिलीन ग्लायकॉल, टेट्राएथिल लेड, सल्फर क्लोराइड, क्लोरोफॉर्म, कार्बोनिल क्लोराइड इ. संयुगे त्याचप्रमाणे ट्रायक्लोरो एथिलीन, मिथिलीन क्लोराइड व तत्सम विद्रावके डीडीटी, बेंझीन क्लोराइड इ. कीटकनाशके व्हिनिल क्लोराइड, व्हिनिलीन क्लोराइड यांसारखी प्लॅस्टिके फ्रिऑन नामक प्रशीतनके (थंडपणा आणणारी संयुगे), क्लोरेटे, हायप्रोक्लोरेटे, हायड्रोक्लोरिक अम्ल व कित्येक क्लोराइडे आणि रंग धंद्यातील अनेक मध्यस्थ रसायने यांचा समावेश होतो.
वापरातील धोके व सुरक्षा उपाय : क्लोरीन वायूमुळे सामान्यतः श्वासोच्छ्वासास अडथळा निर्माण होतो. त्याच्या साधारण संहतीत अल्पकाळ संबंध आल्यास, तसेच अत्यल्प संहतीला दीर्घकाळ संबंध आल्यास कायम व तीव्र स्वरूपाचे परिणाम होत नाहीत. जास्त संहती व दीर्घकाळ संपर्क यांनी श्वसन तंत्राचा (श्वसन संस्थेचा) व कातडीचा दाह होतो. अति – संहतीमुळे डोळ्यांचा क्षोभ होतो, खोकला येतो आणि श्वासोच्छ्वासास त्रास होतो. कामगारांना योग्य व आवश्यक सूचना दिल्यास निर्मितीच्या ठिकाणी त्यांना क्लोरिनापासून असलेला धोका टाळता येतो. द्रवरूप किंवा वायुरूप क्लोरीन हे दैहिक विष नाही. क्लोरीन वायू हाताळताना विशिष्ट वायुमुखवटे वापरणे आवश्यक असते. जेथे क्लोरिनाचा वापर जास्त केला जातो, तेथे पाण्याचे फवारे ठेवणे व डोळे धुणे आवश्यक असते.
पहा : विरंजन हायड्रोक्लोरिक अम्ल.
संदर्भ : Scone, J. S. Chlorine : Its Manufacture, Properties and Uses, New York, 1962.
कानिटकर, के. रा. मिठारी, भू. चिं. जोशी, ब. ग.