गंधक : एक अधातवीय, घनरूप अनेकरूपी मूलद्रव्य रासायनिक चिन्ह S अणुभार ३२·०६६ अणुक्रमांक (अणुकेंद्रातील प्रोटॉनांची संख्या) १६ आवर्त सारणी (मूलद्रव्यांच्या विशिष्ट पद्धतीने केलेल्या मांडणीतील) गट ६ संक्रमण तापमान (ज्या तापमानास पदार्थाचे एका अवस्थेतून दुसऱ्या अवस्थेत पूर्ण रूपांतर होते असे तापमान) ९६·५० से. वि.गु. अस्फटिकी रूप २·०४६ (विषमलंबाक्ष रूपाचे), १·९६ (एकनताक्ष रूपाचे) वितळबिंदू ११२·८० से. (विषमलंबाक्ष), ११९० से. (एकनताक्ष) उकळबिंदू ४४४·६० से. स्थिर समस्थानिक (एकाच अणुक्रमांकाचे भिन्न अणुभार असलेले त्याच मूलद्रव्यांचे प्रकार) ३२, ३३, ३४ व ३६ विद्युत् विन्यास (इलेक्ट्रॉनांची अणूंतील मांडणी) २, ८, ६ शिलावरणातील प्रमाण ०·०५२ % वर्ण पिवळसर गंधहीन रूचिहीन पाण्यात अविद्राव्य (विरघळत नाही) क्रांतिक तापमान (ज्या तापमानापेक्षा जास्त तापमानास बाष्प द्रवरूप होत नाही असे तापमान) १,०४००से. कठिनता १·५ ते २·५ (मोस) [→ कठिनता]. (स्फटिकांच्या आकारांच्या संज्ञांच्या स्पष्टीकरणासाठी स्फटिकविज्ञान ही नोंद पहावी).
इतिहास : प्राचीन भारतीय, ग्रीक व रोमन लोकांना हे मूलद्रव्य माहीत होते. संस्कृत भाषेत गंधकास ‘शुल्बारी’ म्हणत, या शब्दावरून सल्फर हा शब्द आला असे मानण्यात येते. कापडाचा रंग घालविण्यासाठी आणि हवा शुद्ध करण्यासाठी त्याच्या धुराचा प्राचीन काळी उपयोग करीत असत. किमयागार गंधकाला अग्नीचे तत्त्व समजत असत. त्यानंतर गंधक हे सल्फ्यूरिक अम्ल व फ्लॉजिस्टॉन यांचे संयुग आहे असे मानले जात होते. शेवटी लव्हॉयझर यांनी १७७७ साली ते मूलद्रव्य आहे असे सिद्ध केले.
उपस्थिती व निर्मिती : निसर्गात मूलद्रव्याच्या रूपात गंधक पुढील प्रकारांनी आढळते. (१) अवसादी (गाळ साचून तयार झालेल्या) थरांच्या खडकात. उदा., रशिया आणि सिसिली. (२) ज्वालामुखीशी संबंधित असणाऱ्या धूममुखांजवळ (ज्यातून वायूरूप पदार्थ बाहेर पडतात अशा मार्गांजवळ) किंवा गरम पाण्याच्या झऱ्याजवळ. उदा., जपान, मेक्सिको आणि चिली. (३) सैंधवी घुमटांच्या माथ्यावरील खडकात. उदा., टेक्सस, लुइझिॲना इ. अमेरिकेतील संस्थानांत.
सल्फाइडे आणि सल्फेटे या संयुगांच्या रूपात गंधक भूकवचामधील खडकांत विपुल पण विखुरलेले आढळते. ज्वालामुखीतून निघणाऱ्या वायूंमध्ये आणि शिलारसातून बाहेर पडणाऱ्या द्रव्यांमध्ये गंधक एक प्रमुख घटक असते. तसेच ते ज्वालामुखीशी संबंधित गरम पाण्याच्या झऱ्यामध्ये सामान्यतः नेहमी असते.
गंधक काढण्यास योग्य असे पायराइट हे खनिज इतर सल्फाइडी खनिजांबरोबर रीऊ टींटू (स्पेन), पोर्तुगाल, सायप्रस, नॉर्वे, उरल (रशिया), क्वेबेक (कॅनडा), डकटाऊन, टेनेसी (अमेरिका) इ. ठिकाणी सापडते.
केस, लोकर, लसूण, मोहरी, कोबी आणि अनेक प्रथिने यांसारख्या कार्बनी (सेंद्रिय) पदार्थांतही गंधक आढळते.
अवसादी निक्षेपातील गंधक : अगोदर अस्तित्वात असलेल्या खडकांतील सल्फेटांपासून व ज्वालामुखी-निःसरणामध्ये (ज्वालामुखीतून बाहेर पडणाऱ्या पदार्थांमध्ये) असणाऱ्या हायड्रोजन सल्फाइडापासून थरांच्या निक्षेपातील (साठ्यातील)गंधक तयार होते. सल्फेट व हायड्रोजन सल्फाइड गाळ साचत असलेल्या द्रोणीमध्ये विद्रावाच्या स्वरूपात पाण्याच्या प्रवाहाबरोबर वाहून नेले जातात. काही थोडे फार गंधक कलिली (अतिसूक्ष्म कण लोंबकळत्या स्थितीत असलेल्या) स्वरूपातही वाहून नेले जाते. ज्या पाण्यामध्ये ऑक्सिजनाची कमतरता असते म्हणजे जेथे क्षपणास [→ क्षपण] अनुकूल परिस्थिती असते व ज्या ठिकाणी अवायुजीवी (हवेशिवाय जगणारे) सूक्ष्मजंतू विपुल असतात, तेथे सल्फेटापासून व हायड्रोजन सल्फाइडापासून गंधक तयार होते. सूक्ष्मजंतूंच्या कार्यामुळे सल्फेटांचे क्षपण होऊन हायड्रोजन सल्फाइड तयार होते. नंतर हायड्रोजन सल्फाइडाचे ⇨ऑक्सिडीभवन होऊन पाणी व गंधक तयार होते. काहींच्या मते गंधकी सूक्ष्मजंतू हायड्रोजन सल्फाइडापासून गंधक तयार करतात. बॅस्टिन, ॲलन, क्रेनशा आणि मर्विन या शास्त्रज्ञांना सूक्ष्मजंतूविरहित अकार्बनी संयुगांच्या साहाय्याने सल्फेटाचे क्षपण करून गंधक मिळविता आले नाही. मात्र थील, बायरिंग, व्हॅनडेल्डन यांना सूक्ष्मजंतू वापरून सल्फेटापासून हायड्रोजन सल्फाइड वायू मिळविता आला. हायड्रोजन सल्फाइड असणाऱ्या १० मी. खोल सरोवरात १०० दिवसांत दर चौ.मी. क्षेत्रात ४५ किग्रॅ. गंधक तयार होऊ शकेल, असा अंदाज व्हॅन डेल्डन यांच्या संशोधनात मिळालेल्या माहितीवरून मिळतो. सल्फेटाचे नैसर्गिक रीत्या क्षपण होण्यासाठी सूक्ष्मजंतूंची आवश्यकता आहे असे या माहितीवरून दिसून येते.
बाष्पीभवन होऊन जेव्हा समुद्राच्या पाण्याची लवणता वाढते तेव्हा गंधकाऐवजी जिप्सम तयार होते. अशा परिस्थितीत सल्फेटांचे क्षपण करणारे सूक्ष्मजंतू जगू शकत नाहीत. आर्थिक व व्यापारी दृष्ट्या महत्त्वाचे गंधकाचे निक्षेप तयार होण्यासाठी एक तर दुसऱ्या कोणत्याही प्रकारच्या गाळाचे अवसादन पूर्णपणे बंद किंवा स्थगित असावे लागते किंवा ज्यामुळे निव्वळ शुद्ध गंधकाचे थर तयार होतील, इतक्या जास्त प्रमाणात गंधकाचा पुरवठा प्रवाहातून एकसारखा होत रहावा लागतो.
गंधकाचे महत्त्वाचे अवसादी निक्षेप रशियातील निबिशेव, सुकैवा व शेकूर या ठिकाणी सापडतात. अवसादनाच्या निरनिराळ्या घडामोडी निबिशेव येथील निक्षेपात दिसून येतात. येथील निक्षेप म्हणजे जिप्समाचे सापेक्षतः पातळ थर असून त्यांत गंधकाचे पातळ थर तसेच गंधक व कॅल्साइट यांचे पातळ थर आहेत. तेथे गंधकाचे ग्रंथिल घड किंवा वेडेवाकडे पुंजके बिट्युमेनयुक्त चुनखडीमध्येही सापडतात. या खनिजाबरोबर अनपेक्षित असे सेलेस्टाइटही (पांढरे ते फिकट निळे खनिज, स्ट्राँशियम सल्फेट) सापडते. येथील गंधक शुद्ध किंवा बिट्युमेनयुक्त असून काही पुनःस्फटिकीभवन होऊन तयार झालेले आहे, तर काही अंदुकमय (गोलसर कणांच्या पुंजक्याच्या स्वरूपात) आहे. हे निक्षेप सिंधु-तडागात (अडथळ्याने मुख्य समुद्रापासून अलग झालेल्या समुद्राच्या उथळ भागात) अवसादन होऊन तयार झालेले असावेत, असा समज आहे. ते पर्मियन काळातले (सु. २७·५ ते २४·५ कोटी वर्षांपूर्वीच्या काळातले) आहेत, तर शेकूर येथील निक्षेप फार नंतरच्या म्हणजे उत्तर तृतीय कल्पातील (सु. १·२ कोटी वर्षांपूर्वीच्या) सिंधुतडागात मिळतात. या निक्षेपांच्या आसपास हायड्रोजन सल्फाइडयुक्त पाण्याचे असंख्य झरे आहेत. सिसिलीमधील गंधकाचे निक्षेप हे अवसादी खडकाचे दुसरे उदाहरण आहे. या भागात गंधक असलेले खडक सु. ८ किमी. लांब व १ किमी. रुंद अशा आकाराच्या सुट्या व अलग द्रोण्यांमध्ये आढळतात.
गंधक सच्छिद्र चुनखडीच्या खडकात इतस्ततः विखुरलेले अथवा शुद्ध गंधकाचे २·५ सेंमी. पर्यंत जाडीचे थर असलेले असे आढळते. या खडकातील गंधकाचे प्रमाण १२ ते ५० टक्के (सरासरी २६ टक्के) इतके आहे. हे निक्षेप जीवरासायनिक पद्धतींनी तयार झाले असावेत असे समजतात.
ज्वालामुखीपासून मिळणारे गंधक : ज्वालामुखीशी संबंधित असलेल्या धूममुखाजवळ किंवा गरम पाण्याच्या झऱ्याजवळ आढळणारे गंधक खडकातील चर, भेगा, छिद्रे इत्यादींमध्ये असते. असे गंधक तीन प्रकारांनी तयार होते : (१) गंधकाच्या वाफा थंड होऊन, (२) हायड्रोजन सल्फाइड व सल्फर डाय-ऑक्साइड यांच्यात विक्रिया होऊन व (३) हायड्रोजन सल्फाइडाचे ऑक्सिडीभवन होऊन. गरम पाण्याच्या झऱ्यातील हायड्रोजन सल्फाइडाचे सूक्ष्मजंतूंच्या साहाय्याने ऑक्सिडीभवन होऊन गंधक तयार होते. यांपैकी एक किंवा अनेक क्रिया होऊन बहुतेक सर्व ज्वालामुखी गंधक तयार होते. सिरेटोको आयोसान ज्वालामुखीतून १९३६ साली गंधकाचे निःसरण झाले. यावेळी १२०° से. तापमान असलेले शुद्ध गंधक बाहेर पडले व वाहत जात असताना पायऱ्या निर्माण झाल्या. त्याचा १,५०० मी. लांब, २० ते २५ मी. रुंद व ५ मी. जाड निक्षेप तयार झाला. ज्वालामुखीपासून आलेल्या हायड्रोजन सल्फाइडाचे ऑक्सिडीभवन होऊन जपानमधील क्योझुके येथील सरोवरात गंधकाचे थर तयार झाले आहेत, असे काहींचे मत आहे. सिसिलीमधील गंधकाच्या द्रोणी, या त्यांच्याखाली असणाऱ्या बेसाल्टामधून येणाऱ्या गरम पाण्याच्या झऱ्यातील गंधक, त्यांच्यात साचत जाऊन तयार झालेल्या आहेत. रशियातील काझबेक, गामूर व कॅमचॅटका या ठिकाणी असलेले गंधक ज्वालामुखीपासून आलेले असावे, असे रशियन शास्त्रज्ञांचे मत आहे. ज्वालामुखींशी संबंधित असे गंधक वरील ठिकाणांव्यतिरिक्त जावा, मेक्सिको व द. अमेरिकेताल अँडीज पर्वतात आढळते.
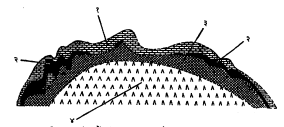
सैंधवी घुमटांच्या माथ्यावरील खडकातील गंधक : अमेरिकेतील टेक्सस व लुइझिॲना राज्यांतील जगप्रसिद्ध असे गधंकाचे निक्षेप सैंधवी घुमटांच्या माथ्यावरील खडकांत आढळतात. घुमटाच्या गाभ्यात लवणे असून त्यांत अल्प प्रमाणात ॲनहायड्राइट सापडते (आ.१). घुमटाच्या वरच्या बाजूस त्याला लागूनच ॲनहायड्राइट किंवा जिप्समाचे थर आहेत व त्यांच्यावर १६ ते ३३० मी. इतके जाड कॅल्साइटाच्या सच्छिद्र चुनखडकाच्या वा कॅल्साइटाच्या खडकाच्या खालच्याभागात गंधक आढळते. तसेच काही अल्पसे गंधक वरच्या जिप्समाच्या भागात देखील आढळते. परंतु फक्त कॅल्साइटामधील गंधकच बाहेर काढतात. विखुरलेले कण, थर, ग्रंथिल घड व स्फटिक अशा प्रकारांनी हे गंधक सापडते. गंधकाचे आकारमान, खडकाच्या एकूण आकारमानाच्या २० ते ४० टक्के आहे. माथ्यावरील खडकात बराइट, सेलेस्टाइट, स्ट्राँशियनाइट ही काही प्रमाणात सापडतात व क्वचित गॅलेना, स्फॅलेराइट व मँगॅनिजाची सल्फाइडे यांच्याबरोबर असतात. गंधक असलेला पट्टा ८ ते १०० मी. जाडीचा असून त्याची सरासरी जाडी ३३ मी. इतकी आहे. माथ्यावरील खनिजयुक्त खडकावर १·५ ते ६५ मी. जाडीचे खनिजरहित माथ्याचे खडक व त्यांवर सु. ५०० मी. पर्यंत जाडीचा सुट्या, मोकळ्या अवसादाचा थर आहे. माथ्यावरील खडकाने सु. ८०० हे. क्षेत्र व्यापले आहे.
लुइझिॲनातील गंधकाचे घुमट असलेले ‘सल्फर डोम’ हे ठिकाण फक्त ३० हेक्टर क्षेत्रात आहे, पण त्या ठिकाणी एक कोटी टन गंधकाचे उत्पादन झाले. टेक्ससमधील ‘बोलिंग डोम’ हे ठिकाण ५०० हेक्टरांत असून त्यात सु. चार कोटी टन गंधक असावे असा अंदाज आहे. टेक्सस आणि लुइझिॲना भागांतील माहीत असलेल्या ३०० सैंधवी घुमटांपैकी फक्त बारा घुमटांमध्ये आर्थिक व व्यापारी दृष्ट्या महत्त्वाचे गंधकाचे साठे सापडले आहेत.
भारत गंधकासाठी सध्या पूर्णपणे आयातीवर अवलंबून आहे कारण स्थानिक पायराइट धातुकांचा अद्याप गंधक मिळविण्यासाठी उपयोग केला जात नाही.
काश्मीरातील पूजा दरी येथील गंधक हेच भारतातील या प्रकाराचे गंधकाचे साठे आहेत, पण त्यांच्या दुर्गम स्थानामुळे अद्याप त्याला महत्त्व प्राप्त झालेले नाही. देशात गंधकाचे उत्पादन होत नसल्यामुळे भारताला दर वर्षी फार मोठ्या प्रमाणात आयात करावी लागते.
प्राप्ती : गंधकाचे निष्कर्षण फ्रॅश व सिसिलीय या दोन मुख्य पद्धतींनी करतात. त्यांखेरीज सोडियम कार्बोनेट तयार करण्याच्या लब्लां पद्धतीतील क्षारीय (अम्लाशी विक्रिया झाल्यास लवण देणाऱ्या पदार्थाचे गुणधर्म असणारे, अल्कलाइन) अपशिष्ट (टाकाऊ पदार्थ) व दगडी कोळशापासून कोक तयार करताना मिळणाऱ्या वायूपासून थोड्या प्रमाणात गंधक मिळवितात. तसेच खनिज तेलाच्या परिष्करणांतील (शुद्धीकरणातील) वायू, नैसर्गिक वायू (खनिज इंधन वायू), जस्ताच्या आणि तांब्याच्या सल्फाइड धातुकांवरील (ज्यापासून धातू मिळवितात अशा कच्च्या धातूवरील) प्रक्रियांत निर्माण होणारा वायू यांपासूनही गंधक मिळवितात. या पद्धतीने कॅनडा, फ्रान्स, जर्मनी, नार्वे, स्वीडन, अमेरिकेची संयुक्त संस्थाने इ. देशांत गंधकाचे उत्पादन होते.
गंधकाचे उत्पादन दुसऱ्या महायुद्धानंतर रासायनिक उद्योगधंद्यांच्या वाढीमुळे दर वर्षास १,२०,००,००० टनांपेक्षाही जास्त वाढले आहे. या उत्पादनाच्या बाबतीत अमेरिकेची संयुक्त संस्थाने, मेक्सिको, कॅनडा, चिली, फ्रान्स, इटली, पोलंड, रशिया, जपान आणि चीन हे देश आघाडीवर आहेत.
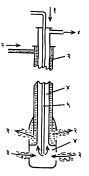
फ्रॅश पद्धती : ही पद्धती १८९१ साली प्रचारात आली. ती अमेरिकेतील टेक्सस व लुइझिॲना येथे वापरली जाते.तेथील गंधकाचे साठे २०० ते ३०० मी. खोल आहेत. विशिष्ट परिस्थितीमुळे नेहमीची उत्खनन (खणून काढण्याची) पद्धती तेथे उपयोगात आणता येत नाही.
या पद्धतीत अनुक्रमे २·५, ७·५ व १० सेंमी. व्यासाच्या एकात एक बसविलेल्या (एककेंद्रीय) तीन नळ्यांचा वापर केला जातो. या नळ्या साठ्यापर्यंत पोहोचतील अशा तऱ्हेने खाणीत घालून सर्वांत बाहेरच्या नळीतून अतितप्त पाणी (१६५० से.) उच्च दाब वापरून जाऊ देतात त्यामुळे गंधक वितळते. नंतर सर्वांत आत असलेल्या नळीतून (२·५ सेंमी.) गरम संपीडित (दाबाखालील) हवेचा झोत सोडतात. त्यामुळे गंधकमिश्र पाण्याचा फेस तयार होतो व घनता कमी असल्यामुळे तो मधल्या नळीतून पृष्ठभागावर जोराने फेकला जातो. तो मोठमोठ्या पिंपांत गोळा करतात तेथे त्यातील गंधक घनरूप बनते. दररोज सु. ६,००० टन गंधक या पद्धतीने मिळविले जाते.
सिसिलीय पद्धती :सिसिलीमधील गंधकात माती, चुनखडी वगैरे द्रव्ये असतात. त्यांचे प्रमाण १५–२५% असते. निक्षेप खणून काढल्यावर मुद्दाम तयार केलेल्या उतरत्या पृष्ठभागावर ढीग रचून ढिगाचे वरचे टोक पेटवितात. गंधकाच्या ज्वलनाने उत्पन्न होणारी उष्णताच माती वगैरेंपासून गंधक निराळे करण्यासाठी वापरली जाते. येथे २५% गंधक इंधन म्हणून वापरले जाते. या कामाकरिता गंधक वापरणे फायद्याचे नाही म्हणून आर्थिक दृष्ट्या फायदेशीर अशा गिल यांनी सुचविलेल्या भट्टया नंतर उपयोगात येऊ लागल्या. गिल पद्धतीत निक्षेप घुमट असलेल्या एका कोठी मालिकेतून (एका कोठीतून दुसऱ्या कोठीत व त्यानंतर तिसऱ्या कोठीत अशा प्रकारे) उष्ण हवा जाऊ देतात व त्यामुळे गंधकाचा इंधन म्हणून खर्च कमी होतो. या पद्धतीने मिळविलेले गंधक पुन्हा शुद्ध करावे लागते.
नैसर्गिक वायूमध्ये असलेल्या हायड्रोजन सल्फाइडामधून व खनिज तेलाच्या परिष्करणानंतर राहिलेल्या वायूतून गंधक मिळविता येते. या वायूत हवा मिसळून सक्रियित (अधिक क्रियाशील बनविलेल्या) बॉक्साइट उत्प्रेरकावरून (विक्रियेत भाग न घेता विक्रियेची गती वाढविणाऱ्या पदार्थावरून) तो प्रवाहित केला असता पुढील विक्रिया होऊन गंधक मिळते.
|
2H2S |
+ |
O2 |
उत्प्रेरक → |
2H2O |
+ |
2S ↓ |
|
हायड्रोजन सल्फाइड |
ऑक्सिजन |
पाणी |
गंधक(अवक्षेप) |
गंधकाची अनेकरूपता : गंधक घन स्वरूपात व द्रव स्वरूपात व द्रव स्वरूपातही अनेकरूपता दाखविते. ही अनेकरूपे तापमानानुवर्तनी आहेत. ज्या तापमानाला एकापेक्षा जास्त रूपे अस्तित्वात असतात, त्या तापमानाला संक्रमण तापमान म्हणतात. सामान्य तापमानाला गंधकाचे स्फटिक विषमलंबाक्षी असतात. त्या गंधकाला α–गंधक म्हणतात. पण α–गंधक तापविले, तर ९६·५० से. तापमानाला त्याचे एकनताक्षी स्फटिक बनतात. त्या गंधकाला β–गंधक म्हणतात. ते सुईसारख्या स्वरूपात व स्फटिकी असते.β–गंधक ११९·३० से. तापमानापर्यंत स्थिर असते आणि तोच गंधकाचा उकळबिंदू होय. पण जर α–गंधक त्वरेने तापविले, तर ते ११२·३० से. तापमानाला वितळते. कारण β–गंधक बनण्यास त्याला पुरेसा वेळच मिळत नाही.
गंधकाचे फूल हे गंधकाच्या बाष्पाचा थंड पृष्ठाशी संपर्क येताच तयार होते. त्यात α–गंधक हे नेहमीच्या स्वरूपात आणि आतिसूक्ष्म चूर्णात असते.
अस्फटिकी गंधक पांढरे किंवा फिकट पिवळ्या रंगाचे व पुडीच्या स्वरूपात असते. ही अत्यंत बारीक पूड स्फटिकी स्वरूपात असावी असे मानण्यास आधार आहे. ते कार्बन डायसल्फाइडात विद्राव्य आहे. कलिल गंधक हे चूर्णरूप गंधक तयार करताना मिळते व गाळलेला द्रव पायसीरूप (एकमेकांत न मिसळणाऱ्या दोन द्रवांच्या मिश्रणरूप) गंधकाचा असतो.
द्रव गंधकाची λ–गंधक व μ–गंधक अशी दोन रूपे आहेत. λ–गंधक हा पिवळा व कमी श्यानतेचा (दाटपणाचा) द्रव आहे. तो कार्बन डायसल्फाइडात विद्राव्य आहे. μ–गंधकाचा रंग गर्द तांबडा किंवा जवळजवळ काळा असतो. तो कार्बन डायसल्फाइडात विरघळत नाही. त्याची श्यानता उच्च आहे.
गंधक ३५०० से. पर्यंत तापवून द्रव अवस्थेतील गंधक पाण्यात ओतले, तर त्याचे प्लॅस्टिक गंधक होते. त्यातील ५५% कार्बन डायसल्फाइडात विरघळते. म्हणून उकळबिंदूजवळील द्रव गंधकात ५५% λ–गंधक व ४५% μ–गंधक असते. तापमान जसजसे खाली येते तसतसे μ–गंधकाचे प्रमाण वाढत जाते.
उपयोग : गंधकाच्या संयुगांच्या उत्पादनात त्याचा मूलद्रव्य अवस्थेत मुख्यतः उपयोग करण्यात येतो. उदा., सल्फ्यूरिक अम्ल (H2SO4), कार्बन डायसल्फाइड (CS2),सोडियम थायोसल्फेट (Na2S2O3), फॉस्फरस ट्रायसल्फाइड (P4S3), कॅल्शियम बायसल्फाइट [Ca(HSO3)3], कॅल्शियम पॉलिसल्फाइड (CaSx). यांतील सर्वांत महत्त्वाचे संयुग म्हणजे सल्फ्यूरिक अम्ल होय. त्याचा उपयोग खते, खनिज तेलाच्या परिष्करणात, धातुकांपासून धातू मिळविण्यासाठी, रबर उत्पादनात, रंगलेप, संश्लिष्ट तंतू (कृत्रिम रीत्या बनविलेले), रंजके, उत्प्रेरके, प्रक्षालके (पृष्ठभाग स्वच्छ करणारे पदार्थ), संश्लिष्ट रेझिने व इतर पुष्कळ कार्बनी आणि अकार्बनी संयुगांच्या उत्पादनात करतात. सल्फ्यूरिक अम्लाखेरीज गंधकाचा उपयोग कागद धंद्यात लगदा करण्यासाठी लागणारे सल्फाइट, रेयॉन, सेलोफेन, कार्बन डायसल्फाइड, कीटकनाशके व कवकनाशके (बुरशीसारख्या हरितद्रव्यरहित सूक्ष्म वनस्पतींचा नाश करणारे पदार्थ), विरंजनकारके (रंग काढून टाकणारे पदार्थ), खते इत्यांदींच्या उत्पादनात केला जातो.
एकूण उत्पादनापैकी सामान्यतः ८७% गंधक सल्फ्यूरिक अम्लाच्या उत्पादनासाठी वापरले जाते व त्यापैकी सु. ४७% गंधक (सल्फ्यूरिक अम्लाच्या स्वरूपात) खताच्या उत्पादनात वापरतात. तथापि मुक्त गंधकाचा बराच भाग वनस्पतींवरील परोपजीवांचा (दुसऱ्याच्या जीवावर उपजीविका करणाऱ्या सजीवांचा) नाश करण्यासाठी फवाऱ्याच्या स्वरूपात वापरण्यात येणारे चुना व गंधक यांचे मिश्रण, काही विशिष्ट सिमेंटे, विद्युत् निरोधक पदार्थ, मलमे, सल्फा आणि इतर औषधे, आयुर्वेदीय औषधे, बंदुकीची दारू, आगपेट्या यांच्या उत्पादनात वापरण्यात येतो.
टिकाऊ रबर तयार करण्यासाठी करण्यात येणाऱ्या व्हल्कनीकरण प्रक्रियेत गंधक वापरतात. अशा रबरावर तापमानाच्या चढउताराचा अनिष्ट परिणाम होत नाही. व्हल्कनीकरणासाठी गंधक-फूल व चूर्ण यांचा सामान्यतः उपयोग करतात.
सल्फॉनिक अम्ले, अल्किल सल्फेटे आणि त्यांचे अनुजात (एका पदार्थापासून बनविलेले दुसरे पदार्थ) यांचा औषधे, प्रक्षालके, वंगणे व रंजकद्रव्ये यांच्या निर्मितीत मोठ्या प्रमाणावर उपयोग करण्यात येतो.
कार्बनी रसायनशास्त्रात वलयी हायड्रोकार्बनांतील हायड्रोजनाचा निरास करून त्यांचे ॲरोमॅटिक (ज्यांत कार्बन अणूंचे वलय असते अशा) हायड्रोकार्बनांत रूपांतर करण्यासाठी गंधकाचा उपयोग करतात. उदा., सायक्लोहेक्झेनाचा २५०° से. तापमानाला गंधक वापरून हायड्रोजननिरास केल्याने बेंझीन मिळते.
रासायनिक गुणधर्म : हे फार क्रियाशील मूलद्रव्य आहे. सोने, प्लॅटिनम, इरिडियम व अक्रिय (रासायनिक विक्रिया करण्याची सहज प्रवृत्ती नसलेल्या) वायूंखेरीज इतर ज्ञात मूलद्रव्यांबरोबर त्याचा सरळसरळ संयोग होतो. पुष्कळ मूलद्रव्यांची गंधकाशी विक्रिया होताना उष्णता निर्माण होते. सामान्य तापमानाला गंधकापासून मंदगतीने सल्फ्यूरिक व सल्फ्यूरस अम्ले बनतात. हायड्रोजन व धातू यांच्याशी संयोग होताना त्याची संयुजा (एखाद्या अणूची इतर अणूंशी संयोग पावण्याची क्षमता दर्शविणारा अंक) –२ असते व H2S, FeS, CuS, HgS अशा प्रकारांची संयुगे बनतात. अधातुबरोबर संयोग होताना त्याची संयुजा किंवा ऑक्सिडीकरण अवस्था [→ ऑक्सिडीभवन] + ४ किंवा + ६ असते व त्याची SO2, SO3 यांसारखी संयुगे बनतात. म्हणून गंदक हे ऑक्सिडीकारक व क्षपणकारकही आहे. त्याच्या ऑक्साइडांपासून अम्ले बनतात. त्याची संयुगे आयनी (रेणूतच एका अगर अधिक इलेक्ट्रॉनांचे संक्रमण होऊन स्थिर विद्युत् विन्यास निर्माण होईल अशा प्रकारे अणूंचा संयोग होऊन तयार झालेली), सहसंयुजी (अणूंमध्ये इलेक्ट्रॉनांची भागीदारी होऊन तयार झालेली) आणि सहसंबद्ध सहसंयुजी (दोन अणूंमध्ये भागीत असलेल्या इलेक्ट्रॉनांच्या जोडीतील दोन्ही इलेक्ट्रॉन एकाच अणूपासून मिळून तयार झालेली) आहेत. पुष्कळ कार्बनी विक्रियांत गंधक भाग घेते.
गंधकाची संयुगे
सल्फाइडे : हायड्रोजन सल्फाइड : (H2S). हायड्रोजन व गंधक यांचे हे महत्त्वाचे संयुग होय. उच्च तापमानाला या दोन मूलद्रव्यांचा संयोग घडवून ते मिळविता येते. सामान्यतः आयर्न सल्फाइडासारख्या सल्फाइडांवर अम्लांची विक्रिया करून कोठी तापमानाला ते प्रयोगशाळेत बनवितात. तो वर्णहीन वायू आहे. त्याला कुजक्या अंड्यासारखा वास येतो. तो फार विषारी आहे, पण दुर्गंधामुळे त्याचे अस्तित्व चटकन जाणवते व धोका टाळणे शक्य होते. घनता १·५३९२ ग्रॅ./लि. (०० से.) वितळबिंदू -८२·९० से., उकळबिंदू -५९·६० से., पाणी, एथिल अल्कोहॉल, कार्बन टेट्राक्लोराइड व कार्बन डायसल्फाइड यांत विद्राव्य हा वायू जास्त ऑक्सिजन असलेल्या वातावरणात जळतो. त्यापासून पाणी व सल्फर डाय-ऑक्साइड मिळतात. तो उत्तम क्षपणकारक मानला जातो. पाण्यात तो अम्लाप्रमाणे वागतो. अविद्राव्य किंवा अल्पविद्राव्य सल्फाइडे बनविण्यासाठी हायड्रोजन सल्फाइड पाण्यात विरघळवून केलेला विद्राव क्षपणकारक म्हणून उपयोगात आणतात. झिंक क्लोराइडाच्या अमोनियातील विद्रावात हायड्रोजन सल्फाइड विरघळवून आणि ज्ञातमूल्य आयोडीन विद्रावाबरोबर ⇨अनुमापन करून विश्लेषणात त्याचे प्रमाण ठरवितात.
हायड्रोजन डायसल्फाइड : (H2S2).(हायड्रोजन परसल्फाइड). हा एक वर्णहीन द्रव आहे. वितळबिंदू –८९० से. उकळबिंदू ७१० से. तो कार्बन डायसल्फाइड, डाय-एथिल ईथर व बेंझीन यांमध्ये विद्राव्य आहे. पण पाणी, अम्ले, क्षारके (अम्लाशी विक्रिया होऊन लवणे देणारे पदार्थ) आणि अल्कोहॉले यांनी त्याचे अपघटन (रेणूचे तुकडे होणे) होते. गंधक त्यात विरघळते व हायड्रोजन पॉलिसल्फाइड बनते. त्याचे गुणधर्म कार्बन डायसल्फाइडासारखेच आहेत.
धातवीय सल्फाइडे : यांचे अम्लीय सल्फाइडे MHS, सामान्य सल्फाइडे M2S व पॉलिसल्फाइडे M2S3 असे वर्गीकरण करतात (M= एकसंयुजी धातवीय आयन). अम्लीय सल्फाइडे पाण्यात विद्राव्य असतात. विद्राव्य सामान्य सल्फाइडे पाण्यात विरघळविली, तर त्यांचे जलीय विच्छेदन (पाण्याची विक्रिया होऊन रेणूचे तुकडे होणे) होऊन हायड्रोजन सल्फाइड व अम्लीय सल्फाइडे बनतात. धातवीय आयनांच्या ऑक्सिडीकरण अवस्थेवर सल्फाइडांच्या जलीय विच्छेदनाची सुलभता अवलंबून असते. जड धातवीय सल्फाइडे पाण्यात अल्प विद्राव्य असल्यामुळे हायड्रोजन सल्फाइडाने किंवा अमोनियम सल्फाइडाने त्यांचे अवक्षेपण (न विरघळणारा साका तयार होणे) होते. त्या त्या धातूची लवणे वा हायड्रॉक्साइडे यांची विक्रिया हायड्रोजन सल्फाइड किंवा अमोनियम सल्फाइड यांच्याबरोबर करून किंवा त्या त्या धातूच्या सल्फेटाचे उष्ण कार्बनाने क्षपण करून किंवा धातू व गंधक यांचा सरळ संयोग करून धातूंची अम्लीय सल्फाइडे व सामान्य सल्फाइडे बनवतात. क्षारीय (सोडियम, पोटॅशियम इत्यादींची अल्कलाइन) व क्षारकीय सल्फाइडे वर्णहीन असतात, तर जड धातूंची सल्फाइडे सामान्यतः गडद रंगाची असतात. विद्राव्य सल्फाइडे क्षपणकारक असतात. गंधक असलेली रंजके तयार करण्याकरिता, कातडी कमावण्यासाठी विलोमक (केस काढून टाकणारी) म्हणून ती वापरण्यात येतात.
पॉलिसल्फाइडे :क्षारीय धातु-सल्फाइडाच्या विद्रावावर गंधकाची विक्रिया केल्यास पॉलिसल्फाइडे बनतात. जसजसे गंधकाचे प्रमाण वाढते तसतसा पॉलिसल्फाइडांचा रंग जास्त गडद होत जातो. त्यांचे जलीय विच्छेदन सामान्य सल्फाइडापेक्षा कमी प्रमाणात होते, पण अम्लांनी त्यांचे अपघटन होऊन मुक्त गंधक मिळते. कित्येक धातवीय आयनांच्या विश्लेषणात त्यांचा उपयोग होतो.
इतर मूलद्रव्यांबरोबर बनलेली सल्फाइडे : कार्बन-गंधक संयुगे : कार्बन डायसल्फाइड (CS2) हे द्रवरूप असून त्याचा उकळबिंदू ४६·२० से. व गोठणबिंदू –१११·६० से. गंधक व फॉस्फरस यांसाठी ते उत्कृष्ट विद्रावक (विरघळविणारा पदार्थ) आहे [→ कार्बन डायसल्फाइड]. कार्बन मोनोसल्फाइड (CS) हा एक अस्थिर वायू आहे. कार्बन डायसल्फाइडामधून विद्युत् विसर्जन (विद्युत् प्रवाह जाऊ देऊन) केले, तर हा वायू बनतो. कार्बन ऑक्सिसल्फाइडाचा (CSO) उकळबिंदू –५०·२० से. व गोठणबिंदू –१३८·८० से. असून कार्बन मोनॉक्साइड व उच्च तापमानात असलेले गंधक यांच्या विक्रियेने हे बनते.
नायट्रोजन-गंधक संयुगे : सल्फर नायट्राइड (N4S4) यालाच टेट्रानायट्रोजन ट्रेटासल्फाइड असे म्हणतात. हे स्फटिकी घनरूप संयुग असून त्याचा वितळबिंदू १७८° से. आहे. कार्बन डायसल्फाइड, बेंझीन, एथिल अल्कोहॉल, द्रव अमोनिया व कार्बन टेट्राक्लोराइड यांत हे विद्राव्य आहे. क्लोरिनाबरोबर विक्रिया होऊन N4S4Cl4 हे संयुग तयार होते. गंधक व द्रव अमोनिया यांची विक्रिया होऊन सु. –११·५° से. तापमानाला सल्फर नायट्राइड बनते.
नायट्रोजन डायसल्फाइड (NS2) आणि नायट्रोजन पेंटासल्फाइड (N2S5) यांना वास्तविक नायट्राइडेच म्हटले पाहिजे. कारण त्यांत नायट्रोजन हाच जास्त विद्युत् ऋण (संयुजी इलेक्ट्रॉनाला आकर्षित करून धरून ठेवण्याची आणि ऋण विद्युत् भार वाढविण्याची प्रवृत्ती असलेला) आहे.
फॉस्फरस-गंधक संयुगे : यांची सूत्रे P4S3, P4S4, P4S7 आणि P4S10 अशी आहेत. यांच्यापैकी P4S10 याची संरचना माहित असून ती P4O10 सारखी आहे. ही सर्व संयुगे कार्बन डायसल्फाइडात विद्राव्य आहेत व ती मूलद्रव्यांपासून बनवितात येतात.
फॉस्फरस ऑक्सिसल्फाइड (P4S4O6) हे संयुग वर्णहीन आहे. त्याचा वितळबिंदू १०२° से. व उकळबिंदू २९५° से.असून कार्बन डायसल्फाइड व बेंझीन यांमध्ये विद्राव्य आहे.
ऑक्साइडे : यांची सूत्रे SO, S2O3, SO2, SO3, S2O7 व SO4 अशी आहेत. यांपैकी फक्त SO2 व SO3 ही महत्त्वाची आहेत.
सल्फर मोनॉक्साइड : (SO). नीच तापमानाला बाष्परूप गंधक व सल्फर डाय-ऑक्साइड यांच्या मिश्रणातून विद्युत् विसर्जन केले म्हणजे हे संयुग मिळते. नीच दाबात ते स्थिर असते. ते थायोनील क्लोराइडात (SO2Cl2) विद्राव्य आहे. ते द्विवारिक (दोन रेणू एकत्र होऊन मोठा रेणू तयार झालेले) असावे.
सल्फर सेस्क्वि-ऑक्साइड : (S2O3). निळसर हिरवट घन संयुग. १५° से. तापमानाखाली हे स्थिर असते. मुक्त गंधक व अतिरिक्त द्रव सल्फर ट्राय-ऑक्साइड (SO3) यांच्या विक्रियेने हे बनते. पाण्याबरोबर त्याची विक्रिया होऊन सल्फ्यूरस अम्ल, सल्फ्यूरिक अम्ल, व बरीच थायोनिक अम्ले बनतात.
सल्फर हेप्टॉक्साइड : (S2O7). सल्फर डाय-ऑक्साइड (SO2) किंवा सल्फर ट्राय-ऑक्साइड आणि ऑक्सिजन यांच्या मिश्रणातून विद्युत् विसर्जन करून ते मिळवितात. त्याची संरचना माहित नाही.
सल्फर टेट्रा-ऑक्साइड: (SO4). सल्फर डाय-ऑक्साइड व अतिरिक्त ऑक्सिजनाच्या मिश्रणात नीच तापमानात दीप्त विद्युत् विसर्जन करून ते बनवितात. ते पांढरे व घनरूप असून ३° से. ला वितळते. त्याची संरचना माहीत नाही. ते ऑक्सिडीकारक आहे.
सल्फर डाय-ऑक्साइड : (SO2). हा वर्णहीन वायू असून त्याचा वास तिखट आहे. वितळबिंदू –७५·४६० से., उकळबिंदू –१०·०२० से.संरचना O–S–O. संयुगाच्या बंधातील कोन ११९० असतो. तो हायड्रोजन व हायड्रोजन सल्फाइड (H2S) यांचे ऑक्सिडीकरण करतो, पण पोटॅशियम परमँगॅनेट वगैरेंबरोबर त्याची क्षपणकारकाप्रमाणे विक्रिया होते. त्याची बाष्पीभवन-उष्णता तुलनात्मक दृष्टीने उच्च असून त्याचा द्रव सुलभतेने बनतो म्हणून तो प्रशीतकात (रेफ्रिजरेटात) वापरतात. जंतुनाशक, विरंजक व संरक्षक म्हणूनही त्याचा उपयोग करतात. त्याचा मुख्य उपयोग सल्फ्यूरिक अम्लाच्या उत्पादनात सल्फर ट्राय-ऑक्साइड बनविण्यासाठी होतो. खनिज तेल उत्पादांचे परिष्करण करण्यासाठीही त्याचा उपयोग होतो. तो सुलभतेने द्रवरूप होतो. द्रवरूप सल्फर डायऑक्साइडाचा विद्रावक म्हणूनही उपयोग करतात. तो पाण्यात थोडासा विद्राव्य आहे. त्याचा एक सजल स्फटिकी पदार्थ बनतो. तो क्षपणकारक नाही. कार्बनी संयुगांच्या ऑक्सिडीकारक विक्रियांत तो वापरतात.
गंधक जाळून हा वायू बनवितात. धातवीय सल्फाइडे जाळूनही तो मिळतो. त्याचप्रमाणे तांब्यासारख्या धातूंवर संहत (विद्रावात जास्त प्रमाणात असलेल्या) सल्फ्यूरिक अम्लाची विक्रिया करून तो प्रयोगशाळेत बनवितात. तसेच सल्फाइटावर संहत अम्लाची विक्रिया करूनही तो मिळविता येतो.
सल्फर ट्राय-ऑक्साइड : (SO3). हे संयुगα, β, वγ अशा निरनिराळ्या रूपांत आढळते. त्या रूपांचा एकमेकांसी असलेला संबंध पूर्णपणे माहीत नाही. γ–SO3 त्रिवारिकी आहे. त्याचा समतोल वितळबिंदू १६·८° से. आहे.β–SO3 हेबहुवारिकी (अनेक रेणू एकत्र येऊन एक जटिल रेणू होऊन तयार झालेले) आहे. त्याचा समतोल वितळबिंदू ३२·५º से. आहे. α–SO3चा समतोल वितळबिंदू ६२·३º से. आहे. γ व β रूपे α–रूपाशी मितस्थायी (कमी स्थिर) आहेत. पाण्याचा अंश उत्प्रेरक म्हणून वापरून त्यांच्यात रूप-बदल घडविता येतो. एकवारिकी व त्रिवारिकी रूपांमधील समतोल अवस्थेमध्ये द्रव सल्फर ट्राय-ऑक्साइड आढळतो. त्याचा सामान्य गोठणबिंदू ४४·५º से. आहे. बाष्परूप सल्फर ट्राय-ऑक्साइड एकवारिकी (एका रेणूचे बनलेले) आहे.
रासायनिक दृष्टीने सल्फर ट्राय-ऑक्साइड अत्यंत विक्रियाशील आहे. γ–रूप उच्चतम विक्रियाशील व α–रूप नीचतम विक्रियाशील आहे. सर्व रूपांची पाण्याबरोबर विक्रिया होऊन सल्फ्यूरिक अम्ल बनते व उष्णता उत्पन्न होते. सल्फ्यूरिक अम्लाबरोबर त्याची विक्रिया होऊन पायरोसल्यूरिक अम्ल (H2S2O7) बनते. सल्फर यट्रा-ऑक्साइड अत्यंत प्रबल ऑक्सिडीकारक असून हॅलाइडांपासून (फ्ल्युओराइडाखेरीज) ते हॅलोजने (क्लोरीन, ब्रोमीन इ.) मुक्त करते. त्याची कार्बनी संयुगाबरोबर विक्रिया केली, तर ते कार्बन किंवा सल्फॉनिक अम्ले मुक्त करते. धातूबरोबर त्याची सरळ विक्रिया होऊन सल्फेटे बनतात. हायड्रोक्लोरिक अम्लाबरोबर सल्फर ट्राय-ऑक्साइडाची विक्रिया होऊन क्लोरोसल्फॉनिक अम्ल (HSO3.Cl) बनते. उच्च तापमानाला त्याचे अपघटन होऊन सल्फर डाय-ऑक्साइड व ऑक्सिजन बनतात.
सामान्यतः सल्फर डाय-ऑक्साइडापासून ४०००–६६५० से. तापमानाला उत्प्रेरक ऑक्सिडीकरणाने सल्फर ट्राय-ऑक्साइड बनते. व्हॅनॅडियम पेंटा-ऑक्साइड हा उत्प्रेरक सामान्यतः वापरतात. प्लॅटिनम धातू, निकेल व कोबाल्टाची सल्फेटे आणि लोह, टंगस्टन, मॉलिब्डेनम व क्रोमियम यांची ऑक्साइडे ही उत्प्रेरके म्हणून वापरता येतात. सल्फर डाय-ऑक्साइड व ओझोन यांच्या विक्रियेने सल्फऱ ट्राय-ऑक्साइड बनवितात. तसेच नायट्रिक ऑक्साइड व सल्फर डाय-ऑक्साइड यांची विक्रिया कोठी तापमानाला आणि उच्च दाबाखाली करून ते बनवितात.
|
2NO |
+ |
2SO2 |
→ |
2SO3 |
+ |
N2 |
|
नायट्रिकऑक्साइड |
सल्फर डाय-ऑक्साइड |
सल्फर ट्राय-ऑक्साइड |
नायट्रोजन |
त्याचा उपयोग मुख्यतः सल्फ्यूरिक अम्ल व सल्फॉनिक अम्ले बनविण्यासाठी करतात.
|
गंधकाची ऑक्सि-अम्ले : |
||
|
नाव |
रेणुसूत्र |
संरचना सूत्र |
|
सल्फॉक्सिलिक अम्ल |
H2SO2 |
HO-S-OH |
|
O |
||
|
| |
||
|
हायपोसल्फ्यूरस अम्ल (डायथायोनस, हायड्रोसल्फ्यूरस) |
H2S2O4 |
HO-S-S-OH |
|
| |
||
|
O |
||
|
O |
||
|
| |
||
|
HO-S-OH |
||
|
सल्फ्यूरस अम्ल |
H2SO3 |
| |
|
S |
||
|
थायोसल्फ्यूरस अम्ल |
H2S2O2 |
OO |
|
| | |
||
|
पायरोसल्फ्यूरस अम्ल |
H2S2O5 |
HO-S-S-OH |
|
| |
||
|
O |
||
|
O |
||
|
| |
||
|
सल्फ्यूरिक अम्ल |
H2SO4 |
HO-S-OH |
|
| |
||
|
O |
||
|
O O |
||
|
| | |
||
|
पायरोसल्फ्यूरिक अम्ल |
H2S2O7 |
HO-S-O-S-OH |
|
| | |
||
|
O O |
||
|
O |
||
|
| |
||
|
थायोसल्फ्यूरिक अम्ल |
H2S2O3 |
HO-S-OH |
|
| |
||
|
S |
||
|
सल्फेनिक अम्ल |
RSOH (R= अल्किल किंवा अरिल गट) |
HO-S-R |
|
O |
||
|
| |
||
|
सल्फिनिक अम्ल |
RSO2H |
HO-S-R |
|
O |
||
|
| |
||
|
सल्फॉनिक अम्ल |
RSO3H |
HO-S-R |
|
| |
||
|
O |
||
|
O |
||
|
| |
||
|
थायोसल्फॉनिक अम्ल |
RS2O2H |
H-S-S-R |
|
| |
||
|
O |
ऑक्सि-अम्लांची लवणे आणि एस्टरे माहीत आहेत, पण बऱ्याच वेळा मुक्त अम्ले अस्थिर असल्यामुळे बऱ्याच वेळा ती अलग करता येत नाहीत.
सल्फॉक्सिलिक अम्ल : हे परिकल्पित (अस्तित्व प्रत्यक्ष न दाखविलेले) अम्ल आहे. सल्फॉक्सिलेटांचे सुलभतेने ऑक्सिडीभवन होते.
हायपोसल्फ्यूरस अम्ल : सल्फ्यूरस अम्लाच्या विद्रावावर जस्तपारदमेलाने (जस्त आणि पारा यांच्या मिश्रधातूने) विक्रिया करून हे अम्ल बनविता येते. पण ते विद्रावात अस्थिर असते. हायपोसल्फाइटे विद्राव अवस्थेपेक्षा घनावस्थेत जास्त स्थिर असतात. ती प्रबल क्षपणकारक आहेत. रंजक उद्योगधंद्यात धातवीय हायपोसल्फाइटे मुख्यतः क्षपणकारक म्हणून वापरतात.
सल्फ्यूरस अम्ल : हे अम्ल मुक्तावस्थेत माहीत नाही, पण त्याच्या संहत विद्रावातून SO2. 7H2O हा सजल पदार्थ स्फटिकी स्वरूपात निराळा करता येतो. या अम्लाच्या विद्रावात मुख्यतः H+ आयन, HSO─3 (बायसल्फेट आयन) व थोड्या प्रमाणात SO─3─ (सल्फाइट आयन) असतात. ते प्रबल क्षपणकारक आहेत. त्याचे सल्फेटात व डाय-थायो-नेटात रूपांतर होते. आयोडाइड आयन व जस्त आयन यांसारख्या प्रबल क्षपणकारकांबरोबर ह्याचे विद्राव ऑक्सिडीकारकासारखे वागतात.
सामान्य सल्फाइटांपैकी फक्त क्षारीय सल्फाइटे बऱ्याच प्रमाणात विद्राव्य आहेत. सामान्य सल्फाइटे व अम्ल सल्फाइटे यांच्यावर अतिरिक्त अम्लांची विक्रिया होऊन सल्फर डाय-ऑक्साइड उत्पन्न होतो. सल्फाइटांच्या विद्रावात मुक्त गंधक विरघळले म्हणजे थायोसल्फेटे बनतात. बाय-सल्फाइटे कार्बनी संयुगाबरोबर समावेशक (एका संयुगाच्या रेणूत दुसरे संयुग वा अणुगट मिळविल्याने बनणारी) संयुगे बनवितात. बाय-सल्फाइटे क्षपणकारक आणि समावेशनकारक म्हणून उपयोगी पडतात. लाकडाच्या लगद्यापासून कागद तयार करण्याच्या उद्योगातही त्याचा उपयोग होतो.
थायोसल्फ्यूरस अम्ल : हे फक्त लवणाच्या रूपात माहीत आहे. लवणातही त्याचे विशिष्ट गुणधर्म पूर्णपणे दृष्टीस पडत नाहीत. लिग्रॉइनमध्ये विरघळलेल्या सल्फर मोनोक्लोराइडाची (S2Cl2) निर्जल सोडियम अल्किलेटावर (उदा., NaOCH3) विक्रिया करून ते बनविता येते.
पायरोसल्फ्यूरस अम्ल : हे अम्लही फक्त लवण रूपातच माहीत आहे. क्षारीय सल्फेटाचा जलीय विद्राव व सल्फर डाय-ऑक्साइड यांच्या विक्रियेने किंवा क्षारीय अम्ल सल्फेटे तापवून ते बनवितात. मुख्यतः रंजक, छपाई व छायाचित्रण या उद्योगांत त्याचा उपयोग करतात.
सल्फ्यूरिक अम्ल :गंधकाच्या संयुगांपैकी हे सर्वांत महत्त्वाचे संयुग आहे [→ सल्फ्यूरिक अम्ल].
पायरोसल्फ्यूरिक अम्ल : शुद्ध सल्फ्यूरिक अम्ल व सल्फर ट्राय-ऑक्साइड याचे समरेणवीय (रेणूची संख्या समान असलेले) परिमाण घेऊन विक्रिया केली असता हे अम्ल बनते. त्याचा वितळबिंदू ३५·१५º से. आहे. ते उत्कृष्ट सल्फॉनीकारक आहे. ते तापविले तर त्यातून सल्फर ट्राय-ऑक्साइड मुक्त होतो. याची पाण्याबरोबर विक्रिया होऊन अतिशय उष्णता उत्पन्न होते. अम्ल सल्फेट व क्षारीय धातू (पोटॅशियम, सोडियम, लिथियम इ.) तापवून क्षारीय पायरोसल्फेटे बनविता येतात.
थायोसल्फ्यूरिक अम्ल : हे फक्त सामान्य लवण रूपात माहीत आहे. त्याची लवणे फक्त घनरूपात किंवा उदासीन (अम्लीय आणि क्षारीय नसलेल्या) व क्षारीय विद्रावांतच स्थिर असतात. सामान्यतः धातवीय सल्फाइटाच्या विद्रावात मुक्त गंधक मिसळून वा सल्फाइडांचे नियंत्रित ऑक्सिडीकरण करून किंवा पॉलिथायोनाइटावर क्षारांची विक्रिया करून ही थायोसल्फाइटे बनवितात. सजल सोडियम थायोसल्फाइटे (हायपो) छायाचित्रणात उपयोगी पडते. क्लोरीन किंवा क्लोरीन संयुगे वापरून विरंजन केल्यावर वस्तूत राहिलेला क्लोरीन काढून टाकण्यासाठी याचा उपयोग करतात. आयोडिनाच्या विद्रावाबरोबर अनुमापन करून त्याची निश्चिती करता येते.
थायॉनिक अम्ले : ही अम्ले फक्त लवण स्थितीत माहीत आहेत. त्याला अपवाद डायथायॉनिक अम्ल हे आहे. ते मुक्त अवस्थेत माहीत आहे. त्याची लवणेही माहीत आहेत. सल्फ्यूरस अम्ल व सल्फाइटाचे विद्राव यांचे मँगॅनीज डाय-ऑक्साइड, परमँगॅनेट व फेरिक किंवा कोबाल्टिक हायड्रॉक्साइडे यांनी ऑक्सिडीकरण करून डायथायोनेटे आणि डायथायॉनिक अम्ल तयार करतात. डायथायॉनिक अम्ल कोठी तापमानाला व विरल विद्रावात स्थिर आहे, पण तापमान वाढविले तर त्याचे अपघटन होते. पॉलिथायोनेटे धातवीय लवण अवस्थेत निश्चितपणे माहीत आहेत. त्यांची लवणे स्थिर व पाण्यात विद्राव्य आहेत. ती सर्व दुर्बल क्षपणकारक असून त्यांची सल्फेटे बनतात. आर्सेनिक ऑक्साइडाच्या उपस्थितीत थायोसल्फेटाच्या विद्रावाची आणि सल्फर डाय-ऑक्साइडाची विक्रिया घडवून पॉलिथायोनेटे बनविता येतात.
परसल्फ्यूरिक अम्ले : मुक्त अवस्थेत ही अम्ले व त्याची लवणेही माहीत आहेत. सल्फेटे किंवा सल्फ्यूरिक अम्ल यांचे विद्युत् विच्छेदन (मूळ पदार्थातून वा त्याच्या विद्रावातून विद्युत् प्रवाह पाठवून रेणूचे तुकडे करणे) करून ती बनवितात. क्लोरोसल्फ्यूरिक अम्लाच्या किंवा त्याच्या लवणांच्या विद्रावावर हायड्रोजन पेरॉक्साइडाची विक्रिया करून ती मिळविता येतात. पेरॉक्सिसल्फ्यूरिक अम्ल (कारो अम्ल) हा एक जलशोषक स्फटिकी घन पदार्थ आहे. त्याचा वितळबिंदू ४५º से. आहे. पाणी, अल्कोहॉल, ईथर व कार्बनी अम्ले यांत ते विद्राव्य आहे. पर-डाय-सल्फ्यूरिक अम्ल (मार्शल अम्ल) हा एक जलशोषक स्फटिकी घन पदार्थ आहे. त्याचा वितळबिंदू ६५º से. आहे. वितळताना त्याचे अपघटन होते. ते प्रबल ऑक्सिडीकारक आहे. ते व त्याची लवणे आयोडेटापासून तात्काल आयोडीन मुक्त करतात. दोन्ही अम्ले हायड्रोजन पेरॉक्साइड तयार करण्यासाठी, विरंजक व कार्बनी पदार्थांचे ऑक्सिडीकरण करण्यासाठी उपयोगात आणतात.
सल्फेनिक अम्ले : एस्टरे व हॅलाइडे यांच्या रूपात ही माहीत आहेत.
सल्फिनिक अम्ले : सल्फॉनिक अम्लांच्या क्लोराइडांचे जस्ताने क्षपण करून अथवा सल्फर डाय-ऑक्साइड ईथरमध्ये विरघळवून त्याची विक्रिया योग्य त्या ग्रीन्यार विक्रियाकारकावर [→ ग्रीन्यार विक्रिया ] करून ही अम्ले बनवितात. ही हवेत अस्थिर आहेत. थायोनिल क्लोराइडाने क्लोरिनीकरण (क्लोरिनाचा समावेश) केल्याने त्यांची अम्ल क्लोराइडे बनतात.
सल्फॉनिक अम्ले :मरकॅप्टनाचे ऑक्सिडीकरण करून अल्किल सल्फाइडांची संहत नायट्रिक अम्लाशी विक्रिया करून, सल्फाइटांची अल्किल हॅलाइडांशी विक्रिया करून वा सल्फिनिक अम्लांचे ऑक्सिडीकरण करून (अल्किल) सल्फॉनिक अम्ले बनवितात. त्यांचे ॲरोमॅटिक अनुजात वाफाळणाऱ्या सल्फ्यूरिक अम्लाबरोबर ॲरोमॅटिक हायड्रोकार्बनाची विक्रिया करून बनवितात. ही संयुगे स्थिर आहेत सामान्यतः ती पाण्यात विरळघतात व त्यांपासून एस्टरे, हॅलाइडे व अमाइडे बनविता येतात. कार्बना संयुगे जलविद्राव्य व्हावीत म्हणून त्यांचे सल्फॉनीकरण करतात.
थायोसल्फॉनिक अम्ले : लवणे व एस्टरे यांच्या रूपात ही अम्ले माहीत आहेत. त्यांची लवणे, त्या त्या सल्फॉनिक अम्लांची क्लोराइडे व सल्फाइडे यांच्या विक्रियेने बनवितात. अल्किल आयोडाइडाबरोबर लवणांची विक्रिया करून एस्टरे मिळविता येतात.
इतर विविध संयुगे : सल्फॉक्साइडे (R2SO, सल्फ्यूरस अम्लाचे अनुजात) व सल्फोने (R2SO2, सल्फ्यूरिक अम्लाचे अनुजात) ही गंधकाची काही महत्त्वाची संयुगे होत. नायट्रिक अम्लाने वा हायड्रोजन पेरॉक्साइडाने सल्फाइडांचे ऑक्सिडीकरण करून सामान्यतः ॲलिफॅटिक सल्फॉक्साइडे मिळविली जातात. ॲरोमॅटिक हायड्रोकार्बनांवर सल्फर डाय-ऑक्साइडाची किंवा ॲल्युमिनियम क्लोराइडाच्या उपस्थितीत थायोनिल क्लोराइडाची विक्रिया करून ॲरोमॅटिक सल्फॉक्साइडे तयार करतात. सामान्यतः थायो-ईथरे किंवा सल्फॉक्साइडे यांचे वाफाळणाऱ्या नायट्रिक अम्लाने अथवा परमँगॅनेटाने ऑक्सिडीकरण केल्याने ॲलिफॅटिक सल्फोने मिळतात. ॲरोमॅटिक हायड्रोकार्बनांवर सल्फर ट्राय-ऑक्साइडाची विक्रिया करून किंवा सल्फॉनिक अम्लावर बेंझीन आणि फॉस्फरस पेंटा-ऑक्साइड यांची उच्च तापमानात विक्रिया करून ॲरोमॅटिक सल्फोने मिळतात. ती स्थिर, वर्णहीन व घनरूप असतात. त्यांचे अपघटन न होता ऊर्ध्वपातन (प्रथम वाफ करून व नंतर ती थंड करून अलग करणे) करता येते.
गंधकाची ऑक्सिहॅलाइडे ही सल्फॉक्सिलिक अम्ल, सल्फ्यूरस अम्ल (थायोनील अनुजात) आणि सल्फ्यूरिक अम्ल (सल्फ्यूरिल अनुजात) यांच्या अनुजातांमध्ये समाविष्ट करता येतात. अरिल मरकॅप्टन व हॅलोजने यांची नीच तापमानात विक्रिया करून अरिल सल्फर हॅलाइडे (सल्फॉक्सिलिक अम्लाचे अनुजात) बनवितात. थायोनिल हॅलाइडे ही वितळबिंदू व उकळबिंदू नीच असलेली संयुगे आहेत. सल्फ्यूरिक हॅलाइडांच्या अंगीही हा गुण आहे. ती अनुरूप थायोनील अनुजातांपेक्षा जास्त स्थिर व कमी क्रियाशील असतात.
कार्बनी सल्फॉनिल हॅलाइडे व हॅलोसल्फॉनिक अम्ले हेही सल्फ्यूरिक अम्लाचे महत्त्वाचे अनुजात होत. अल्किल व अरिल सल्फॉनिक हॅलाइडे वर्णहीन व द्रवरूप किंवा घनरूप असतात. सामान्यतः त्यांचा उकळबिंदू उच्च असतो. हॅलोसल्फॉनिक अम्ले मुक्त अवस्थेत आणि लवणे व एस्टरे यांच्या रूपात माहीत आहेत. क्लोरो संयुगांपेक्षा फ्ल्युओरो संयुगे जास्त स्थिर असतात.
हॅलोजन-गंधक संयुगांचे गुणविशेष पुढील संयुगांत आढळतात.S2F2 (सल्फरमोनोफ्ल्युओराइड), SF2, SF4, SF6, S2F10, S2Cl2, (सल्फर मोनोक्लोराइड), SCl2, SCl4 आणि S2Br2 (सल्फर मोनोब्रोमाइड). त्यांचे वितळबिंदू आणि उकळबिंदू नीच आहेत, पाण्याने त्यांचे जलीय विच्छेदन होते. याला SF6 व S2F10 ही संयुगे अपवाद आहेत. कार्बनी संयुगांच्या फ्ल्युओरीकरणासाठी उपयुक्त असे सल्फरटेट्राफ्ल्युओराइड हे एक उल्लेखनीय संयुग आहे. सल्फर क्लोराइडे रबराच्या व्यापारी उत्पादनात वापरतात, सल्फर मोनोक्लोराइड हे कोठी तापमानाला द्रव असते, कार्बनी संयुगे, गंधक, आयोडीन आणि काही धातवीय संयुगांसाठी हे विद्रावक म्हणून वापरतात. ही हॅलाइडे मूलद्रव्याच्या सरळ संयोगानेही सामान्यतः बनवितात.
सल्फोनामाइडे ही संयुगे ⇨सल्फा औषधे म्हणून ओळखली जातात. अनेक सांसर्गिक रोगांत ती वापरण्यात येतात.
अभिज्ञान : (अस्तित्व ओळखणे). मुक्त गंधक पायपरिडिनामध्ये विरघळले, तर त्या विद्रावाला तांबडा रंग येतो. गंधकाची महत्त्वाची अनेक रूपे ही परीक्षा दाखवितात.
संयुगामधील गंधकाचे अस्तित्व पुढील पद्धतीने ओळखता येते : प्रथम गंधकाचे संयुग वितळविलेल्या सोडियम धातूबरोबर तापवतात. त्यामुळे सोडियम सल्फाइड तयार होते. नंतर ते सल्फाइड अकार्बनी विश्लेषण पद्धतीने निश्चित करतात. त्यावरून गंधकाचे अस्तित्व निश्चित होते.
गंधकाची परिमाणात्मक निश्चिती करण्यासाठी गंधक असलेले संयुग केरियस यांच्या बंद नळीत वाफाळणाऱ्या नायट्रिक अम्लाबरोबर तापवितात. त्यामुळे गंधक असलेल्या संयुगाचे सल्फेट बनते. नंतर बेरियम सल्फेटाच्या रूपात अवक्षेपण करून नेहमीच्या विश्लेषण पद्धतीने गंधकाची परिमाणात्मक निश्चिती करतात [ → वैश्लेषिक रसायनशास्त्र].
विषबाधा : गंधक हे विषारी नाही, ते अपाय न होता पोटात घेता येते. गंधकाच्या धुळीमुळेही विषबाधा होत नाही, पण डोळ्यांची व श्वासनलिकेची गंधकाच्या धुळीने आग होते. धुळीने काही माणसांना इसब होतो. सल्फर डाय-ऑक्साइड एक दशलक्ष भागांत ८ ते २० भाग इतके अल्पांश असले, तरी डोळ्यांची आग होते व खोकला येतो. सल्फर डाय-ऑक्साइड हवेत प्रती दशलक्ष भागांत ५०० भाग असला, तर तत्काळ धोका असतो. हाड्रोजन सल्फाइड प्रती दशलक्ष भागांत २० भाग असले व ते ८ तासपर्यंत हुंगले गेले, तर विषबाधा होत नाही. पण हेच प्रमाण प्रती दशलक्ष भागांत १०० भाग असले, तर डोळ्यांची व श्वासनलिकेची आग होते व ते १,००० भाग असले, तर त्यापासून तत्काळ धोका उद्भवतो.
पहा : खते सल्फॉनीकरण सल्फ्यूरिक अम्ल.
संदर्भ : 1. Abbot, D. Inorganic Chemistry, London, 1965.
2. Bateman, A. M. Economic Mineral Deposits, New Delhi, 1960.
3. Haynes, W. Brimstone : The Stone That Burns, Princeton, 1959.
4. Partington, J. R.General and Inorganic Chemistry, London, 1966.
देशपांडे, ज्ञा. मा. आगस्ते, र. पां.
“