नीच तापमान भौतिकी : नीच तापमानाची निर्मिती, त्याचे मापन व अत्यंत कमी तापमानास आढळणाऱ्या–क्वचित प्रसंगी आश्चर्यकारक अशा–आविष्कारांचे भौतिकी शास्त्राच्या मूलभूत सिद्धांतांनुसार विशदीकरण या सर्वांचा समावेश नीच तापमान भौतिकी या विभागात होतो. कोठी तापमानापेक्षा (सर्वसाधारण परिस्थितीतील तापमानापेक्षा) कमी अशा कोणत्याही तापमानास नीच तापमान ही संज्ञा देणे शक्य असले, तरी सर्वसाधारणपणे –१८३° से. च्या खालील तापमानास नीच तापमान म्हणण्याचा प्रघात आहे. या तापमानास द्रव ऑक्सिजन उकळू लागतो. काही ताऱ्यांच्या गर्भातील तापमान १०१० अंश से. एवढे असावे, असा अंदाज करण्यात आला आहे. त्यावरून तापमानास काही उच्च मर्यादा असेल असे वाटत नाही. याउलट शास्त्रज्ञांस अठराव्या शतकाच्या पूर्वार्धातच कल्पना येऊ लागली होती की, नीच तापमानास एक निश्चित मर्यादा आहे. ही मर्यादा वितळणाऱ्या बर्फाच्या तापमानाच्या खाली २७३·१६° से. एवढी आहे. आदर्श वायूचे तापमान जर कमी करीत या मर्यादेपर्यंत नेले, तर त्यास दाब असणार नाही किंवा आयतन (घनफळ) असणार नाही. या सर्वांत नीच तापमानास निरपेक्ष शून्य तापमान म्हणतात. ज्या तापक्रमाचा (तापमान मोजण्याच्या मापक्रमाचा) शून्य बिंदू –२७३·१६° से. आहे व ज्याचा अंश (एकक) सेल्सिअस अंशाएवढाच आहे, अशा तापक्रमास ⇨ केल्व्हिन निरपेक्ष तापक्रम म्हणतात. सेल्सिअस अंशांमध्ये २७३·१६ मिळविले असता केल्व्हिन अंश मिळेल, हे यावरून लक्षात येईल.
पदार्थांचे तापमान नीच तापमानास नेले असता ते फार निराळे व विलक्षण गुणधर्म दाखवू लागतात. काही धातू थंड केल्या असता त्या अतिसंवाहक बनतात म्हणजे विद्युत् प्रवाह त्यांमधून पाठविला असता त्यास बिलकुल रोध होत नाही [⟶ अतिसंवाहकता]. या स्थितीमध्ये या धातू चुंबकत्वापासून संपूर्ण परिरक्षक म्हणून कार्य करतात. द्रवरूप हीलियमामध्ये तर एक निराळ्याच प्रकारची तरंग गती मिळू लागते. द्रवरूप हीलियम हा इतका अतिप्रवाही द्रायू होतो की, त्याला या स्थितीत द्रव, घन किंवा वायू यांपैकी कोणतीच संज्ञा लागू पडत नाही [⟶ अतिप्रवाहिता]. या आविष्काराचे रूढ भौतिकी सिद्धांताप्रमाणे स्पष्टीकरण देणे शक्य होत नाही व याकरिता ⇨ पुंज सिद्धांताचाच आश्रय घ्यावा लागतो.
द्रव्याच्या गत्यात्मक सिद्धांताप्रमाणे पदार्थातील उष्णता ही त्यामधील रेणूंच्या इतस्ततः गतिज ऊर्जेच्या स्वरूपात असते [⟶ द्रव्याचा गत्यात्मक सिद्धांत]. तापमान वाढविले की, रेणूची व्यक्तिगत इतस्ततः गतिज ऊर्जा वाढते. याचाच अर्थ त्यामधील अनवस्था किंवा अव्यवस्थितपणा वाढतो. भौतिकीमध्ये अनवस्थेचे मूल्यमापन ⇨ एंट्रॉपी या राशीच्या साहाय्याने केले जाते. पदार्थाचे तापमान वाढले की, जशी त्यामधील अनवस्था वाढते तशी त्याची एंट्रॉपी वाढते. पदार्थाचे तापमान कमी करण्याकरिता त्यामधील उष्णता काढून घ्यावी लागेल किंवा त्यामधील अनवस्थेचे परिणाम बाहेरून काहीतरी कार्य करून कमी करावे लागेल. या दोन्ही प्रकारच्या रीतींचा उपयोग आधुनिक नीच तापमान संशोधनात करण्यात आला आहे.
डब्ल्यू. नेर्न्स्ट यांच्या सिद्धांताप्रमाणे निरपेक्ष शून्य तापमानास सर्व पदार्थांची एंट्रॉपी शून्य असावयास पाहिजे अथवा या तापमानास पदार्थातील अनवस्थेचे परिमाण शून्य होत असले पाहिजे. या अवस्थेपेक्षा जास्त व्यवस्था प्रस्थापित करण्याची कल्पनासुद्धा शक्य नसल्यामुळे या तापमानापेक्षा कमी तापमान शक्य असत नाही, असा युक्तिवाद करता येतो. या अवस्थेमधील पदार्थाच्या रेणूंची गतिज ऊर्जा शून्य नसून तिला काहीतरी मूल्य असते, असे आधुनिक पुंज सिद्धांताप्रमाणे दाखविता येते. नेर्न्स्ट यांच्याच निष्कर्षानुसार कोणत्याही पदार्थाचे तापमान सम्यकपणे (तंतोतंतपणे) शून्य करता येणार नाही किंवा ते शून्य झाले आहे हे सुद्धा निरीक्षणाद्वारे सिद्ध करता येणार नाही. कोणत्याही राशीचे मापन करण्याच्या क्रियेमध्ये काहीतरी ऊर्जेची देवघेव होणे आवश्यक असते (उदा., मनुष्याचे तापमान काढण्याकरिता वापरण्यात येणारा तापमापक मनुष्याच्या शरीरातून औष्णिक ऊर्जेचे जेव्हा शोषण करतो तेव्हा त्यामुळे त्यातील पारा प्रसरण पावून त्याचे तापमान दाखवितो). शून्य तापमानास ही देवघेव होणे शक्य होत नाही असे दाखविणे सोपे आहे.
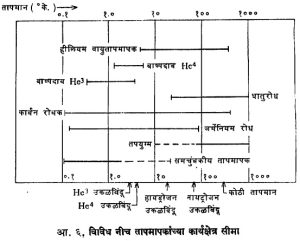
केल्व्हिन तापक्रमानुसार काही विशिष्ट उच्च व नीच तापमानांची मूल्ये आ. १ मध्ये दाखविली आहेत.
नीच तापमान निर्माण करण्याच्या पद्धती : वितळणाऱ्या बर्फापेक्षा (म्हणजे अंदाजे २७३° के.) कमी असे तापमान प्रयोगशाळेत मिळविण्याकरिता ऐतिहासिक दृष्ट्या बाष्पसंकोचन पद्धती वापरण्यात आली. या पद्धतीत कोठी तापमानास बाष्प स्वरूपात असणारा क्लोरीन, अमोनिया, कार्बन डाय-ऑक्साइड यासारखे द्रव्य घेऊन त्यावर वातावरणीय दाबाच्या कित्येक दशक किंवा शतक एवढा दाब दट्ट्याच्या साहाय्याने अथवा अन्य रीतीने लावला असता त्याचे (कोठी तापमानास) द्रवात रूपांतर होते. या संकोचन क्रियेमध्ये द्रव्यातून उष्णता बाहेर टाकली जाते. ज्या पात्रात द्रव्याचे संकोचन केले जाते त्याभोवती खेळते पाणी सोडून ही उष्णता काढून घेतली जाते व संकोचित द्रव्याचे तापमान परत कोठी तापमानाएवढे करण्यात येते. यानंतर जर द्रवावरील दाब कमी करून त्याचे मोठ्या प्रमाणात बाष्पीभवन होऊ दिले, तर (माठातील पाण्याचे तापमान त्याचे बाष्पीभवन होऊ दिल्यामुळे जसे कमी होते त्याच प्रकारे) इष्ट द्रव्याचे तापमान खूप प्रमाणात खाली येते. संकोचन व बाष्पीभवन या क्रिया कोठी तापमानास न करता त्यापेक्षा खाली असलेल्या तापमानास केल्यास द्रवीकरण क्रियेची क्षमता वाढते आणि तसे करणे सोयीस्करही ठरते. याकरिता द्रव्य ज्या पात्रात ठेवले आहे त्याभोवती शीतकारी मिश्रणे ठेवली जातात (उदा., बर्फ व मीठ यांचे मिश्रण). या रीतीचा उपयोग करून १७९८ साली अमोनियाचे व १८२३ मध्ये क्लोरिनाचे द्रवीकरण करण्यात यश आले. १८३५ मध्ये घन कार्बन डाय-ऑक्साइड (म्हणजे सुका बर्फ) मिळविण्यात यश आले. वरील प्रकारे मिळालेल्या द्रवाचे त्याहून कमी गोठणबिंदू असणाऱ्या द्रव्याचे प्रशीतन करण्याकडे उपयोग करण्यात येऊ लागला. वातावरणीय दाबाच्या ५० पट दाब वापरून, आणि घन कार्बनडाय ऑक्साइड व ईथर यांच्या मिश्रणाचा उपयोग करून १६३° के. इतके किमान तापमान मायकेल फॅराडे यांनी मिळविल्याचा उल्लेख आहे. विविध प्रकारचे प्रयत्न करूनसुद्धा नायट्रोजन, ऑक्सिजन, हायड्रोजन, हीलियम इ. वायूंचे द्रवीकरण करणे शक्य झाले नाही. या कारणाकरिता वरील वायूंना ‘नित्य वायू’ असे नाव देण्यात आले. वरील प्रयोगाच्या असफलतेचे कारण टॉमस अँड्रूज (१८६३) यांच्या प्रयोगावरून स्पष्ट झाले. त्यांच्या प्रयोगाने असे सिद्ध झाले की, कोणत्याही वायूवरील फक्त दाब वाढवून, त्याचे द्रवीकरण करण्याकरिता त्याचे प्राथमिक तापमान त्या वायूकरिता असलेल्या एका विशिष्ट तापमानापेक्षा कमी असावयास हवे. हे विशिष्ट तापमान निरनिराळ्या वायूंकरिता निरनिराळे असून त्यास त्या वायूचे क्रांतिक तापमान असे म्हणतात. विविध वायूंकरिता असणारी क्रांतिक तापमानाची मूल्ये कोष्टकात दाखविली आहेत.
| विविध वायूंचे क्रांतिक तापमान | |
| वायू | क्रांतिक तापमान ( °के.) |
| हीलियम
हायड्रोजन नायट्रोजन ऑक्सिजन कार्बन डाय-ऑक्साइड |
५·२६
३३·२६ १२६·०६ १५४·३६ २४२·१६ |
सर्वस्वी हीच रीत वापरून नायट्रोजन आदी नित्य वायूंचे द्रवीकरण करणे शक्य का झाले नाही हे या माहितीवरून स्पष्ट होते. अंतिम शीतन करून यांचे द्रवीकरण करण्याकरिता जूल-टॉमसन परिणामाचा (जे. पी. जूल व विल्यम टॉमसन–मागाहून लॉर्ड केल्व्हिन – यांच्या नावाने ओळखण्यात येणाऱ्या परिणामाचा) उपयोग करतात [⟶ वायूंचे द्रवीकरण ऊष्मागतिकी]. पण ही रीत कार्यान्वित करण्याकरिता वायूंचे प्राथमिक तापमान बरेच कमी असावे लागते. या कार्याकरिता वरील पद्धतीमधील मुख्य तत्त्वाचाच उपयोग करून वायूचे प्राथमिक शीतन करतात. या रीतीचे वर्णन खाली केले आहे.
प्रशीतक आवर्तन पद्धत : या पद्धतीमध्ये एका सिलिंडरामध्ये दट्ट्याच्या साहाय्याने इष्ट वायूचे संकोचन केले जाते. त्यामुळे उत्पन्न होणारी उष्णता खेळणाऱ्या पाण्यासारख्या शीतकाच्या द्वारे शोषून घेतली जाते. यामुळे वायूचे तापमान स्थिर राहून ही संकोचन क्रिया समतापी (स्थिर तापमानाला आयतनात व तापमानात बदल होणारी) होते. यानंतर वायूस औष्णिक दृष्ट्या संपूर्णपणे निरोधित अशा दुसऱ्या सिलिंडरात प्रसरण पावू दिले जाते. प्रसरणाच्या अखेरीस वायूचा दाब संकोचन करण्याआधी त्याचा जो दाब होता तो अंदाजे तेवढाच परत होतो. ही प्रसरण क्रिया असंक्रमी (ज्यात उष्णता दिली वा घेतली जात नाही अशी) असल्यामुळे वायूचे तापमान खाली येते. ज्या सिलिंडरामध्ये वायूचे प्रसरण होते त्यामध्ये दट्ट्या ठेवला व आत येणाऱ्या संकोचित वायूच्या द्वारे त्याला पुढे मागे हालवून वायूकडून कार्य करून घेतले, तर वायूच्या तापमानात होणारी घट आणखीच वाढते. ऊर्जा अक्षय्यता तत्त्वाप्रमाणे [⟶ द्रव्य आणि ऊर्जा यांची अक्षय्यता] हे कार्य करण्यास लागणारी ऊर्जा वायूच्या अंतःस्थ औष्णिक ऊर्जेपासून मिळाली असणार हे उघड आहे. अशी योजना असलेल्या यंत्रास प्रसरण एंजिन असे म्हणतात. यानंतर थंड झालेला वायू संकोचक विभागाकडे परत पाठविला जातो व अशा रीतीने एक आवर्तन पूर्ण होते. प्रत्येक आवर्तनानंतर वायूच्या तापमानात सतत घट होत जाते.
संकोचकाकडून जास्त तापमानाचा वायू प्रसरण एंजिनाकडे जातो व कमी तापमानाचा वायू त्याकडे दुसऱ्या मार्गाने परत येतो. या क्रियेमध्ये उष्णतेचे क्षरण (गळती) होऊन प्रक्रियेची क्षमता कमी होण्याचा खूप संभव असतो. ही गोष्ट टाळून तिची क्षमता वाढविण्याकरिता उष्णताविनिमयक (दोन द्रायू–द्रव किंवा 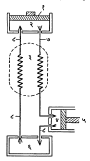 वायू– एकमेकांपासून अलग ठेवून अधिक तापमानाच्या द्रायूतील उष्णतेने कमी तापमानाच्या द्रायूला तापविणारे साधन) वापरतात. त्याच्या कार्याची कल्पना आ. २ वरून येईल. या विनिमयकाच्या सर्वांत साध्या प्रकारात दोन तांब्याच्या समकेंद्री नळ्या असतात. आतील नळीमधून जास्त तापमानाचा संकोचित केलेला वायू प्रसरण एंजिनाकडे वाहतो, तर बाहेरील नळीतून थंड झालेला वायू संकोचकाकडे परत जात असतो. या दोन प्रवाहांमध्ये उष्णतेची देवघेव होऊन आतील वायू थंड होतो, तर बाहेरील वायू जास्त गरम होतो. या आवर्ती प्रक्रियेचा उपयोग करून वायूचे थेट द्रवात रूपांतर करणे योग्य समजले जात नाही. कारण संकोचक किंवा प्रसरण एंजिन यांमध्ये द्रव निर्माण झाल्यास त्यापासून त्यामधील दट्ट्याच्या हालचालीला अडथळा येऊन त्यामुळे वंगणक्रिया इ. बाबतीत तांत्रिक अडचणी निर्माण होतील. अंतिम द्रवीकरण जूल–टॉमसन परिणामाचा उपयोग करून करण्यात येते.
वायू– एकमेकांपासून अलग ठेवून अधिक तापमानाच्या द्रायूतील उष्णतेने कमी तापमानाच्या द्रायूला तापविणारे साधन) वापरतात. त्याच्या कार्याची कल्पना आ. २ वरून येईल. या विनिमयकाच्या सर्वांत साध्या प्रकारात दोन तांब्याच्या समकेंद्री नळ्या असतात. आतील नळीमधून जास्त तापमानाचा संकोचित केलेला वायू प्रसरण एंजिनाकडे वाहतो, तर बाहेरील नळीतून थंड झालेला वायू संकोचकाकडे परत जात असतो. या दोन प्रवाहांमध्ये उष्णतेची देवघेव होऊन आतील वायू थंड होतो, तर बाहेरील वायू जास्त गरम होतो. या आवर्ती प्रक्रियेचा उपयोग करून वायूचे थेट द्रवात रूपांतर करणे योग्य समजले जात नाही. कारण संकोचक किंवा प्रसरण एंजिन यांमध्ये द्रव निर्माण झाल्यास त्यापासून त्यामधील दट्ट्याच्या हालचालीला अडथळा येऊन त्यामुळे वंगणक्रिया इ. बाबतीत तांत्रिक अडचणी निर्माण होतील. अंतिम द्रवीकरण जूल–टॉमसन परिणामाचा उपयोग करून करण्यात येते.
जूल-टॉमसन परिणामावर आधारित पद्धत : या आविष्कारामध्ये मिळणारा परिणाम म्हणजे वायूच्या तापमानात घट, खूप मोठ्या प्रमाणात संकोचित केलेल्या वायूचे एका विशिष्ट प्रकारे असंक्रमी प्रसारण करू दिल्यामुळे मिळते. एका पात्रात ठेवलेला उच्च दाबाचा वायू एका सच्छिद्र गुडदी अथवा बुचाच्या द्वारे दुसऱ्या पात्रात शिरत असतो. पहिल्या पात्रातील दाब स्थिर ठेवलेला असतो, तर दुसऱ्या पात्रातील दाब त्यापेक्षा खूप कमी मूल्यावर स्थिर ठेवलेला असतो. सच्छिद्र गुडदी ही सूक्ष्म छिद्रे असलेल्या कापसाच्या बोळ्यासारख्या पदार्थाची बनविलेली असते (या कार्याकरिता एका तोंडाशी अगदी बारीक तोटी असलेली नळी सुद्धा वापरता येते). त्यामुळे वायूला एका पात्रातून दुसऱ्या पात्रात जाण्याकरिता अनेक समांतर सूक्ष्म रंध्रमार्ग उपलब्ध होतात, असे समजता येईल. प्रसरण पावणारा वायू व परिसर यांमध्ये उष्णतेची देवघेव होऊ नये याकरिता औष्णिक निरोधक वापरलेला असतो. वायूचे प्रसरण जर एका ठराविक क्रांतिक मूल्यापेक्षा कमी असलेल्या तापमानावर झाले, तर या प्रसरणामुळे वायू थंड होतो. हे क्रांतिक तापमान निरनिराळ्या वायूंकरिता भिन्न असून त्याचे मूल्य संकोचित वायूच्या प्राथमिक दाबावर अवलंबून असते. उदा., हवेकरिता क्रांतिक तापमानाचे मूल्य ६००° के. असून महत्तम शीतन जेव्हा दाब वातावरणीय दाबाच्या ४५० पटींनी जास्त असेल तेव्हा मिळते. जर हे प्रसरण योग्य तापमान व दाब हे न वापरता केले, तर वायू थंड व्हावयाच्या ऐवजी गरम सुद्धा होऊ शकतो, असे दाखविता येते. हायड्रोजनाकरिता क्रांतिक तापमान ६०° ते ८०° के. तर दाब १५० वातावरणे इतका असतो. त्यामुळे त्या वायूचे जूल-टॉमसन परिणाम वापरून शीतन करण्याकरिता त्याचे प्राथमिक शीतन द्रवरूप हवेच्या साहाय्याने करावे लागते. द्रवरूप हायड्रोजनाने हीलियमाचे प्राथमिक शीतन केल्यानंतरच जूल–टॉमसन परिणामाचा उपयोग करून त्याचे द्रवात रूपांतर करता येते. एच्. कामर्लिंग-ऑनेस यांनी लायडन (हॉलंड) येथे १९०८ साली ही रीत वापरून द्रवरूप हीलियम प्रथम प्रयोगशाळेत मिळविला. द्रवावरील बाष्प पंपाच्या साहाय्याने वेगाने दूर काढून घेऊन, द्रवाचे तीव्र बाष्पीभवन करून ०·७° के. एवढे तापमान निर्माण करण्यात त्यांनी यश मिळविले.
आधी वर्णन केलेल्या पद्धतीच्या मानाने जूल-टॉमसन परिणामावर आधारित असलेली पद्धत तितकी कार्यक्षम नाही पण तिचा क्रम अखंड आवर्तनी राहतो व तिच्यामध्ये थंड झालेल्या कोणत्याही भागात प्रसरण एंजिनामधील दट्ट्यासारखे गतियुक्त भाग असत नाहीत. ही शेवटची गोष्ट महत्त्वाची आहे कारण अशा नीच तापमानास सक्षम कार्य करतील अशी वंगणे सध्या तरी उपलब्ध नाहीत. या पद्धतीत सुद्धा उष्णताविनिमयकासारखी योजना वापरून पुनर्जननी शीतन करून प्रक्रियेची कार्यक्षमता वाढविलेली असते. याकरिता जूल-टॉमसन प्रसरणामुळे थंड झालेला वायू संकोचकाकडे परत जाताना त्यापासून सच्छिद्र गुडदीकडे येणाऱ्या वायूच्या प्रवाहाच्या उष्णतेचे शोषण करून त्यास थंड करतो. द्रव स्थितीतील वायूंचा संचय जेम्स देवार यांनी संशोधित केलेल्या निर्वात पात्रात करण्यात येतो. शास्त्रीय कार्याकरिता शोधून काढलेली ही प्रयुक्ती सर्वसामान्य मनुष्याच्या जीवनात थर्मास पात्र या स्वरूपात उपयोगी पडू लागली आहे [⟶ थर्मास]. याच संशोधनातून अनेक घरांतून आढळणाऱ्या प्रशीतकांची (रेफ्रिजेटरांची) निर्मिती पण शक्य झाली.
हवेचे द्रवीकरण : हवेचे प्रथम समतापी संकोचन, नंतर असंक्रमी प्रसरण व शेवटी जूल-टॉमसन प्रसरण या तत्त्वाचा उपयोग करून वातावरणातील हवेचे मोठ्या प्रमाणावर द्रवीकरण करण्याकरिता विल्यम हॅम्पसन आणि कार्ल फोन लिंडे यांनी १८९५च्या सुमारास यंत्रे तयार केली. यामुळे औद्योगिक क्षेत्रात लागणारे ऑक्सिजन, नायट्रोजन, आर्गॉन इ. वायू उपलब्ध होऊ लागले. या यंत्ररचनेमध्ये जी. क्लोड, पी. एल्. काप्यिट्स यांनी अनेक सुधारणा केल्या [⟶ वायूंचे द्रवीकरण].
असंक्रमी विचुंबकीकरण : वायूचे संकोचन व असंक्रमी अथवा जूल-टॉमसन प्रसरण करून द्रवीकरण व मिळणाऱ्या द्रवाचे बाष्पीभवन करून ०·७° के. एवढे किमान तापमान प्रयोगशाळेत मिळाल्याचा उल्लेख मागे आला आहेच. यापेक्षा कमी तापमान मिळविण्याकरिता रूढ पद्धतींचा उपयोग होत नाही असे आढळून आले. त्यामुळे या कार्याकरिता एका निराळ्याच तत्त्वावर आधारित अशी पद्धत शोधून काढणे आवश्यक आहे, हे स्पष्ट झाले. १९२६ मध्ये डब्ल्यू. एफ्. जीओक व पी. जे. डब्ल्यू. डेबाय यांनी स्वतंत्र रीत्या एक नवीन पद्धत सुचविली. ही पद्धत म्हणजे असंक्रमी विचुंबकीकरणाची (चुंबकत्त्व नाहीसे करण्याची) होय.
पदार्थामधील तापमानाचे वर्णन त्यामधील सुव्यवस्था (व्यवस्थित मांडणी) व अनवस्था (अव्यवस्थितपणा) या कल्पनांच्या साहाय्याने करता येते. येथे सुव्यवस्था आणि अनवस्था हे शब्द सापेक्ष अर्थाने वापरले आहेत असे समजावे. अनवस्था जशी कमी होत जाते तशी सुव्यवस्था वाढत जाते असे मानावे. पदार्थातील सुव्यवस्थेचे मूल्यमापन त्यामधील सूक्ष्म अणू किंवा रेणू यांची अवकाशातील मांडणी व त्यांना असणारे गतिस्वातंत्र्य यांवरून करता येते. गोठलेल्या पाण्यातील म्हणजे बर्फाच्या स्फटिकांतील रेणूंची रचना ठरीव व व्यवस्थित असते. त्याला एक ठराविक आकृतिबंध असतो पण स्फटिक जालकाच्या कोपऱ्याशी असलेले रेणू स्थिर नसून ते आपल्या स्थानाभोवती इतस्ततः दोलने करीत असतात. तापमान जसे जास्त होते त्या प्रमाणात या दोलनाचा परमप्रसर (स्थिर स्थितीपासून होणारे महत्तम स्थानांतरण) वाढतो. जर हे रेणू पूर्णपणे स्थिर असते, तर सुव्यवस्थेचे प्रमाण जास्त झाले असते. दोलनामुळे त्यांच्या स्थान निर्धारणामध्ये अनिश्चितता येते व त्यामुळे सुव्यवस्था कमी होते असे म्हणता येते. हिमस्फटिकाला सारखी उष्णता दिली असता एक ठराविक टप्प्याला त्यामधील जालक मांडणी मोडते व त्याचे पाणी होते. या पाण्यातील रेणू द्रवामध्ये कोठेही जाऊ शकतात. त्यांचे गतिस्वातंत्र्य वाढते व याच प्रमाणात त्यामधील सुव्यवस्था कमी होते असे म्हणता येते. पाण्यास आणखी उष्णता देऊन त्याची वाफ बनविल्यास हे रेणू संपूर्णपणे मुक्त होतात व अवकाशात कोठेही संचार करू शकतात. या अवस्थेत त्यामधील सुव्यवस्थेचे प्रमाण सर्वांत कमी आहे, हे स्पष्ट होते. पदार्थाचे तापमान जेवढे कमी तेवढी त्याच्या रेणूंमधील सुव्यवस्था जास्त व त्यामधील एंट्रॉपीही कमी हे परस्परसंबंध वरील उदाहरणावरून स्पष्ट होतात. वरील उदाहरणात सुव्यवस्थेचे प्रमाण पदार्थातील रेणूच्या अवकाशातील स्थान निर्धारणावरच अवलंबून आहे असे गृहीत धरले आहे. काही पदार्थांच्या रेणुकणांशी काही विशिष्ट दिशीय राशी संबंधित असतात. गॅडोलियन सल्फेट, आयर्न अमोनियम, ॲलम (तुरटी) यांसारख्या समचुंबकीय लवणांच्या रेणूंना नित्य असे चुंबकीय परिबल असते [⟶ चुंबकत्त्व]. हे परिबल त्यामधील इलेक्ट्रॉनांच्या स्वतःच्या आसाभोवती परिभ्रमण (अथवा परिवलन) गतीमुळे निर्माण होते. रेणूमधील प्रत्येक इलेक्ट्रॉनाला या गतीमुळे निर्माण होणारे चुंबकीय परिबल एकाच मूल्याचे असले, तरी या परिबलाच्या दिशा निरनिराळ्या असू शकतात. रेणूमधील सर्व इलेक्ट्रॉनांच्या चुंबकीय परिबलांचे सदिश रीतीने काढलेले परिणामी मूल्य [⟶ सदिश] अशून्य असेल, तर त्या रेणूला नित्य असे चुंबकीय परिबल असते व तो एका सूक्ष्म चुंबकाप्रमाणे वागतो. बाहेरून चुंबकीय क्षेत्र जर लावले नाही, तर या प्रकारचा पदार्थ चुंबकीय गुणधर्म दाखवित नाही, कारण यामधील रेणूच्या व्यक्तिगत चुंबकीय परिबलांच्या दिशा इतस्ततः सर्व दिशांत सारख्या विखुरलेल्या असतात. त्यामुळे कोणत्याही एका दिशेत परिणामी चुंबकीय परिबल शून्य असते. हा परिबलाचा इतस्ततः विखुरलेला दिक्विन्यास (दिशांची मांडणी) अनवस्था अथवा एंट्रॉपी निर्माण करतो. जर आपण १° के. पर्यंत थंड केलेले समचुंबकीय लवण घेतले, तर त्यामधील स्थान स्थान-निर्धारणामुळे मिळणाऱ्या अनवस्थेचे मूल्य जवळजवळ नगण्य असते. त्यामधील शिल्लक असलेली अनवस्था अथवा एंट्रॉपी हा त्यांच्या रेणूच्या इतस्ततः विखुरलेल्या दिक्विन्यासामुळेच निर्माण झालेली असते, असे मानण्यास हरकत असत नाही. या पदार्थाभोवती द्रवरूप हीलियमाचे शीतकारी मिश्रण ठेवले आणि नंतर ५–१० हजार ओर्स्टेड या प्रतीचे त्यावर चुंबकीय क्षेत्र लावले, तर या चुंबकीय क्षेत्रामुळे रेणवीय सूक्ष्म चुंबकांवर प्रेरणायुग्म (एकरेषीय नसलेल्या, समान व विरुद्ध दिशा असलेल्या समांतर प्रेरणांच्या जोड्या) कार्य करून त्यांना क्षेत्र दिशेशी जास्तीत जास्त समांतर करण्याचा प्रयत्न करतील. यामुळे पदार्थांचे चुंबकीकरण होऊन काही अंतस्थ ऊर्जा उष्णतेच्या स्वरूपात बाहेर टाकली जाईल. ही ऊर्जा सभोवती असलेला द्रवरूप हीलियम शोषून घेईल. ही क्रिया मागील पद्धतीत वर्णन केलेल्या वायूच्या समतापी संकोचन क्रियेशी समतुल्य आहे असे दिसून येईल. यानंतर पदार्थ औष्णिक दृष्ट्या निरोधित करून त्यावरील चुंबकीय क्षेत्र काढून घेतले, तर रेणवीय सूक्ष्मचुंबक परत आपल्या इतस्ततः दिक्विन्यास असलेल्या अवस्थेत जाण्याचा प्रयत्न करतील. या कार्याकरिता लागणारी ऊर्जा पदार्थाच्या अंतस्थ उष्णतेपासूनच मिळणे शक्य असल्यामुळे पदार्थाच्या तापमानात घट होते. मागील पद्धतीत वर्णन केलेल्या वायूच्या असंक्रमी प्रसरण क्रियेसारखी ही क्रिया आहे हे लक्षात येईल. या असंक्रम पद्धतीने लायडन येथे डब्ल्यू. जे. डी. हास व ई. सी. वीर्झ्मा यांनी १९३५ मध्ये ०·००३° के. एवढे तापमान मिळविले. या पद्धतीचा उपयोग ०·१° के. ते ०·००१° के. या तापमानाच्या टप्प्यातच होऊ शकतो असे आढळले कारण ०·००१° के. तापमानाला सूक्ष्म रेणवीय चुंबकांच्या दिक्विन्यासात संपूर्ण सुव्यवस्था प्रस्थापित होते, असे दाखविता येते. यापेक्षा कमी तापमान निर्माण करण्याकरिता अणुकेंद्रकीय परिवलन गतीमुळे निर्माण होणाऱ्या समचुंबकत्त्वाचा उपयोग करावा असे सी. जे. गोर्टर, एन्. कुर्टी आणि एफ्. ई. सायमन यांनी स्वतंत्रपणे १९३५ मध्ये सुचविले.
अणुकेंद्रीय समचुंबकत्व परिमाणावर आधारित शीतन : या पद्धतीत वापरावयास उपयुक्त अशा पदार्थांच्या अणूंना इलेक्ट्रॉनांच्या परिवलन गतीमुळे काही चुंबकीय परिबल असत नाही, पण त्यांच्या अणुकेंद्रांना त्यांच्या परिवलन गतीमुळे परिणामी नित्य चुंबकीय परिबल असते. अणुकेंद्रांच्या गतीमुळे अणूंना मिळणारे चुंबकीय परिबल इलेक्ट्रॉन परिवलन गतिजन्य परिबलाशी तुलना करता हजार पटीपेक्षा सुद्धा बरेच कमी असते. त्यामुळे चुंबकीय क्षेत्रात अणूंची वर्तणूक प्रतिचुंबकीय [⟶ चुंबकत्व] स्वरूपाची आढळते. बाहेरून चुंबकीय क्षेत्र लावून पदार्थातील निरनिराळ्या अणुकेंद्रांच्या चुंबकीय परिबल दिशा समांतर करावयाच्या झाल्या, तर त्याकरिता उच्च मूल्याच्या H/T गुणोत्तराचा (H लावावयाचे चुंबकीय क्षेत्र आणि T पदार्थाचे तापमान) वापर करावा लागतो. उदा., तापमान १° के. करिता दहा लक्ष ओर्स्टेड एवढे चुंबकीय क्षेत्र लागेल. प्रयोगशाळेत आतापर्यंत जे सर्वांत उच्च असे क्षेत्र निर्माण करण्यात आले आहे त्यापेक्षा वरील मूल्य कितीतरी पटींनी जास्त आहे. ०·०१° के. या तापमानाकरिता व जवळजवळ H/T गुणोत्तर मूल्याकरिता एक लाख ओर्स्टेड क्षेत्र पुरे होईल. या प्रतीचे क्षेत्र मात्र निर्माण करणे शक्य आहे. कुर्टी व त्यांचे सहाध्यायी यांनी वरील पद्धतीचा उपयोग करून २ X १०-५ अंश के. एवढे तापमान १९५६ साली मिळविले. या कार्याकरिता त्यांनी तांबे या अणुकेंद्रीय समचुंबकीय पदार्थाचा वापर केला. समचुंबकीय लवणाचे विचुंबकीकरण करून प्रथम ०·०१२° के. एवढे तापमान मिळवून तांब्याचे त्याद्वारे प्राथमिक शीतन केले. या तापमानावरच तांबे असताना त्यावर २०–२८ हजार ओर्स्टेड या प्रतीचे चुंबकीय क्षेत्र लावले. या क्षेत्रामुळे तांब्यामधील अणुकेंद्रांच्या चुंबकीय परिबल दिशा बऱ्याच मोठ्या प्रमाणात एकमेकींशी समांतर अशा करण्यात आल्या. या चुंबकीकरणामध्ये जी उष्णता बाहेर पडली ती सभोवती असलेल्या शीतकाने शोषून घेतली. या तापमानाच्या तांब्याचे संपूर्णपणे विलगीकरण करण्यात येऊन त्यावर लावलेले चुंबकीय क्षेत्र काढून घेतले. या परिस्थितीत अणुकेंद्रामध्ये परस्परक्रिया होऊन ते चुंबकीय क्षेत्रातील सुव्यवस्थित स्थितीपासून परत काही अंशी इतस्ततः दिक्विन्यासाकडे जाण्याचा प्रयत्न करतात. या कार्याकरिता लागणारी ऊर्जा पदार्थापासूनच मिळविली जात असल्यामुळे पदार्थाच्या तापमानात खूप घट होते. येथे हे नमूद केले पाहिजे की, पदार्थाचे तापमान ०·०१° के. इतके कमी केल्याशिवाय त्याच्या अणुकेंद्रांतील परस्परक्रियेचे परिमाण आवश्यक एवढे मूल्य घेत नाही. वरील तापमान मिळविण्यात निरनिराळ्या प्रकारच्या अनेक तांत्रिक अडचणी आल्या; पण त्या सर्वांवर यशस्वी रीतीने मात करण्यात आली.
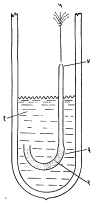
He3-He4 विरलीकरण प्रशीतक : हीलियमाची He3 आणि He4 अशी दोन समस्थानिक (अणुक्रमांक तोच पण अणुभार भिन्न आहेत अशी) स्वरूप आहेत. त्यांपासून मिळालेल्या द्रव्यांचे गुणधर्म अगदी निराळे आहेत. त्यांचे उकळबिंदू अनुक्रमे ३·१९° के. व ४·२१° के. एवढे आहेत. He3 द्रवाची घनता व सुप्त उष्णता (तापमान न बदलता १ ग्रॅम पदार्थाची अवस्था बदलण्यासाठी लागणारी उष्णता) He4 द्रवापेक्षा काही पटीने कमी, तर त्याचा बाष्प दाब काही पटीने जास्त आहे असे आढळून येते. हे दोन द्रव एकमेकांत मिसळले, तरी मिश्रणाचे तापमान कमी होते असे आढळते. कोठी तापमानास, पाणी व अल्कोहॉल यांचे मिश्रण केल्यास ज्याप्रमाणे मिश्रणाचे तापमान कमी होते तसाच काहीसा प्रकार येथे घडून येतो. या गुणधर्मावर आधारित प्रशीतकाची कल्पना एफ्. लंडन, जी. आर्. क्लार्क व ई. मेंडोसा यांनी १९६२ मध्ये सुचविली. या प्रकारचा प्रशीतक लायडन येथे १९६५ मध्ये तर ब्रिटन, रशिया, अमेरिकेची संयुक्त संस्थाने या देशांत १९६६ मध्ये कार्यवाहीत आणला गेला. या प्रशीतकाची ढोबळ रूपरेषा आ. ३ (अ) मध्ये दाखविली आहे.
प्रशीतकाच्या सर्व बाजूंस सामान्य व विपुल He4 चा द्रव ठेवलेला असतो. याचे तापमान ४·२° के. असल्यामुळे त्याचे संरक्षण करण्याकरिता त्याभोवती द्रवरूप नायट्रोजन (७८° के.) ठेवलेला असतो. एका विशिष्ट कोठीत (१) कमी बाष्पदाबाचा He4 द्रव ठेवलेला असतो. बाष्पीभवनामुळे त्याच्या तापमानात घट होऊन ते १° के. एवढे होत. यामुळे त्याच्या खाली उच्च निर्वातामध्ये लोंबत ठेवलेल्या शीतक विभाग (२) आणि (३) यांचे औष्णिक दृष्ट्या परिरक्षण होते. शीतक विभाग (२) यास बाष्पपात्र म्हणतात, तर विभाग (३) यास मिश्रक म्हटले जाते. या दोन विभागांस जोडणारी नलिका (४) ही उष्णता–विनिमयक म्हणूनसुद्धा कार्य देते. प्रशीतकाचे कार्य चालू करण्याकरिता ४०% व ६०% यांच्या द्रवमिश्रणाने प्रशीतक भरला जातो. या वेळी बाष्पपात्रामधील द्रवाची पातळी प एवढी असते. या द्रवावरील बाष्पामध्ये He3 चे प्रमाण जास्त असते कारण त्याचा बाष्पदाब He4 च्या सापेक्षतेने जास्त असतो, त्यावरील अवकाशात निर्वात अनुरक्षण करणाऱ्या पंपामुळे ही बाष्पे जेव्हा काढून टाकली जातात तेव्हा यामुळे होणाऱ्या द्रुत बाष्पीभवनाने बाष्पपात्रातील द्रवाचे शीतन होऊन, त्याचे तापमान ०·६° के. इतके होते व राहिलेल्या द्रवात He4 चे प्रमाण वाढते. He4 घटकाची औष्णिक संवाहकता उच्च प्रतीची असल्यामुळे आणि मिश्रक व बाष्पपात्र यांमध्ये नलिका उष्णता-विनियमक म्हणून कार्य करीत असल्यामुळे बाष्पपात्र व मिश्रक यांमधील द्रवाचे तापमान ०·६° के एवढे खाली येते. He3 व He4 यांचे एकजिनसी मिश्रण असलेल्या द्रवाचे तापमान ०·८° के. यापेक्षा खाली नेले असता त्यापासून परत एकजिनसी अशी दोन घटक मिश्रणे अलग होतात परंतु या दोन घटकांमध्ये He3 व He4 यांचे सापेक्ष प्रमाण निरनिराळे असते. या प्रकारच्या विक्रियेची कल्पना दुधाचे सदृश्य उदाहरण घेऊन विशद करता येते. दूध हे एकजिनसी मिश्रण आहे, पण ते तापविले असता त्यापासून दोन निरनिराळे परत एकजिनसीच घटक मिळतात. त्यांपैकी एक घटक सायीच्या स्वरूपात असतो, हिची घनता कमी असल्यामुळे ती दुधाच्या वरच्या पृष्ठभागावर तरंगते त्याखाली असलेला घटक परत द्रवच असतो. असाच काहीसा प्रकार He3 आणि He4 यांच्या मिश्रण द्रव्यात होऊन त्यांपैकी ज्या घटकात (५) He3 याचा अंश जास्त आहे व ज्याची घनता कमी आहे तो मिश्रकाच्या वरच्या भागावर तरंगू लागतो. याउलट ज्यामध्ये He3 चा अंश कमी आहे तो द्रव घटक मिश्रकाच्या खालच्या भागात राहतो. या शेवटच्या द्रव घटकामध्ये He3 अणूंचे He4 अणूंबरोबरील प्रमाण ३ : ७ एवढे असते. (५) या विभागातील He3 अणू पंपाच्या साहाय्याने बाष्पीभवन क्रियेच्या द्वारे द्रवातून काढून घेतले, तर (५) या द्रव घटकात जास्त He3 अणू विद्रावित (विरघळलेले) होऊ शकतात व परिणामी विरलीकरणाच्या सुप्त उष्णतेमुळे द्रवाचे शीतलन होते. यावरून हे स्पष्ट होईल की, शीतकात होणारे शीतलन He3 अणू, He3 व He4 या मिश्रणात विद्रावित झाल्यामुळे होते. यामुळे ०·०१५° के. इतके नीच तापमान मिळते. बाष्पपात्राचे कार्य मुख्यतः बाष्पीभवन वापरून शीतकाचे प्राथमिक तापमान ०·६° के. एवढे करणे हे होय. पुढील शीतलन कार्य मिश्रकात होते, विद्रावण होण्याकरिता लागणारा He3 अणूंचा पुरवठा (६–७–९) या मार्गाने केला जातो. शुद्ध He3 अणू टप्याने १° के. (कोठी १) ते ०·०१५° के. (मार्ग टप्पे ८–९) थंड करून मिश्रकाच्या (५) या विभागाला पुरवले जातात. टप्पा (८) मधील वेटोळे आ. ३ (आ) मध्ये जास्त स्पष्टपणे दाखविले आहे. टप्पा (९) याचे सविस्तर चित्रीकरण आ. ३ (इ) मध्ये दाखविले आहे. (५) या विभागाला अणूंचा सतत पुरवठा व (२) विभागाच्या वरच्या बाजूपासून वायू अणूंचे सतत उच्चाटन होत असल्यामुळे निरनिराळ्या विभागांतील द्रवांची पातळी निरनिराळी असू शकते. अशा प्रकारे हा संच आवर्तनी प्रकारे अखंडित कार्य करून मिश्रक व बाष्पपात्र यांमधील द्रवाचे तापमान ०·०१५° के. या समतोल मूल्यावर आणून ठेवतो.
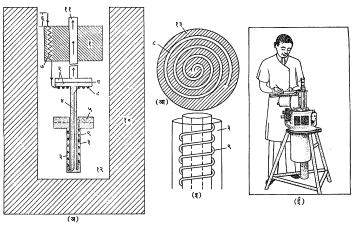
वर वर्णन केलेल्या शीतन कार्याकरिता उपयोगात येणाऱ्या तत्त्वाचा अत्यंत कल्पक रीतीने उपयोग करून हीलियम द्रव निर्माण करू शकतील असे आकारमानाने बरेच लहान प्रशीतक तयार करण्यात आले आहेत. यामध्ये कार्यक्षम बंद प्रशीतक आवर्तनाचा उपयोग केलेला असतो. अशा प्रकारचा प्रशीतक अमेरिकेत एस्. सी. कॉलिन्झ यांनी १९५० साली आणि ए. डी. लिट्ल यांनी त्याच सुमारास प्रथम बनविला. यामध्ये दोन सिलिंडरांचे एंजिन वापरलेले असते. सिलिंडरांची मांडणी अशा तऱ्हेने केलेली असते की, एका सिलिंडरामधून निघणारा निष्कासित वायू दुसऱ्या सिलिंडरामधील आगम वायूचे शीतन करतो. या संचाच्या साहाय्याने कोठी तापमानाच्या पाण्यापासून (द्रव हवा अथवा हायड्रोजन यांचा शीतनक म्हणून वापर न करता) सरळ द्रव हीलियमाच्या तापमानापर्यंत पोहचता येते. याकरिता लागणारी विद्युत् ऊर्जा काही वॉटपेक्षा जास्त नसते ही गोष्ट उल्लेखनीय आहे. या प्रशीतकाच्या आकारमानाची कल्पना आ. ३ (ई) मध्ये दाखविलेल्या रेखाचित्रावरून येईल.
नीच तापमानाचे मापन : सामान्यपणे कोणत्याही नीच तापमानाचे मापन पुष्कळ वेळा योग्य अशा दुय्यम तापमापकाच्या साहाय्यानेच करणे सोईस्कर ठरते. म्हणून प्रत्यक्ष तापमानात दोन गोष्टींचा अंतर्भाव होतो : (१) नीच तापमानाचे दुय्यम तापमापकाद्वारे मापन आणि (२) तापमापकाचे इयत्तीकरण किंवा अंशांकन. इयत्तीकरणासाठी काही विशिष्ट तापबिंदूची तापमाने एखाद्या मानक (प्रमाणभूत) साधनाने ज्ञात करून घ्यावी लागतात. या कार्याकरिता मानक साधन म्हणून स्थिर आयतन वायुतापमापक [⟶ तापमापन] वापरतात. यामध्ये वायू म्हणून हायड्रोजन किंवा हीलियम याचा उपयोग केला जातो. हा वायू ०° से. तापमानास १,००० मिमी. पाऱ्याच्या दाबाखाली भरलेला असतो. याचे अंशांकन करण्याकरिता पाण्याचा गोठणबिंदू ०° से. उकळबिंदू १००° से. आहे असे मानतात. मोजावयाच्या तापमानास या वायूचा दाब Pt एवढा असेल, तर त्याचे सेल्सिअस तापमान
| t = | Pt – Po | X | 100 |
| P100 – Po |
या सूत्राने मिळते. येथे Po व P100 अनुक्रमे पाण्याच्या गोठणबिंदूस व उकळबिंदूस असलेला पाण्याचा दाब दर्शवितात. वरील सूत्रात वायूचे वर्तन आदर्श वायूसारखेच आहे असे गृहीत धरले आहे. हे गृहीत नीच तापमानाकरिता यथार्थ असत नाही. त्यामुळे या सूत्रापासून मिळणाऱ्या तापमानाचे शुद्धीकरण करावे लागते. याकरिता वायूच्या स्थितिदर्शक समीकरणात [⟶ स्थिति समीकरण] येणाऱ्या विशिष्ट स्थिरकाचा उपयोग करावा लागतो. याशिवाय इतरही अनेक तांत्रिक कारणांकरिता मिळालेल्या तापमानाचे शुद्धीकरण करावे लागते. शुद्धीकरण केल्यानंतर आदर्श वायू तापक्रमानुसार तापमान मिळते. हे तापमान आणि ऊष्मागतिकीय तापक्रमानुसार मिळणारे तापमान (म्हणजे केल्व्हिन तापमान) यांमध्ये फरक नसतो [⟶ तापमापन].
हीलियमयुक्त वायुतापमापक ९०° के. ते ४° के. पर्यंत कोणतेही तापमान १% अचूकतेने मोजू शकतो. जेव्हा वायूचे तापमान नीच असते तेव्हा त्याचा दाब इतका कमी असतो, की तो मोजण्याकरिता पाऱ्याच्या दाबमापकाऐवजी ‘पिरानी’ अथवा ‘तप्ततंतू’ दाबमापक वापरला जातो [⟶ निर्वात]. वायुतापमापक हे अर्धनिरपेक्ष साधन आहे. त्याची कक्षा मोठी आहे व त्याची संवेदनशीलता जवळजवळ स्थिर राहते. याउलट याची औष्णिक धारणक्षमता जास्त आहे व प्रतिसादाची त्वरा कमी आहे. या कारणाकरिता वर नमूद केल्याप्रमाणे या मापकाचा उपयोग मानक म्हणूनच केला जातो. दुय्यम तापमापकाच्या इयत्तीकरणासाठी वायुतापमापकाच्या साहाय्याने पुढील शुद्ध केलेले तापबिंदू निश्चित केले गेलेले आहेत.
| °से. | °के. | } | एक वातावरण दाबाकरिता | |
| पाऱ्याचा वितळबिंदू | –३८·८७ | २३४·२९ | ||
| घन कार्बन डायऑक्साइडाचा संप्लवन बिंदू | –७८·५१ | १९४·६५ | ||
| द्रव ऑक्सिजनाचा उकळबिंदू | –१८२·९७ | १९४·६५ | ||
| द्रव हायड्रोजनाचा उकळबिंदू | –२५२·७६ | २०·४० | ||
| [संप्लवन म्हणजे द्रवामध्ये रूपांतर न होता एकदम वायूमध्ये रूपांतर होणे] | ||||
दुय्यम तापमापक : (१) धातूचा रोध तापमापक : तापमान कमी केले की, धातूचा विद्युत् रोध कमी होतो, या गुणधर्माचा उपयोग या तापमापकामध्ये केला जातो. या कार्याकरिता प्लॅटिनमाचा उपयोग केला जातो. सर्वसामान्यपणे शुद्ध अशा प्लॅटिनमाकरिता रोधकतेचे (p) दोन भाग आढळतात (एकक लांबी व एकक काटच्छेद क्षेत्रफळ असणाऱ्या पदार्थाच्या ठोकळ्याच्या विद्युत् रोधाला त्या पदार्थाची रोधकता म्हणतात).
p = p (T) + po
पहिला भाग p (T) हा तापमान कमी केले असता कमी होतो, तर दुसरा भाग po हा तापमानावर अवलंबून न राहता धातूमधील अपद्रव्याप्रमाणे बदलतो. रोध तापमापकाची कक्षा अंदाजे १५° के. पर्यंत जाऊ शकते. नीच तापमानाकरिता रोधाचे मूल्य कमी होत असल्यामुळे मापनाची अचूकता त्याच प्रमाणात कमी होते व त्याचे चलनही या तापमानाकरिता कमी असते. सोने व शिसे यांच्या तारा हायड्रोजनाच्या तापमानाकरिता उपयुक्त ठरल्या आहेत, तर फॉस्फरस, ब्राँझसारख्या मिश्रधातूच्या तारा हीलियमाची तापमाने मोजण्याकरिता उपयोगी पडतात [⟶ तापमापन].
(२) अर्धसंवाहक रोध तापमापक : धातूचे तापमान कमी केले असता त्याचा रोध कमी होतो व त्यामुळे त्याच्या साहाय्याने केलेल्या तापमापनाची संवेदनशीलता अशा तापमानाकरिता कमी होते. याउलट जर्मेनियमसारख्या अर्धसंवाहकाचा (ज्याची विद्युत् संवाहकता धातू व निरोधक यांच्या दरम्यान आहे अशा द्रव्याचा) रोध त्याचे तापमान कमी केले असता कमी होत जातो. नीच तापमानास त्याच्या रोधाचे मूल्यही मोठे असते. याउलट अर्धसंवाहकाची औष्णिक संवाहकता चांगली नसते व त्यांना चुंबकीय क्षेत्रात ठेवले असता त्यांचा विद्युत् रोध मोठ्या प्रमाणात बदलू शकतो. या गोष्टीमुळे अडचणी निर्माण होतात. त्या दूर करण्याकरिता विशिष्ट तांत्रिक योजना उपयोगात आणाव्या लागतात.
(३) कार्बन रोध तापमापक : अर्धसंवाहकता स्फटिक हे रोध तापमापक म्हणून चांगले काम देतात पण हे स्फटिक मिळविण्यास कठीण असतात. त्यामुळे रेडिओ मंडलामध्ये उपयोगात असलेल्या कार्बन रोधकांचाच 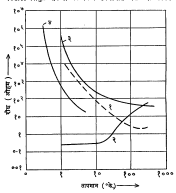
उपयोग तापमानाकरिता करण्यात आला आहे. आ. ४ मध्ये निरनिराळ्या प्रकारच्या रोधकांच्या रोधांचे तापमानाबरोबर होणारे चलन दाखविले आहे. कार्बन रोधकामधील द्रव्याला चांगली औष्णिक संवाहकता नसते. त्यामधील जूल उष्णतानिर्मितीमुळे काही नको असलेले परिणाम मिळतात. या दोन्ही गोष्टींकरिता योग्य ती काळजी घ्यावी लागते. तापमापक म्हणून वापरावयाच्या कार्बन रोधकास व मृत्तिका (सेरॅमिक) आवेष्टन दिले जाते.
(४) तपयुग्म तापमापक : नीच तापमाने मोजण्याकरिता निरनिराळ्या धातूंची तपयुग्मे (दोन भिन्न धातूंच्या तारांची टोके एकत्र करून एका तापमानाला व उरलेली टोके एकत्र करून सापेक्षतः कमी तापमानाला ठेवल्यास तयार होणाऱ्या साधनाला तपयुग्म म्हणतात) वापरली जातात. उदा., तांबे कॉन्स्टन्टन तपयुग्म सु. १५° के. पर्यंतच्या तापमानाचे मापन करण्याकरिता वापरले जाते. २·५° के. पर्यंतची तापमाने मोजण्यास उत्तम ठरलेले तपयुग्म २२·१% कोबाल्टमिश्रित सोने व तांबे यांपासून बनविलेले असते [⟶ तापमापन].
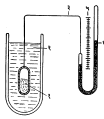
(५) बाष्पदाब तापमापक : या प्रकारच्या तापमापकाची रचना आ. ५ मध्ये दाखविली आहे. (१) या भांड्यात योग्य असा द्रव भरलेला असतो. या द्रवाच्या वर सुरुवातीस निर्वात असल्यामुळे त्याचे बाष्पीभवन होऊन द्रव व बाष्प यांमध्ये समतोल निर्माण होतो. ज्या क्षेत्राचे तापमान काढावयाचे आहे अशा क्षेत्रात हे द्रवयुक्त भांडे ठेवले असता त्या तापमानानुसार त्यावरील बाष्प एक ठराविक दाबमूल्य धारण करते. हा दाब त्याला जोडलेल्या दाबमापकाच्या साहाय्याने मोजला जातो. उपयोगात आणलेल्या द्रवाकरिता निरनिराळ्या तापमानांकरिता अपेक्षित दाब माहीत असल्यास मोजलेल्या दाबावरून तापमान मोजता येते. नीच तापमानाच्या निरनिराळ्या टप्प्यांनुसार खाली दर्शविल्याप्रमाणे योग्य असे द्रव वापरावे लागतात.
१३२° ते १६३° के. करिता एथिलीन (C2H4)
१२२° ते १०३° के. करिता मिथेन (CH4)
९०° ते ६८° के. करिता ऑक्सिजन द्रव
५·२° ते १° के. करिता He4 द्रव.
(६) चुंबकीय तापमापक : १° के. पेक्षा कमी तापमानाच्या मापनाकरिता चुंबकीय तापमापन पद्धतीच उपलब्ध आहे. या मापकामध्ये समचुंबकीय असे लवण द्रव्य वापरलेले असते आणि हे द्रव्य ज्या क्षेत्राचे तापमान मोजावयाचे आहे त्यामध्ये ठेवले जाते. या परिस्थितीत द्रव्याच्या चुंबकीय प्रवणतेचे [⟶ चुंबकत्व] मापन करण्याकरिता लागणारी उपकरण योजना उपलब्ध आहे. जर समचुंबकीय रेणूंना आदर्श वायूचे नियम यथार्थ आहेत असे मानले, तर त्याची रेणवीय चुंबकीय प्रवणता (χ) पुढील सूत्राने मिळते.
| χ = | C |
| T |
यामध्ये C क्यूरी स्थिरांक व T निरपेक्ष तापमान. वरील नियम पी. क्यूरी यांनी प्रायोगिक रीत्या सिद्ध केला व त्याचे सैद्धांतिक समर्थन पी. लांझव्हँ यांनी केले. वरील नियम जर निरपेक्ष शून्य तापमानापर्यंत यथार्थ ठरला असता, तर या रीतीने तापमापन सर्वांत सोपे ठरले असते पण नीच तापमानाकरिता समचुंबकीय पदार्थाचे वर्तन या नियमापासून विचलित होते, असे प्रयोगाद्वारे आढळून आले आहे. त्यामुळे या तापमापकाचे अंशांकन He4 बाष्पदाब तापमापकाद्वारे करावे लागते.
आ. ६ मध्ये नीच तापमान मोजण्याकरिता वापरण्यात येणाऱ्या विविध पद्धतींच्या तापमापकांच्या कार्यक्षेत्र सीमा दाखविल्या आहेत.
नीच तापमानास आढळणारे आविष्कार : सर्वसामान्यपणे १०° के. या तापमानापेक्षा कमी तापमान असलेल्या अनेक पदार्थांची वर्तणूक आश्चर्यकारक अशी आढळते. या वर्तणूकीचे विशदीकरण रूढ भौतिकीच्या सिद्धांताप्रमाणे करणे शक्य होत नाही व याकरिता पुंज (क्वांटम) सिद्धांताचा उपयोग करावा लागतो. द्रव हीलियम ॥ (λ बिंदूच्या म्हणजे २·१९° के. तापमानाच्या खालील द्रव हीलियमाला हीलियम ॥ म्हणतात) याबाबतीत विशेष चमत्कारिकपणा दाखवितो, म्हणून त्यास ‘पुंज द्रव’ अशी संज्ञा दिली आहे.
चमत्कारिक आविष्कारांमध्ये अतिसंवाहकता व द्रव हीलियमाची अतिप्रवाहिता हे विशेष महत्त्वाचे आहेत.
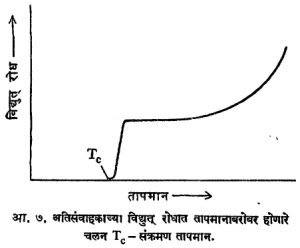
अतिसंवाहकता : कोठल्याही धातूचा विद्युत् रोध तिचे तापमान कमी केले असता कमी होतो, याचा उल्लेख आधी आलेलाच आहे. बऱ्याच धातूंकरिता त्यांचे तापमान १०° ते १° के. या मर्यादेत कमी केले असता त्यांचा रोध संथपणे कमी होत जातो असे आढळते. याउलट पाऱ्याकरिता एका ठराविक संक्रमण तापमानास (४·२° के.) त्याचा रोध आ. ७ मध्ये दाखविल्याप्रमाणे वेगात कमी होऊन शून्य मूल्य धारण करतो. कोठी तापमानाच्या तांब्याच्या रोधकतेशी तुलना केल्यास अतिसंवाहक अवस्थेत पाऱ्याच्या रोधकतेत १०१७ या पटीने घट होते. हा आविष्कार आतापर्यंत सु. २५ मूलद्रव्ये, अगणित मिश्रधातू व संयुगे यांच्या बाबतीत आढळला आहे. प्रत्येक पदार्थाकरिता संक्रमण तापमानाचे मूल्य भिन्न असते. सगळ्यांत जास्त मूल्य (१८° के.) हे निओबियम–कथिल (Nb3Sn) या मिश्रधातूकरिता मिळाले आहे.
काही परिस्थितीत अतिसंवाहकाचा पोकळ गोलक बाहेर लावलेल्या चुंबकीय क्षेत्रामुळे त्यामध्ये असलेल्या
चुंबकीय स्त्रोतास संपूर्णपणे बाहेर घालवून देतो. या आविष्काराचे स्वरूप आ. ८ वरून स्पष्ट होईल. आ. ८ (अ) 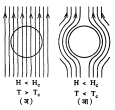 मध्ये गोलकाचे तापमान संक्रमण तापमानापेक्षा (Tc) जास्त आहे व त्यावर लावलेल्या चुंबकीय क्षेत्राचे मूल्य संक्रमण क्षेत्र मूल्य Hc पेक्षा कमी आहे असे गृहीत धरले आहे. या परिस्थितीत गोलकाचे तापमान कमी करून त्यास अतिसंवाहक बनविले, तर आ. ८ (आ) मध्ये दाखविल्याप्रमाणे गोलकाच्या आतील सर्व चुंबकीय स्रोत बाहेर काढला जातो असे आढळते. जेव्हा H > Hc असेल तेव्हा पदार्थाची अतिसंवाहकता नष्ट होते (माईसनर परिणाम). या आविष्काराचा उपयोग चुंबकीय क्षेत्रापासून परिरक्षक योजना करण्याकरिता होतो [⟶ अतिसंवाहकता].
मध्ये गोलकाचे तापमान संक्रमण तापमानापेक्षा (Tc) जास्त आहे व त्यावर लावलेल्या चुंबकीय क्षेत्राचे मूल्य संक्रमण क्षेत्र मूल्य Hc पेक्षा कमी आहे असे गृहीत धरले आहे. या परिस्थितीत गोलकाचे तापमान कमी करून त्यास अतिसंवाहक बनविले, तर आ. ८ (आ) मध्ये दाखविल्याप्रमाणे गोलकाच्या आतील सर्व चुंबकीय स्रोत बाहेर काढला जातो असे आढळते. जेव्हा H > Hc असेल तेव्हा पदार्थाची अतिसंवाहकता नष्ट होते (माईसनर परिणाम). या आविष्काराचा उपयोग चुंबकीय क्षेत्रापासून परिरक्षक योजना करण्याकरिता होतो [⟶ अतिसंवाहकता].
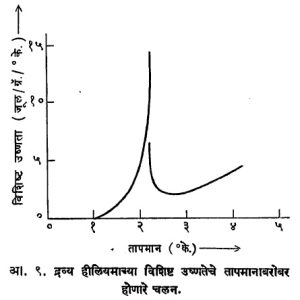
अतिप्रवाहिता : ज्या दिवशी कामर्लिंग-ऑनेस यांनी हीलियम वायूचे द्रवीकरण केले त्याच दिवशी त्याचे मुक्त बाष्पीभवन व त्यामुळे होणारे शीतलन यांच्या साहाय्याने हीलियमाची घनावस्था मिळविण्याचा त्यांनी प्रयत्न केला, पण तो सफल झाला नाही. आता सर्वांस माहीत झाले आहे की, जवळजवळ निरपेक्ष शून्यापर्यंत द्रव हीलियमाचे नुसते शीतलन केले, तरी तो द्रवरूपातच राहतो. त्यावरील दाब वाढवून शीतलन केले, तरच त्याची घनावस्था मिळते. हीलियमाच्या द्रवाचे शीतलन करून तो घनरूप करण्याच्या प्रयत्नात असे आढळते की, या द्रवामध्ये २·१९° के. या तापमानास द्रवाच्या अनेक गुणधर्मांमध्ये एक आकस्मित असा बदल होतो. या तापमानास द्रवाच्या विशिष्ट उष्णतेत (१ ग्रॅम द्रवाचे तापमान १° के. वाढविण्यासाठी त्याला द्याव्या लागणाऱ्या उष्णतेत) कशी वाढ होते हे आ. ९ वरून दिसून येईल. या आकृतीतील वक्रांच्या विशिष्ट आकारावरून या संक्रमण तापमानास λ बिंदू असे म्हटले जाते. या बिंदूपर्यंत तापमान कमी होत असताना घटणारे द्रवाचे आयतन, या बिंदूच्या खाली तापमान गेल्यास वाढू लागते. द्रवाच्या श्यानतेत (दाटपणात) होणारा फरक आ. १० मध्ये दाखविला आहे. त्यावरून λ बिंदूखाली द्रवाच्या श्यानतेत एकदम कशी घट होते हे दिसते.
या व इतर प्रयोगांचे परिशीलन करून असे मानावे लागते की, λ बिंदूखाली मिळणारा द्रव हा He । व He ॥ या दोन निरनिराळ्या गुणधर्मांच्या द्रवांचे मिश्रण आहे. λ बिंदूपेक्षा अधिक तापमानाकरिता फक्त He । हाच द्रव असतो. λ बिंदू (२·१९° के.) ते सु. १° के. तापमानाकरिता हीलियम द्रवात हे दोन्हीही प्रकार कमीअधिक प्रमाणात असतात.१° के. तापमानाखाली द्रव संपूर्णपणे He ॥ या स्वरूपाचा असतो. He Ι बऱ्याच अंशी इतर 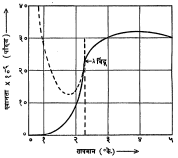
सामान्य द्रवांप्रमाणे वागतो, पण He ॥ चे गुणधर्म इतर कोणत्याही द्रवांपेक्षा निराळे आहेत. त्याची औष्णिक संवाहकता प्रचंड असून त्याची एंट्रॉपी शून्य असल्यामुळे त्याची उष्णता शोषून घेण्याची क्षमता अतिशय मोठी आहे. यामुळे या द्रवाचे तापमानसुद्धा निरपेक्ष शून्याएवढे असे मानता येते. त्याची श्यानता जवळजवळ शून्यवत आहे त्यामुळे बारीक केशनलिकेतून होणारा त्याचा प्रवाह जवळजवळ रोधशून्य असतो. λ बिंदूखाली द्रव हीलियमामध्ये असणाऱ्या या घटकामुळे खालील आविष्कार आढळतात.
(१) हीलियम द्रवाचा पटल प्रवाह : एखादा रिकामा काचेचा पेला λ बिंदूपेक्षा कमी तापमानाच्या हीलियम द्रवात अर्धवट बुडविला, तर पेल्यात हीलियम द्रव पटलरूपात शिरताना दिसतो. पेल्याच्या आतील व बाहेरील द्रवाची पातळी सारखी होईतोपर्यंत हा विसर्पण प्रवाह चालू राहतो. हा पेला जर द्रवाच्या पूर्णतः बाहेर उचलला, तर त्यातील द्रव पटलरूपाने हळूहळू बाहेर पडून पेला रिकामा होतो व पेल्याच्या बाहेरच्या तळभागावर हीलियम द्रवाचे थेंब तयार होऊन ठिपकू लागतात.
(२)कारंजे परिणाम : λ बिंदूखालील तापमानाच्या हीलियम द्रवाच्या कोणत्याही एका स्थानी उष्णता दिली असता तिचा स्वीकार करावयास He ॥ हा अतिप्रवाही द्रव तेथे धावत येतो. कारण त्याची श्यानता व एंट्रॉपीही शून्यवत असते. या उष्णतेचे शोषण करून He ॥ या द्रवाचे He । मध्ये रूपांतर होते. या आविष्कारावर आधारलेले कारंजे आ. ११ मध्ये दाखविले आहे. एमरी पूड ज्या नलिकेत ठेवली आहे तीमध्ये He ॥ हाच घटक सहजपणे प्रवेश करू शकतो. तीमध्ये एका ठिकाणी उष्णता पुरविली असल्यामुळे तेथे He ॥ द्रव येऊन उष्णतेचे शोषण करून आपले He । मध्ये रूपांतर करून घेतो. He ॥ नलिकेत इतक्या वेगाने येतो की, त्यामुळे नलिकेमधून ३० सेंमी. उंचीचे या द्रवाचे कारंजे उडताना दिसते. याउलट He । द्रवाची श्यानता खूप असल्यामुळे निर्माण झालेला He । द्रव एमरी पूड ज्यामध्ये आहे त्या नलिकेच्या द्वारे परत भांड्यात सहजपणे जाऊ शकत नाही.
(३)द्वितीय ध्वनी : λ बिंदूखालच्या तापमानाच्या हीलियम द्रवाच्या स्तंभाच्या एका टोकाशी उष्णता पुरविली, तर त्यापासून लागलीच एका उष्णतेचा स्पंद दुसऱ्या टोकाकडे प्रगत होताना आढळतो. त्याच द्रवातून ज्या वेगाने सामान्य ध्वनी (अनुतरंग स्वरूपात म्हणजे ज्यात माध्यमाच्या कणांची हालचाल तरंगाच्या पुढे जाण्याच्या दिशेप्रमाणेच असते अशा तरंगाच्या स्वरूपात) प्रगत होईल त्याच्यापेक्षा या स्पंदाचा वेग सु. १० पटींनी कमी असतो. ध्वनि-उद्गमामुळे संकोचन विरलीकरण याची आवर्तने द्रव माध्यमात निर्माण केली जातात त्यामुळे द्रवाची घनता स्थानानुसार बदलते व हा बदल तरंगाच्या स्वरूपात प्रेषित केला जातो. असे हे ध्वनि-तरंग प्रसरणाकरिता विशदीकरण देण्यात येते. हीलियम द्रवामधील होणारी क्रिया यापेक्षा सर्वस्वी निराळी असते. स्तंभात He । व He ॥ या दोन तऱ्हेच्या द्रव अणूंचे एक ठराविक प्रमाणात सर्वत्र सारखे वितरण आहे. He । व He ॥ यांमध्ये परस्परक्रिया होत नाही पण एकाचे दुसऱ्या स्वरूपात रूपांतर होऊ शकते. He ॥ जवळ शून्यवत एंट्रॉपी आहे म्हणजे त्याचे तापमान He । पेक्षा कमी आहे. त्याची उष्णताग्रहण करण्याची क्षमता चांगली आहे. त्यामुळे तो उष्णता शोषून He । या स्वरूपात येऊ शकतो. त्याची श्यानता शून्यवत असल्यामुळे तो स्तंभामध्ये कोठेही अगदी सहज रीतीने संचार करू शकतो. या सर्व गोष्टी लक्षात घेतल्या, तर द्वितीय ध्वनीचे प्रेषण कसे होते याचे विशदीकरण करता येते. स्तंभाच्या ज्या टोकाशी उष्णता दिलेली असते त्या स्थानी असलेले He ॥ अणू ती लागलीच शोषून घेऊन आपले रूपांतर He । मध्ये करतात. या भागातील He ॥ ची सांद्रता कमी झाल्यामुळे शेजारील भागातील He ॥ अणू ही कमतरता भरून काढण्याकरिता येतात. या अणूकरिता श्यानता कमी असल्यामुळे ही हालचाल अतिशय त्वरेने होते. ज्या विभागातून हे अणू येतात तेथील He ॥ अणूंची सांद्रता त्यामुळे कमी होते. या अणूंचे तापमान कमी असल्यामुळे ज्या विभागातून ते येतात त्या स्थानविभागाचे परिणामी तापमान (तात्पुरते) वाढते, असे म्हणता येईल. अशा प्रकारे जास्त तापमानाचा एक विभाग हा स्तंभाच्या ज्या टोकाशी प्रथम उष्णता दिली होती त्यापासून दूर असा प्रगत होत जातो. त्यामध्ये He ॥ च्या सांद्रतेचे प्रसारण केले जाते. He ॥ चे He । मध्ये केवळ रूपांतर होत असल्यामुळे एकंदर (He । + He ॥) अणूंच्या संख्येत काही फरक होत नाही. मात्र यामध्ये तापमान अथवा एंट्रॉपी या राशीचे प्रसारण होते. ध्वनीमध्ये दाबाचे (किंवा घनतेचे) प्रसारण होते, हा या दोन आविष्कारांत मोठा फरक आहे. यावरून यास नवीन प्रकारचा तरंग आविष्कार का म्हणतात याचे कारण लक्षात येईल.
शीत अभियांत्रिकी : (क्रायोजेनिक्स). हायड्रोजन, हीलियम इ. द्रवरूप वायूंची मोठ्या प्रमाणावर निर्मिती करण्याची तंत्रे [⟶ वायूंचे द्रवीकरण] कार्यक्षम झाली तशी या द्रव वायूंचा विविध क्षेत्रांत मोठ्या प्रमाणात उपयोग होऊ लागला. द्रव वायूंचे संचय करण्याच्या पद्धतीमध्ये सुधारणा झाल्यामुळे त्यांचा जास्त काळपर्यंत संचय करणे किंवा त्यांची एका ठिकाणाहून दुसऱ्या ठिकाणी वाहतूक करणे शक्य झाले. सुरुवातीस द्रवरूप वायूंचा संचय करण्याकरिता देवार निर्वात पात्राचाच उपयोग केला जात होता. या पात्रामध्ये उच्च प्रतीच्या परावर्तक धातवीय पटलांच्या योगे केलेल्या दोन भित्तींमध्ये निरोधक म्हणून उच्च निर्वात वापरलेला असतो. या भित्ती काचेच्या असल्यामुळे त्या तितक्याशा बळकट नाहीत. याकरिता निरोधक म्हणून स्पंजित (स्पंजासारख्या सच्छिद्र) प्लॅस्टिकाचा (उदा. पॉलिस्टायरीन) उपयोग करण्यात आला आहे. या पात्राची बळकटी जास्त असल्यामुळे ते परिवहनास जास्त सोयीस्कर असले, तरी त्याची निरोधन कार्यक्षमता निर्वात पात्राच्या अंदाजे १/६ एवढीच असते असे आढळते. देवार पात्रात उष्णतेचे क्षरण बहुतांशी प्रारणाच्या (तरंगरूपी ऊर्जेच्या) स्वरूपात होते. त्यामुळे उच्च निर्वातामध्ये पिअरलाइटासारख्या उष्णता निरोधक पदार्थाचे बारीक चूर्ण ठेवले, तर पात्राची कार्यक्षमता ६–७ पटींनी वाढते असे दिसले. याच कार्याकरिता आलटून पालटून ॲल्युमिनियम (परावर्तक) व काचतंतू (उष्णता निरोधक) यांचे पातळ थर एकमेकांवर ठेवून बनलेल्या साधानाचा (सुपर इन्शुलेशनचा) सुद्धा निर्वातात चूर्णाच्या ऐवजी उपयोग करतात. आ. १२ मध्ये निर्वात चूर्ण-निरोधित टाकी दाखविली आहे. हिच्याद्वारे हायड्रोजन द्रवाचे सुद्धा परिवहन करता येते.
ही टाकी ट्रक किंवा रेल्वे अनुवाहनांवरून नेण्यास योग्य आहे.
द्रव वायूचा रासायनिक, अणुकेंद्रीय अभियांत्रिकीतील व सैनिकी उपयोग : रासायनिक व इतर उद्योगधंद्यांत ऑक्सिजन, नायट्रोजन (आर्गॉन) यांसारखे निरनिराळे वायू वापरावे लागतात आणि हे वायू बहुधा वायुमिश्रणातून वेगळे करून मिळवावे लागतात. उदा., हवेमध्ये आयतनानुसार ७८ % नायट्रोजन आणि २१ % ऑक्सिजन असल्यामुळे हे दोन्ही वायू हवेचे द्रवीकरण करून मिळालेल्या द्रवाचे आंशिक ऊर्ध्वपातन (उकळबिंदूतील फरक लक्षात घेऊन बाष्प थंड करून घटक अलग करण्याची क्रिया) करून ते वेगळे करता येतात. विवेचक अधिशोषण तंत्र (घन अगर द्रव पदार्थाच्या पृष्ठभागावर आकृष्ट करून घेऊन द्रवातील घटक वेगळे करण्याचे तंत्र) वापरून हवेमध्ये असलेले आर्गॉन, हीलियम इ. अक्रिय (इतर पदार्थाशी सहजासहजी रासायनिक विक्रिया न होणारे) घटक वायू वेगळे करून शुद्ध करता येतात. हीलियमाचे हवेतील प्रमाण कमी असते. त्यामुळे हीलियमाचा पुरवठा जास्त करून काही वायुकूपांतून येणाऱ्या मिश्रवायूचे शुद्धीकरण करून मिळतो. नैसर्गिक रीत्या मिळणाऱ्या अशा वायूमध्ये हीलियमाचे प्रमाण १ ते ८% असते व १२–८०% नायट्रोजन आणि उरलेला घटक मिथेन हा असतो.
रासायनिक उद्योगामध्ये ऑक्सिजनाचा उपयोग ऑक्सिडीकरण [⟶ ऑक्सिडीभवन] विक्रिया वापरून अमोनिया, तसेच मिथेनॉल यांसारखी रसायने तयार करण्याकरिता होतो. शीतलन करून मिळविल्या जाणाऱ्या द्रव वायूंच्या उत्पादन प्रमाणाची कल्पना खालील उदाहरणावरून येईल. १९७२ साली फक्त अमेरिकेत द्रव ऑक्सिजनाचे उत्पादन अंदाजे २ X १०९ लिटर एवढे होते. हवेतून मिळणारा द्रव नायट्रोजन वायू वापरून प्रथम अमोनिया व नंतर त्यापासून शेतीस लागणारी खते बनविली जातात. कृत्रिम अमोनिया करण्याकरिता कोकभट्टी वायूचे पृथक्करण शीतलन प्रक्रिया वापरूनच करतात. औष्णिक अणुकेंद्रीय विक्रियेकरिता लागणारा ड्युटेरियम द्रव हायड्रोजनाचे आंशिक ऊर्ध्वपातन करून मिळविला जातो.
लांब पल्ल्याच्या व खूप उंचीवर उडणाऱ्या विमानातील वैमानिकांना ऑक्सिजनाचा पुरवठा करावा लागतो. तो पूर्वी जड पोलादी सिलिंडरामधून मोठ्या दाबाखाली भरलेल्या वायूद्वारे केला जात असे. १९४० सालापासून याऐवजी द्रव ऑक्सिजन हलक्या उष्णतानिरोधित पात्रात ठेवून जरूरीप्रमाणे त्याच्या बाष्पाचा पुरवठा केला जातो. या पद्धतीमुळे वजनात ६५% घट, तर आयतनात ८५% घट होते. अशा ऑक्सिजनाचा पुरवठा करता यावा म्हणून विमानतळावरच सुवाह्य अशी द्रव ऑक्सिजननिर्मिती केंद्रे बसविण्यात आलेली आहेत.
अवकाशीय उपयोग : जर्मनीने १९४४ मध्ये वापरलेल्या व्ही–२ रॉकेटाकरिता ऑक्सिडीकारक म्हणून द्रव ऑक्सिजन, तर इंधन म्हणून अल्कोहॉल वापरले होते. त्यानंतर रॉकेटांचा जो विकास झाला आहे त्यांपैकी बऱ्याच रॉकेट प्रकारांत द्रव ऑक्सिजन व द्रव फ्ल्युओरीन यांचा ऑक्सिडीकारक म्हणून, तर केरोसीन, मिथेन, हायड्रॅझीन इत्यादींचा इंधन म्हणून उपयोग केला गेला आहे. रॉकेटाला प्राप्त होणारा आवेग निष्कासित (बाहेर टाकण्यात येणाऱ्या) वायूच्या रेणुभाराच्या वर्गमूळाच्या व्यस्त प्रमाणात असल्याने, लहान रेणुभार असलेला द्रव हायड्रोजन इंधन असलेले रॉकेट विशेष कार्यक्षम ठरेल असा अंदाज आहे.
अणुकेंद्रीय रॉकेटाकरिता सुद्धा द्रवरूप हायड्रोजनाचा उपयोग केला जाणार आहे. अशी रॉकेटे प्रत्यक्षात साध्य होऊ शकतील, असे प्रयोगांती आढळून आले आहे.
खाद्यपदार्थांचे परिरक्षण : या कार्याकरिता द्रव नायट्रोजन मोठ्या प्रमाणात वापरला जातो. द्रव नायट्रोजनामध्ये बुडवून किंवा द्रव नायट्रोजनाचा फवारा त्यावर सोडून किंवा द्रव नायट्रोजनाने शीत केलेल्या बाष्पाच्या साहाय्याने खाद्यपदार्थ थंड केले जातात. अशा प्रकारे थंड केलेले टोमॅटो किंवा केळी बराच काळ चांगली टिकतात व त्यांच्या चवीवर या शीतलनाचा काही परिणाम होत नाही. इतर पदार्थांच्या बाबतीत सुद्धा थोड्या फार फरकाने हाच अनुभव मिळतो. अशा तऱ्हेने थंड केलेले खाद्यपदार्थ वाहतूकीच्या दृष्टीने सोयीस्कर ठरतात.
शीतलनाचे जैव परिणाम : प्रयोगाने असे आढळून येते की, मनुष्य हा सामान्य तापमानापेक्षा विशेष अधिक तापमान (म्हणजे अंदाजे ५०°–११०° से.) सहन करू शकत नाही पण त्याला सुसह्य असणाऱ्या नीच तापमानास मर्यादा आहे, असे दिसत नाही. जैव क्रियाशीलता नीच तापमानास पुष्कळ प्रमाणात कमी होते. म्हणून पुरेसे नीच तापमान वापरून जैव विक्रिया निरनिराळ्या अवस्थांत तात्पुरत्या स्थगित करून त्यांचा अभ्यास करता येतो. या प्रकारे अर्बुद वाढीवर (पेशींच्या अत्यधिक वाढीमुळे निर्माण होणाऱ्या व शरीरक्रियेला निरुपयोगी असणाऱ्या गाठीच्या वाढीवर) संशोधन केले जाते. याच गुणधर्माचा उपयोग करून अशा पदार्थाचे परिरक्षण करता येते. प्रतिरोपण करण्याकरिता (शरीराचा निरुपयोगी झालेला भाग काढून त्या ठिकाणी दुसरा भाग बसविण्याकरिता) आवश्यक असे सस्तन प्राण्याचे ऊतक (समान रचना व कार्य असलेल्या पेशींचा समूह) मानवी डोळ्यामधील स्वच्छमंडल (बुबुळाचा पुढचा पारदर्शक भाग) किंवा रक्ताधानासाठी (शरीरातील रक्तप्रवाहात बाहेरील रक्त घालण्यासाठी) लागणारे मानवी रक्त या सर्वांचे शीतलन करून परिरक्षण करता येते. पशूंच्या (विशेषतः बैलाच्या) वीर्याचे शीतलन करून ते परिरक्षित केले जाते व त्याचा अनेक गायींचे कृत्रिम रीत्या वीर्यसेचन करण्याकडे उपयोग केला जातो. यामुळे अनेक बैल पोसावयाचा खर्च तर वाचतोच, पण परिणामी वेचक प्रजनन करून जनावरांच्या जातींमध्ये सुधारणा करता येते. शीतलन करण्याकरिता द्रव नायट्रोजन वापरण्यास १९५२ मध्ये सुरुवात झाली. चामखिळीसारख्या चर्मविकाराचे निर्मूलन करण्याकरिता द्रव नायट्रोजनाशी १०–६० सेकंद पर्यंत केलेला संस्पर्श उपयोगी ठरतो.
शस्त्रक्रियेकरिता शीतलनाचा वापर : माणसाच्या शरीराचे तापमान कृत्रिम रीत्या शीतलन करून २९३°–३०३° के. इतके केले, तर त्याला लागणारा ऑक्सिजन ५०% कमी होतो. अशा परिस्थितीत त्याचे हृदय ८ मिनिटांपर्यंत बंद राहिले, तरी त्यास काही कायम स्वरूपाची इजा होत नाही. हृदयावरच्या शस्त्रक्रिया करण्याकरिता ही परिस्थिती उपयोगी पडते. शीतलनामुळे वेदना कमी होतात व त्याचे इतर काही वाईट परिणामही होत नाहीत.
मोतीबिंदूच्या विकारामध्ये डोळ्यातील भिंगामध्ये विकृती होते व दृष्टी परत येण्याकरिता शस्त्रक्रिया करून हे भिंग काढून घ्यावे लागते. स्वच्छमंडलाला छेद पाडून त्यातून एक थंड केलेली एषणी (पातळ, लवचिक, सळईसारखे उपकरण) आत सारली, तर हे भिंग गोठून तिला चिकटते. यानंतर एषणी बाहेर काढली असता तिच्याबरोबर हे भिंग सहजपणे बाहेर येते.
पार्किनसन विकार (जेम्स पार्किनसन या इंग्रज शरीरक्रियावैज्ञानिकांच्या नावावरून ओळखण्यात येणारा विकार) घालविण्याकरिता मेंदूवर शस्त्रक्रिया करावी लागते. हा विकार झालेल्या रोग्याच्या हातापायांची बोटे सारखी कापत असतात. या शस्त्रक्रियेत २६३° के. पर्यंत थंड केलेली बारीक एषणी रोग्याच्या कवटीला छिद्र पाडून आत सरकविली जाते. आधी निदान करून साधारणपणे निश्चित केलेल्या मेंदूच्या भागापाशी तिचा संस्पर्श होताच रोग्याच्या हातापायांचा कंप थांबतो. अशा तऱ्हेने रोगाचे स्थान निश्चित केल्यानंतर त्या ठिकाणी २३३° के. पर्यंत एषणी थंड करून २-३ मिनिटे ठेवतात. यामुळे त्या जागेतील ऊतक मृत होते व अशा रीतीने रोगाचे मूळ नाहीसे केले जाते.
भौतिकी संशोधनातील उपयोग : (अ) बुद्बुद् कोठी : वेगवान कणांकरिता अभिज्ञातक (अस्तित्व ओळखण्याचे साधन) म्हणून ही प्रयुक्ति वापरली जाते. हीमध्ये द्रव हायड्रोजन, हीलियम इ. द्रव वायूंचा उपयोग अनेक वेळा केला जातो [→ कण अभिज्ञातक].
(आ) विद्युत् गोंगाट : इलेक्ट्रॉनीय मंडलामध्ये विद्युत् गोंगाटामुळे विक्षोभ निर्माण होतो. गोंगाटाचे प्रमाण तापमानावर अवलंबून असल्यामुळे मंडल परिसराचे तापमान कमी करून गोंगाट १०० पटींनी कमी करता येतो. या तापमानास या मंडलाच्या कार्यक्षमतेत खूप वाढ होते.
(इ) धनावस्थी स्विच : चुंबकीय क्षेत्राद्वारे अतिसंवाहकतेचा नाश होणे या आविष्कारावर आधारित असा धनावस्थी क्रायोट्रॉन नावाचा स्विच शोधून काढण्यात आला आहे. याला जागा व आदान विद्युत् कार्य शक्ती कमी लागते. तसेच याचे कार्य अधिक विश्वसनीय असते.
 (ई) चुंबकीय क्षेत्र निर्मिती : सामान्य विद्युत् चुंबकात मध्यभागी एक मृदू लोखंडाचा गाभा असून त्याभोवती परिनलिकेच्या आकाराचे (दंडगोलाकार) वेटोळे असते. या वेटोळ्यामधून विद्युत् प्रवाह पाठविला असता वेटोळ्याच्या अक्षाला समांतर असे चुंबकीय क्षेत्र मिळते. चुंबकीय क्षेत्राचे परिमाण वाढविण्याकरिता वेटोळ्यातील विद्युत् प्रवाहाचे मूल्य वाढविले जाते. लोखंडाच्या गाभ्याचे चुंबकीकरण काही ठराविक मर्यादेनंतर संपृक्त (ज्यापेक्षा जास्त चुंबकीकरण होऊ शकत नाही अशी अवस्था) होत असल्यामुळे ३०,००० ओर्स्टेडपेक्षा जास्त क्षेत्र हवे असल्यास असा गाभा वापरण्यापासून काही फायदा होत नाही. याकरिता वेटोळ्यामधून इतका मोठा विद्युत् प्रवाह पाठवावा लागतो की, एक तर त्याकरिता योग्य विद्युत् उद्गम मिळणे कठीण असते आणि दुसरे म्हणजे या विद्युत् प्रवाहामुळे वेटोळ्याचे तापमान वाढून त्याचा रोध वाढतो व त्यामुळे त्यामधील विद्युत् प्रवाहाचे मूल्य आपोआप कमी होते. याकरिता शीतकांच्या साहाय्याने वेटोळ्याचे तापमान २०° के. इतके कमी करावे असे सुचविण्यात आले आहे. या तापमानाकरिता वेटोळ्याचा रोध खूप कमी असतो. त्यामुळे उपलब्ध विद्युत् उद्गमाच्या साहाय्याने जास्त मूल्याचा विद्युत् प्रवाह आणि त्यामुळे जास्त मूल्याचे चुंबकीय क्षेत्र मिळविता येते.
(ई) चुंबकीय क्षेत्र निर्मिती : सामान्य विद्युत् चुंबकात मध्यभागी एक मृदू लोखंडाचा गाभा असून त्याभोवती परिनलिकेच्या आकाराचे (दंडगोलाकार) वेटोळे असते. या वेटोळ्यामधून विद्युत् प्रवाह पाठविला असता वेटोळ्याच्या अक्षाला समांतर असे चुंबकीय क्षेत्र मिळते. चुंबकीय क्षेत्राचे परिमाण वाढविण्याकरिता वेटोळ्यातील विद्युत् प्रवाहाचे मूल्य वाढविले जाते. लोखंडाच्या गाभ्याचे चुंबकीकरण काही ठराविक मर्यादेनंतर संपृक्त (ज्यापेक्षा जास्त चुंबकीकरण होऊ शकत नाही अशी अवस्था) होत असल्यामुळे ३०,००० ओर्स्टेडपेक्षा जास्त क्षेत्र हवे असल्यास असा गाभा वापरण्यापासून काही फायदा होत नाही. याकरिता वेटोळ्यामधून इतका मोठा विद्युत् प्रवाह पाठवावा लागतो की, एक तर त्याकरिता योग्य विद्युत् उद्गम मिळणे कठीण असते आणि दुसरे म्हणजे या विद्युत् प्रवाहामुळे वेटोळ्याचे तापमान वाढून त्याचा रोध वाढतो व त्यामुळे त्यामधील विद्युत् प्रवाहाचे मूल्य आपोआप कमी होते. याकरिता शीतकांच्या साहाय्याने वेटोळ्याचे तापमान २०° के. इतके कमी करावे असे सुचविण्यात आले आहे. या तापमानाकरिता वेटोळ्याचा रोध खूप कमी असतो. त्यामुळे उपलब्ध विद्युत् उद्गमाच्या साहाय्याने जास्त मूल्याचा विद्युत् प्रवाह आणि त्यामुळे जास्त मूल्याचे चुंबकीय क्षेत्र मिळविता येते.
जे. ई. कुन्झ्लर आदी शास्त्रज्ञांनी १९६१ मध्ये असे दाखविले की, निओबियम आणि कथिल यांच्या मिश्रधातूची तार बनविली, तर ती १८° के. तापमानाच्या खालील मूल्याकरिता अतिसंवाहकता दाखविते. या तारेचे वेटोळे बनवून त्यास १·८° के. तापमानास थंड करून त्यावर विद्युत् चालक प्रेरणा (मंडलात विद्युत् प्रवाह वाहण्यास कारणीभूत असणारी प्रेरणा) लावली असता वेटोळ्याचा रोध शून्यवत असल्यामुळे त्यापासून प्रचंड मूल्याचा विद्युत् प्रवाह मिळतो. हा अभिसारी विद्युत् प्रवाह एकदा सुरू झाला की, वेटोळ्याचा उद्गमाबरोबरच संबंध जोडला, तरी या विद्युत् प्रवाहाकरिता मंडल पूर्ण राहील. हा प्रवाह अशा रीतीने वाहत राहील अशी व्यवस्था केली, तर अखंडित विद्युत् ऊर्जा पुरवठा नसतानासुद्धा अशा प्रयुक्तीपासून ७०,००० ओर्स्टेड एवढे प्रचंड चुंबकीय क्षेत्र मिळते. या मूल्याचे क्षेत्र इतर कोणत्याही प्रकारे इतकी कमी ऊर्जा खर्च करून निर्माण करता येत नाही. या रीतीने चुंबकीय क्षेत्र निर्माण करणाऱ्या अतिसंवाहक चुंबकाकरिता वापरण्यात येणारी योजना आ. १३ मध्ये दाखविली आहे.
विविध क्षेत्रांतील संकीर्ण उपयोग : अतिसंवाहक पदार्थाच्या चुंबकीय परिरक्षक क्रियेचा उपयोग कार्यक्षम व काटेकोर चुंबकीय भिंग योजनांमध्ये केला जातो. ⇨ इलेक्ट्रॉन सूक्ष्मदर्शक यंत्रात अशा योजना इलेक्ट्रॉन शलाकांचे केंद्रीकरण करण्याकरिता वापरल्या जातात.
धातुविज्ञानामध्ये पोलादाचे अवक्षेपण क्रियेने कठिनीकरण करण्याकरिता त्यास द्रव नायट्रोजनामध्ये बुडविले जाते [→ धातूंचे अवक्षेपण कठिनीकरण].
शोषण पंपाच्या (अथवा क्रायोपंपाच्या) द्वारे निर्वात निर्माण करण्याकरिता भांड्यातील वायुकणांचे योग्य अशा प्रशीतित पृष्ठभागावर शीतन आणि संघनन (द्रव कणांच्या रूपात साचण्याची क्रिया) केले जाते. याकरिता २०° के. या प्रतीचे नीच तापमान वापरतात [→ निर्वात].
क्षेपणास्त्राचे अभिज्ञान करून देणारा अवरक्त अभिज्ञातक (वर्णपटातील तांबड्या रंगाच्या अलीकडील अदृश्य किरणांच्या साहाय्याने अस्तित्व ओळखणारे साधन) हा द्रव नायट्रोजनाच्या तापमानापर्यंत शीतन केल्यानंतर कार्यान्वित होतो.
अतिवेगवान आगगाड्यांमध्ये त्यांची चाके व रूळ यांमधील घर्षणामुळे ऊर्जेचा व्यय होतो व गाडीच्या महत्तम वेगावर मर्यादा येते. आगगाडीची चाके व रूळ या दोहोंवर समचुंबकीय ध्रुव असलेल्या अतिसंवाहक चिरचुंबकाची स्थापना करून त्यांच्या परस्पर अपसरणामुळे चाके रूळापासून वर उचलली जाऊन अधांतरी राहतील अशा योजना अभिकल्पित केल्या (आराखड्याच्या रूपात मांडलेल्या) गेल्या आहेत.
अतिसंवाहक संच हे विद्युत् चुंबकीय ऊर्जेचे संचायक म्हणून कार्य करू शकतात. त्यामध्ये जर (उदा., प्रवर्तन क्रियेने म्हणजे चुंबकीय स्त्रोतात बदल करून विद्युत् चालक प्रेरणा निर्माण करण्याच्या क्रियेने) विद्युत् प्रवाह निर्माण केला, तर तो काही सहस्त्र वर्षे तसाच वाहत राहील असे दाखविले गेले आहे.
संदर्भ : 1. Allen, R. J. Cryogenics, London, 1964.
2. Barron, R. Cryogenic Systems, New York, 1966,
3. Mclintock, M. Cryogenics, New York, 1964.
4. Mendelssohn, K., Ed. Progress in Cryogenics, London, 1964.
5. Rose Innes, A. C. Low Temperature Techniques : The Use of Liquid Helium in the Laboratory, London, 1964.
6. Saha, M. N. Srivastava, B. N., A Treatise on Heat, Allahabad, 1965.
7. Sittig, M. Cryogenics : Research and Applications, Princeton, 1963.
भावे, श्री. द.; चिपळोणकर, व. त्रिं.