धातूंचे मुलामे : एका धातूवर दुसऱ्या विशेष गुणाच्या धातूंचे चढविलेले लेप. गंजप्रतिबंधासाठी पोलाद, तांबे, पितळ यांवर जस्त, कथिल, निकेल, क्रोमियम इ. धातूंचे मुलामे देतात. धातूपासून बनविलेल्या वस्तूंच्या पृष्ठाभागावर त्याच्याशी एकजीव व सलग असे कवच निर्माण करून हे मुलामे गंजकारक वातावरण वा द्रव यांपासून आतल्या धातूंचे संरक्षण करतात. अर्थात मुलाम्यासाठी वापरण्यात येणाऱ्या धातू ऑक्सिजन अथवा हवेतील इतर वायू यांच्याशी रासायनिक दृष्ट्या असंयोगी असल्या पाहिजेत आणि त्यांनी गंजकारक वातावरणाचा त्याच्यातील धातूंशी संबंध येऊ देता कामा नये.
मुलाम्याची कार्यक्षमता ही त्याच्या जाडीवर अवलंबून असते आणि ही जाडी संरक्षण करावयाच्या धातूचे गुणधर्म, गंजकारक बाह्य परिस्थितीची तीव्रता, गंजप्रतिबंधाचा अपेक्षित काळ यांना अनुलक्षून ठरवावयाची असते. मुलाम्याच्या टिकाऊपणाकरिता व उत्कृष्ट संलग्नतेसाठी पृष्ठभागावर चिकटलेला कचरा, ग्रीज वगैरे तेलकट पदार्थ अथवा पूर्वी तयार झालेला गंज काढून धातूचा पृष्ठभाग अतिशय निर्मल करणे आवश्यक असते.
धातुपृष्ठाचे निर्मलीकरण व त्याची पूर्वतयारी : धातुपृष्ठाचे निर्मलीकरण आणि इतर तयारी पुढील क्रमाने करतात : (१) ग्रीज वगैरे तेलकट पदार्थ व कचरा काढून टाकणे, (२) ऑक्साइड अथवा इतर प्रकारचा गंज काढून टाकणे आणि (३) संलग्नता सुधारण्यासाठी निर्मल धातुपृष्ठावर विशेष संस्कार करणे.
निर्मलीकरणाच्या विविध पद्धती : विद्रावकाने निर्मलीकरण :धातूवस्तूच्या प्रत्यक्ष उत्पादनापासून मुलामे चढविण्याच्या कृतीपर्यंतच्या कालखंडामधील गंजप्रतिबंधासाठी लावलेली तेले, ग्रीज वा इतर स्नेहमय पदार्थ काढून टाकण्याकरिता ही पद्धत वापरतात. ह्यासाठी नॅप्था, क्लोरीनयुक्त हायड्रोकार्बने, टोल्यूइन, झायलीन आणि ॲसिटोन इ. कार्बनी विद्रावक (विरघळविणारे पदार्थ) विशेष उपयोगात आहेत. या सफाईनंतर धातुपृष्ठ क्षारयुक्त (अल्कलीयुक्त) गरम पाण्याने धुवून घेतात. ह्या पाण्यात साबण, प्रक्षालक (डिटर्जंट) वगैरे जातीचा आर्द्रकारक पदार्थ टाकल्यास धातुपृष्ठ कुठल्याही द्रवाने ओले होण्यास सुयोग्य होते. विशेषतः विद्युत् विलेपनासाठी हे आवश्यक आहे.
क्षारांच्या साहाय्याने निर्मलीकरण :ट्रायसोडियम फॉस्फेटाच्या विद्रावात साबण आणि दाहक (कॉस्टिक) सोड्याचा धातुपृष्ठ ओले करणारा विद्राव टाकतात. जुना रंग काढून टाकण्यासाठी हा विद्राव चांगला उपयोगी पडतो. वरील क्षारीय विद्रावाने धुतल्यानंतर पाण्यात खळबळणे व ०·१% क्रोमिक अम्ल अथवा सोडियम वा पोटॅशियम क्रोमेटाने धुणे या क्रिया थोडादेखील क्षार धातुपृष्ठावर राहू न देण्यासाठी करणे आवश्यक असते. धातू ऋणाग्री नेणारा विद्युत् प्रवाह क्षारीय धुलाईच्या वेळी चालू ठेवल्यास तेथे भरपूर हायड्रोजन वायू निर्माण होतो आणि विद्राव खळबळला जाऊन तेलकट पदार्थ निघून जाण्यास मदत होते.
यांत्रिक निर्मलीकरण : या पद्धतीत प्रक्षालके व अपघर्षक (खरवडून व घासून पृष्ठभाग गुळगुळीत करणाऱ्या पदार्थाची) पूड लावून केसांच्या कुंच्याने वस्तू घासतात. सुटा गंज व इतर मलद्रव्ये काढण्यास ही पद्धत उपयुक्त आहे. घट्ट चिकटलेला कचरा व ऑक्साइडाचा पापुद्रा काढण्यासाठी बोथट छिन्न्या, खरवडण्याच्या सुऱ्या, तारांचे ब्रश वगैरे वापरावे लागतात. उरलेली धूळ व सुटा कचरा एखादा विद्रावक आणि गरम पाण्याच्या धुलाईने काढून टाकतात.
ज्योत निर्मलीकरण :धातुपृष्ठावरील ओल आणि सुटा ऑक्साइड पापुद्रा काढण्याची ही सोपी पद्धत आहे. ज्योतीने पृष्ठभाग तापविला म्हणजे ओल नाहीशी होते व पापुद्रा सुटून अलग होतो. पृष्ठ थंडहोण्यापूर्वी पुढील प्रक्रिया केली म्हणजे पुन्हा पृष्ठावर बाष्पाचे संघनन (द्रवीकरण) होत नाही.
वालुकाझोताने निर्मलीकरण : काही प्रकारचे लेप खडबडीत पृष्ठावर चांगले बसतात. उदा., रंग फवारलेले धातूंचे मुलामे. अशा ठिकाणी वालुकाझोताने निर्मलीकरण करण्याची पद्धत योग्य ठरते. या पद्धतीत २ ते ७ किग्रॅ./सेंमी.२ दाबाच्या हवेच्या झोतामध्ये बारीक वाळू मिसळून तो झोत धातूपृष्ठावर सोडला जातो. तीव्र वेगाने आपटणाऱ्या वाळूमुळे ऑक्साइडाचा पापुद्रा निघून जातोच आणि पृष्ठभाग खरखरीतही होतो. विशेषतः मोठ्या क्षेत्रफळाच्या पोलादपृष्ठावर ही पद्धत चांगली लागू पडते परंतु ह्या पद्धतीस फार किंमतीची साधनसामग्री लागते व वाळूचे अतिसूक्ष्म कण कर्मचाऱ्यांच्या फुफ्फुसात गेले, तर सिलिकॉसीस (वालुकाजन्य फुफ्फुस रोग) हा रोग होण्याची शक्यता असते. म्हणून ही पद्धत वापरताना अतिशय काळजी घ्यावी लागते.
धातुमार्जन : अम्ल धातुमार्जन पद्धती ही यांत्रिक अथवा वालुकाझोत निर्मलीकरणापेक्षा सोपी आहे कारण त्याकरिता विशेष साहित्य लागत नाही. ॲल्युमिनियम सोडून सर्व धातू अम्लात बुचकळून निर्मल करता येतात फक्त ॲल्युमिनियम निर्मल करण्यासाठी ती क्षारात बुचकळून काढतात. मात्र वेगवेगळ्या धातूंकरिता वेगवेगळी अम्ले वापरावी लागतात.
पोलादाकरिता कोमट सल्फ्यूरिक अम्ल अथवा थंड हायड्रोक्लोरिक अम्ल वापरतात. ऑक्साइड विरघळवून राहिलेले अम्ल क्षाराने धुवून काढतात परंतु क्षाराचा थोडा जरी भाग पृष्ठभागावर राहिला, तरी नंतर दिलेल्या मुलाम्याचे आयुष्य कमी होते म्हणून क्षाराऐवजी फॉस्फोरिक अम्लाने धुणे जास्त चांगले. फॉस्फोरिक अम्लाने धुतल्यानंतर फॉस्फेटाचा मंद धूसर रंगाचा पापुद्रा तयार होतो. तो गंजण्यापासून तात्पुरते संरक्षणही करतो व रंगास घट्ट धरून ठेवण्यासही मदत करतो.
ऑक्साइड पापुद्रा जास्तच घट्ट असेल, तर विद्युत् धातुमार्जन पद्धत अवलंबतात. या पद्धतीस अम्लाच्या वापरात वाढ न होता ऑक्साइड पापुद्रा मात्र वेगाने नाहीसा केला जातो. साफ करावयाची धातू धनाग्री वा ऋणाग्री करणाऱ्या अशा दोन्ही पद्धती वापरात आहेत. पोलादाच्या धन धातुमार्जनामघ्ये ३०% सल्फ्यूरिक अम्लाचा पोटॅशियम क्रोमेटमिश्रित विद्राव वापरतात. प्रवाहघनता सु. ०·१ अँपि./सेंमी.२ असते. ह्या पद्धतीने पोलादाचा स्वच्छ आणि रेशमी कापडासारखा चकचकीत पृष्ठभाग तयार होतो. ह्या पद्धतीत हायड्रोजन वायूच्या विसर्जनामुळे (बाहेर पडण्यामुळे) येणारा ठिसूळपणाही टाळला जातो.
अगंज (स्टेनलेस) पोलादाच्या बाबतीत जरा जास्त परिणामकारक प्रक्रिया करावी लागते. यासाठी सल्फ्यूरिक अम्ल व हायड्रोक्लोरिक अम्लाचे ६५° ते ७५° से.पर्यंत तापवलेले मिश्रण पुष्कळ ठिकाणी वापरतात पण वितळविलेल्या दाहक क्षारांमध्ये बुचकळण्याची पद्धतीही हळूहळू वापरात येत आहे. ह्या पद्धतीत ३७०° से. तापमानाच्या दाहक सोड्यामध्ये १·५ ते २% सोडियम हायड्राइड मिसळून त्यात धातुवस्तू बुचकळून काढतात. खालील विक्रियांनुसार ऑक्साइडाचे तात्काळ धातूमध्ये रूपांतर होते.
|
4 NaH सोडियम हायड्राइड |
+ |
Fe3O4 फेरिक ऑक्साइड |
® |
3 Fe लोह |
4 NaOH दाहक सोडा |
|
NaH सोडियम हायड्राइड |
+ |
CuO कॉपर ऑक्साइड |
® |
Cu तांबे |
NaOH दाहक सोडा |
ह्या विक्रियांमुळे ऑक्साइडाचा पापुद्रा धातूपासून सोडवला जातो व तो पुढील द्रुतशीतनामध्ये गळून पडतो किंवा थोडा राहिला, तरी बोळ्याने पुसून काढता येतो. ज्या धातूंवर ३७०° से. तापमानाला दाहक सोड्याचा परिणाम होत नाही, त्या सर्वांवर ही पद्धत वापरता येईल.
मुलाम्यांचे वर्ग : गंजापासून संरक्षण करण्याच्या दोन प्रकारांनुसार मुलाम्यांचे धनाग्री व ऋणाग्री असे दोन वर्ग होतात.
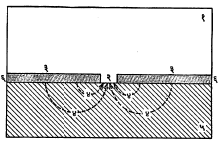 धनाग्रभूत मुलामे : मुलाम्याची धातू पायिक (मुलामा जिच्यावर द्यावयाचा त्या) धातूच्या (वस्तूच्या) दृष्टीने धनाग्री (ॲनोडिक) असेल, तर अशा मुलाम्यांना धनाग्रभूत मुलामे म्हणतात [विद्युत् रासायनिक घटातील ज्याचे विद्युत् अग्र वर्चस् म्हणजे घटातील विद्रावाच्या सापेक्ष विद्युत् पातळी, कमी असेल त्या धातुघटकाला धनाग्री म्हणतात → विद्युत् रासायनिक श्रेणी]. उदा., जस्त, ॲल्युमिनियम, कॅडमियम या धातू पोलादाच्या दृष्टीने धनाग्री असतात कारण त्यांचे विद्राव वर्चस् पोलादापेक्षा जास्त आहे. त्यामुळे वरील धातूंचे पोलादावरील मुलामे धनाग्रभूत होतात. जर धनाग्रभूत मुलामा (उदा., पोलादावरील ॲल्युमिनियम) आ. १ मध्ये दाखविल्याप्रमाणे काही जागी खंडित झाला अथवा त्यास छिद्रे पडली, तर ॲल्युमिनियम आणि उघडा पडलेला पोलादाचा भाग यामध्ये विद्युत् (गॅल्व्हानिक) घट तयार होतो. ॲल्युमिनियम पोलादाच्या दृष्टीने धनाग्री असल्यामुळे ओलाव्यात विरघळते व ह्या विरघळण्याच्या क्रियेमुळे गंजकारक विद्युत् प्रवाह चालू राहतो. जवळपासचा सर्व मुलामा विरघळल्याशिवाय उघड्या पडलेल्या पोलादपृष्ठाला गंजक्रियेचा जरादेखील स्पर्श होऊ शकत नाही. अशा प्रकारच्या संरक्षणाचे क्षेत्र गंजकारक बाह्य परिस्थितीच्या विद्युत् संवाहकतेवर अवलंबून असते. पिण्याच्या पाण्यासारख्या कमी संवाहकता असलेल्या द्रवांमध्ये हे संरक्षण ०·३ ते १·२५ सेंमी. पर्यंत मर्यादित असते. तेच जास्त संवाहकता असलेल्या समुद्राच्या पाण्यामध्ये अनेक सेंमी. रुंदीचा उघडा पडलेला भागसुद्धा संरक्षित राहू शकतो.
धनाग्रभूत मुलामे : मुलाम्याची धातू पायिक (मुलामा जिच्यावर द्यावयाचा त्या) धातूच्या (वस्तूच्या) दृष्टीने धनाग्री (ॲनोडिक) असेल, तर अशा मुलाम्यांना धनाग्रभूत मुलामे म्हणतात [विद्युत् रासायनिक घटातील ज्याचे विद्युत् अग्र वर्चस् म्हणजे घटातील विद्रावाच्या सापेक्ष विद्युत् पातळी, कमी असेल त्या धातुघटकाला धनाग्री म्हणतात → विद्युत् रासायनिक श्रेणी]. उदा., जस्त, ॲल्युमिनियम, कॅडमियम या धातू पोलादाच्या दृष्टीने धनाग्री असतात कारण त्यांचे विद्राव वर्चस् पोलादापेक्षा जास्त आहे. त्यामुळे वरील धातूंचे पोलादावरील मुलामे धनाग्रभूत होतात. जर धनाग्रभूत मुलामा (उदा., पोलादावरील ॲल्युमिनियम) आ. १ मध्ये दाखविल्याप्रमाणे काही जागी खंडित झाला अथवा त्यास छिद्रे पडली, तर ॲल्युमिनियम आणि उघडा पडलेला पोलादाचा भाग यामध्ये विद्युत् (गॅल्व्हानिक) घट तयार होतो. ॲल्युमिनियम पोलादाच्या दृष्टीने धनाग्री असल्यामुळे ओलाव्यात विरघळते व ह्या विरघळण्याच्या क्रियेमुळे गंजकारक विद्युत् प्रवाह चालू राहतो. जवळपासचा सर्व मुलामा विरघळल्याशिवाय उघड्या पडलेल्या पोलादपृष्ठाला गंजक्रियेचा जरादेखील स्पर्श होऊ शकत नाही. अशा प्रकारच्या संरक्षणाचे क्षेत्र गंजकारक बाह्य परिस्थितीच्या विद्युत् संवाहकतेवर अवलंबून असते. पिण्याच्या पाण्यासारख्या कमी संवाहकता असलेल्या द्रवांमध्ये हे संरक्षण ०·३ ते १·२५ सेंमी. पर्यंत मर्यादित असते. तेच जास्त संवाहकता असलेल्या समुद्राच्या पाण्यामध्ये अनेक सेंमी. रुंदीचा उघडा पडलेला भागसुद्धा संरक्षित राहू शकतो.
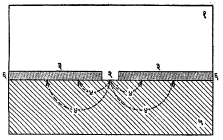
ऋणाग्रभूत (कॅथोडिक) मुलामे : हे मुलामे पायिक धातूपेक्षा जास्त अभिजात (विद्युत् रासायनिक श्रेणीच्या तळाशी असलेल्या) धातूंचे असतात. उदा., पोलादावर तांबे, निकेल, क्रोमियम, चांदी आणि थोड्या प्रमाणावर सोने आणि प्लॅटिनम यांचे. गंजण्यापासून पायिक धातूचे परिणामकारक रीत्या संरक्षण करण्याकरिता असे मुलामे संपूर्णपणे अखंड व अच्छिद्र असावे लागतात. आ. २ मध्ये दाखविल्याप्रमाणे खंडित व सच्छिद्र ऋणाग्रभूत मुलामे असणे हे पायिक धातूला अजिबात मुलामे नसण्यापेक्षा अधिक अनिष्ट आहे. विशाल ऋणाग्रभूत मुलामापृष्ठ व उघडे पडलेले लहान क्षेत्राचे धातुपृष्ठ ह्या जोडीमध्ये धनाग्री धातुपृष्ठाचे तीव्र वेगाने संक्षारण (झीज) होते व मुलाम्यातील छिद्रांपाशी खालील धातूला खड्डे (मुलामा पत्र्यावर असल्यास आरपार भोके) पडतात.
अग्रांच्या ध्रुवतेत उलटापालट : काही विशिष्ट परिस्थितींमध्ये विद्युत् रासायनिक श्रेणीमधील धातूंच्या स्थानांमध्ये अदलाबदल होते. उदा., ॲल्युमिनियम सामान्यतः पोलादाच्या दृष्टीने धनाग्री असते परंतु कॅल्शियम बायकार्बोनेटयुक्त कठीण (साबणाचा फेस सुलभपणे होत नाही अशा) पाण्यात ॲल्युमिनियम मुलाम्यातील छिद्रांपाशी खालील पोलाद गंजते. याचाच अर्थ असा की, ॲल्युमिनियम पोलादाच्या दृष्टीने ऋणाग्री होते. काही विशिष्ट पाण्यांमध्ये नेहमी पोलादाच्या दृष्टीने धनाग्री असलेले जस्त ६०° से.च्या वरील तापमानास ऋणाग्री होते. कॅडमियमामध्ये बऱ्याच परिस्थितींमध्ये अशा प्रकारच्या उलटापालटीची शक्यता असल्यामुळे कॅडिमियमाचे मुलामे अच्छिद्र असणेच इष्ट असते. अशाच प्रकारचे आणखी एक उदाहरण म्हणजे पोलादाचे कथिलाच्छादित पत्र्याचे खाद्यपदार्थ ठेवण्याचे डबे हे होय. विद्युत् रासायनिक श्रेणीमध्ये कथिल पोलादाच्या दृष्टीने ऋणाग्री आहे परंतु हवेच्या अनुपस्थितीत आणि कार्बनी अम्लयुक्त खाद्यपदार्थांच्या उपस्थितीत ते आपली ध्रुवता बदलते. डब्याच्या बाहेर ऑक्सिडीकारक [→ऑक्सिडीभवन] वातावरण असल्यामुळे कथिल ऋणाग्री असते. त्यामुळे दमट वातावरणात कथिलाच्या मुलाम्यातील सूक्ष्म छिद्रांपाशी गंजाचे कण आढळतात पण मुलामा मात्र चकचकीत राहतो. डब्याच्या आतील हवा काढून टाकलेली असल्यामुळे कथिल पोलादाच्या दृष्टीने धनाग्री बनते व स्वतः गंजते. यामुळेच बरेच दिवस ठेवलेले लोणच्यासारख्या पदार्थांचे डबे उघडून पाहिल्यास मुलाम्याचा पृष्ठभाग निस्तेज झाल्याचे दिसून येते.
मुलामा देण्याच्या पद्धती : धातुपृष्ठावर मुलामे देण्यासाठी खालील पद्धती वापरतात.
विद्युत् विलेपन : ही धातूंच्या मुलाम्याची अत्यंत महत्त्वाची पद्धत आहे. या पद्धतीने मुलामा देण्याकरिता नेहमी वापरल्या जाणाऱ्या धातू म्हणजे जस्त, निकेल, क्रोमियम, कथिल आणि तांबे या होत. पितळेवर चांदीचा मुलामाही याच पद्धतीने देतात.
ह्या पद्धतीत मुलाम्याच्या धातूच्या लवणाच्या विद्रावातून एकदिश विद्युत् प्रवाह पाठविला जातो. त्यामुळे लवणाचे विद्युत् विच्छेदन (विजेच्या प्रवाहाने रेणूचे तुकडे) होऊन मुलाम्याच्या धातूचे वस्तूच्या धातुपृष्ठावर मुलाम्याच्या रूपात निक्षेपण (साचण्याची क्रिया) होते. ह्या विद्युत् विच्छेदक घटाच्या ऋणाग्री पायिक धातू असते व धनाग्री मुलामा द्यावयाची धातू अथवा अन्य संवाहक असतो. लवणाचे विद्रावातील प्रमाण विद्युत् प्रवाह घनता, विद्रावाचे तापमान, खळबळण्याची क्रिया व विद्रावाचे pH मूल्य [ → पीएच् मूल्य] यांवर मुलाम्याचे गुणधर्म अवलंबून असतात [ → विद्युत् विलेपन].
निमज्जन : (स्थानांतर विलेपन). ह्या पद्धतीत पायिक धातू मुलाम्याच्या धातूच्या लवणाच्या विद्रावात बुडवितात. विद्युत् प्रवाह वापरला जात नाही आणि निक्षेपणाचे कार्य केवळ स्थानांतराने होते. पायिक धातूच्या अणूंकडून अभिजात धातूचे आयन (विद्युत् भारित अणू) तिच्या लवणाच्या विद्रावातून आपल्याकडे ओढले (स्थानांतरित केले) जातात हे तत्त्व या पद्धतीच्या मागे आहे. अर्थातच हे ऋणाग्रभूत मुलामे असतात.
निमज्जित मुलामे अतिशय समांगी (सर्वत्र एकसारखे) असतात, परंतु ते फार पातळही असतात. त्यांचा उपयोग विशेषकरून इतर धातवीय वा कार्बनी मुलाम्यांना आधार म्हणून होतो. उदा., ॲल्युमिनियम व मॅग्नेशियम यांवर निकेलाचे विद्युत् विलेपन करण्यापूर्वी जस्ताचा थर ह्याच पद्धतीने देतात.
निकेल, कथिल, सोने आणि चांदी यांचे मुलामे शोभेकरिता, मालिन्यप्रतिकाराकरिता वा परावर्तनांक (परावर्तित प्रकाशाचे प्रमाण) वाढविण्याकरिता द्यावयाचे असले, तर ह्याच पद्धतीने देतात.
ह्याच प्रकारच्या नुकत्याच प्रचारात आलेल्या कानिगेन प्रक्रियेत निकेल सल्फेट आणि सोडियम हायपोफॉस्फाइट यांच्या मिश्र विद्रावात पायिक धातुवस्तू बुडवून ठेवतात. विद्रावाचे तापमान ९८° ते १००° से. व pH मूल्य ४·५ ते ५ असते. निकेलाच्या लवणाचे सोडियम हायपोफॉस्फाइटाने ⇨ क्षपण होते.
|
NaH2PO2 सोडियम हायपोफॉस्फाइट |
+ |
NiSO4 निकेल सल्फेट
|
+ |
H2O पाणी |
→ |
N I निकेल |
+ |
NaH2PO3 सोडियम हायपोफॉस्फेट
|
+ |
H2SO4 सल्फ्यूरिक अम्ल |
|
3 Ni निकेल |
+ |
3 H (HPO2) हायपोफॉस्फेट |
→ |
Ni3P निकेल फॉस्फाइड |
+ |
2 H3PO3 ऑर्थो फॉस्फोरिक अम्ल |
||||
निकेल आणि निकेल फॉस्फाइड (५ ते ८%) यांची मिश्रधातू पायिक धातूवर समांगी लेपित होते. हा मुलामा अतिशय घट्टपणे धातूला धरुन राहतो व खूप कठीणही असतो. मिश्र विद्रावाची घटना, तापमान आणि pH मूल्य यांचे काळजीपूर्वक नियंत्रण करून १०० ते २०० मायक्रॉन (१ मायक्रॉन = १०-३ मिमी.) जाडीपर्यंत समांगी लेप देता येणे शक्य होते. त्याच्या जाडीमुळे आणि सघन, अस्फटिकी रचनेमुळे असा मुलामा अच्छिद्र असतो. त्यामुळे त्याचा गंजप्रतिकारही अप्रतिम असतो. त्याच्या उत्कृष्ट झीजविरोघी गुणधर्मांमुळे तो उपकरणांमधील दंतचक्रांवर व जेथे वस्तूचे माप अगदी अचूक पाहिजे असेल तेथे वापरतात.
द्रवधातू बुचकळी : द्रवधातू बुचकळी म्हणजे जिचा मुलामा द्यावयाचा त्या धातूच्या रसात वस्तू बूडविणे, ही मुलामा देण्याची सर्वांत जुनी पद्धत आहे. ती कमी खर्चाची असल्यामुळे अजूनही वापरात आहे परंतु ती कमी तापमानाला वितळणाऱ्या धातूंच्या (उदा., जस्त, कथिल, शिसे, ॲल्युमिनियम यांचे मुलामे देण्याच्या) बाबतीतच उपयोगी पडते.

द्रवधातू बुचकळी मुलाम्यामध्ये दोन थर असतात एक पायिक धातूला घट्ट पकडून ठेवणारा पायिक धातूशी संयोग होऊन तयार झालेला मिश्रधातूचा थर व दुसरा वरचा शुद्ध मुलाम्याच्या धातूचा थर. द्रवधातू पायिक धातूच्या पृष्ठभागाला चिकटली की, तिचे पायिक धातुपृष्ठातून आत विसरण (रेणू एकमेकांत मिसळण्याची क्रिया) होते व काही प्रमाणात पायिक धातूशी संयोग होतो. जास्त तापमानाच्या द्रवधातूत पायिक धातू बराच वेळ बुडवून ठेवल्यास विसरण अधिक प्रमाणावर होऊनमिश्रधातूच्या संयोगी थराची जाडी वाढते. सामान्यतः हा मिश्रधातूचा घन विद्राव (दोन धातूंचे समांगी मिश्रण) नसून दोन धातूंचे म्हणजे आंतरधातवीय संयुगच असते. उदा., जस्त मुलाम्यात, कथिल मुलाम्यात आणि ॲल्युमिनियम मुलाम्यात या आंतरधातवीय संयुगरूपी मिश्रधातूच मुलाम्याच्या पायिक धातूबरोबरच्या संलग्नतेला कारणीभूत होतात परंतु ही संयुगे खूप ठिसूळ असतात व त्यामुळे वाकविण्याच्या क्रियेमध्ये त्यांचा थर मोडण्याचे भय असते. म्हणून आधुनिक तंत्रात हा थर कमीतकमी जाडीचा करण्यावर भर दिला जात आहे. या पद्धतीने तयार केलेल्या कथिलाच्छादित पत्र्याचा छेद आ.३मध्ये दाखविला आहे. मुलाम्यांच्या धातूच्या रसातून पायिक धातू बाहेर काढताना मिश्रधातूच्या थराला चिकटून शुद्ध धातूही बाहेर येते. ह्या शुद्ध धातूच्या थराची जाडी वस्तू बाहेर काढण्याच्या वेगावर अवलंबून असते. वस्तू जास्त वेगाने बाहेर काढल्यास थंड होण्याचा वेग वाढतो व द्रवधातू वाहून जाण्यास कमी वेळ मिळतो त्यामुळे ह्या थराची जाडी वाढते. अशा रीतीने एकंदर मुलाम्याची जाडी द्रवधातूचे तापमान, बुडवून ठेवण्याचा अवधी आणि बाहेर काढण्याचा वेग यांवर अवलंबून असते.
गॅल्व्हानीकरण : (जस्तलेपन). द्रवधातू बुचकळी पद्धतीने खालील महत्त्वाचे मुलामे दिले जातात. धातूंवरील मुलाम्यांत (नरम) पोलादावरील जस्ताचा मुलामा सर्वांत जास्त वापरला जातो व त्यासाठी द्रवधातू बुचकळी पद्धत मोठ्या प्रमाणावर उपयोगात आहे. बाष्पित्रासाठी (बॉयलरसाठी)वापरीत असलेल्या जाड पोलादी पत्र्याचा एक मोठा हौद जस्त वितळविण्यासाठी वापरतात. इंधन तेल, इंधन वायू वा विद्युत् शक्ती यांच्या साह्याने तो तापविला जातो. जस्ताचे तापमान ४२५° ते ४६०° से. इतके ठेवले जाते. यापेक्षा जास्त तापमान ठेवल्यास हौदाचा पोलादी पत्राच जस्तामध्ये विरघळू लागतो. जस्ताच्या रसात कमी तापमानाचा पोलादी पदार्थ बुडविल्यावर रसाच्या तापमानात फार फरक पडू नये म्हणून ताशी एक टन पोलाद लेपित करावयाचे असल्यास हौदात २० टन जस्त कायम ठेवतात.
पोलादी तारेच्या लेपनाकरिता तार रिळावर गुंडाळून घेतातव ती मग सातत्याने ओढली जाते. अनुशीतनासाठी (विशिष्ट तापमानाला तापवून मग सावकाश थंड करण्याची क्रिया करण्यासाठी) ती एका द्रव शिसे भरलेल्या हौदातून नेतात. नंतर ती क्रमाने हायड्रोल्कोरिक अम्ल, पाणी आणि झिंक अमोनियम-क्लोराइड या अभिवाहातून (ऑक्सिडीभवन होऊ नये म्हणून वापरण्यात येणाऱ्या पदार्थातून) जाते. शेवटी ती जस्ताच्या हौदातून जाऊन बाहेर येते. लगेच तीला पाण्याच्या फवाऱ्याने थंड करून दुसऱ्या रिळावर गुंडाळतात.
पोलादी पत्रा आ. ४ मध्ये दाखविल्याप्रमाणे प्रथम क्षाराने आणि अम्लाने साफ करून पाण्याने धुवून, वाळवून मग झिंक अमोनियम क्लोराइडाने अभिवाहित केला जातो. नंतर ४५०° से. तापमानाच्या द्रव जस्तातून जातो आणि तेथून बाहेर पडल्याबरोबर थंड केला जातो. दुसऱ्या एका पद्धतीत पत्र्याच्या पृष्ठभागाचे प्रथम ऑक्सिडीकरण करतात. मग त्याचे दुसऱ्या भट्टीमध्ये हायड्रोजनाच्या साह्याने जस्तलेपन, क्षपण व अनुशीतन एकदमच पार पडते. मग अभिवाह न लावताच तो पत्रा जस्ताच्या हौदात जातो.
लोखंडी नळ अभिवाहाने धुतल्यावर, द्रव जस्तावर तंरगणाऱ्या अभिवाहातून खाली ढकलले जातात. नंतर ते जास्तीत जास्त जस्त वाहून जाईल अशा पद्धतीने बाहेर काढतात. शिवाय काही अतिरिक्त जस्त त्यांच्या बरोबर आल्यास ते वाफेच्या झोताने काढून टाकतात.
छोट्या वस्तू त्यांचे अम्लमार्जन आणि अभिवाहन झाल्यानंतर पोलादी जाळीच्या टोपलीत ठेवून बुचकळून काढतात आणि नंतर गरगर फिरवून अतिरिक्तजस्तकाढून टाकतात.
जस्त मुलाम्यासंबंधी विनिर्देश दर चौ. मी. पृष्ठास अमुक अमुक ग्रॅम जस्त असा करतात. पत्र्याच्या बाबतीत त्याला दोन पृष्ठे असल्याने विनिर्देश वरील आकड्याच्या दुप्पट असतो. सामान्यतः पत्र्यांवर ३७५ ते ८२५ ग्रॅ./चौ. मी. पत्र्यास व इतर वस्तूंवर ३०० ते ६९० ग्रॅ./चौ. मी. पृष्ठास असा मुलामा असावा लागतो. एका प्रयोगात ६०० ग्रॅ./चौ.मी. मुलामा औद्योगिक परिसरात५ वर्षे व खेड्यातील वातावरणात २३ वर्षे टिकला.

घरबांधणी व मोटारीच्या सांगाड्यातले बरेचसे भाग जस्तलेपित केलेले असतात उदा., सपाट व पन्हळी पत्रे, मुख्य स्विचांच्या पेट्या, लहान मोठे पाण्याचे वा विद्युत् केबली आत घालायचे नळ व त्यांचे कोपरे, सांधे वगैरे कुंपणाच्या लोखंडी तारा, इतर तारांच्या व पत्र्यांच्या वस्तू, खिळे, स्क्रू, घरी वापरण्याची पाण्याची लोखंडी पिंपे वगैरे.आता तर पुलाच्या मोठमोठ्या तुळया आणि उच्च दाबाच्या विजेच्या तारांचे व दूरचित्रवाणी मनोरे यांच्या जोडकामातील पोलादी पट्ट्या वगैरेसुद्धा जस्तलेपित करतात. अन्नपदार्थांकरिता विशेषतः अम्लधर्मीयांसाठी मात्र जस्तलेपन केलेली भांडी योग्य नसतात. त्यांना कथिलाचा मुलामा द्यावा लागतो.
कथिलाचा मुलामा : हा मुलामा देण्याची पद्धत मूलतः जस्तलेपनासारखीच म्हणजे द्रवधातू बुचकळीचीच असते. मुलामा जीवर द्यायचा आहे, अशा धातूचे अम्लमार्जन व धुलाई ह्या क्रिया केल्यावर काही विशिष्ट क्रिया मात्र येथे कराव्या लागतात [→कथिलाच्छदित पत्रे].
ॲल्युमिनियमाचा मुलामा : ॲल्युमिनियमाच्या मुलाम्यामुळे पोलादास गंजप्रतिकार, तापरोध, परावर्तकता आणि सुंदर रूप हे गुण प्राप्त होतात. उच्च तापमानास ऑक्सिडीकरण होणे व त्यामुळे पापुद्रे सुटणे यांपासून संरक्षण होण्यासाठी ॲल्युमिनियमाच्या शुद्ध थरापेक्षा लोह व ॲल्युमिनियमाचे आंतरधातवीय संयुग जास्त चांगले असते. पृष्ठभाग प्रदेशात १०% ॲल्युमिनियम आल्यास जास्तीत जास्त संरक्षण मिळते.
खालील दोन अडचणीमुळे ॲल्युमिनियमाच्या मुलाम्यांसंबंधीची प्रगती खुंटली आहे. ॲल्युमिनियम चटकन लोहात मिसळते.लोह-ॲल्युमिनियमाच्या आंतरधातवीय संयुगाची जाडी फक्त तापमानावर अवलंबून असते. मुलाम्यानंतर काही यांत्रिक संस्कार करावयाचे असल्यास या संयुगाची जाडी एकूण मुलाम्याच्या जाडीच्या १/३ ते १/५ च असावी लागते. त्यासाठी तापमानावर फार अचूक नियंत्रण ठेवणे आवश्यक असते, ते सहजी मिळू शकत नाही. दुसरे कारण म्हणजे ॲल्युमिनियमाला असलेले ऑक्सिजनाचे आकर्षण. पोलादाच्या पृष्ठभागावर थोडे जरी ऑक्साइड शिल्लक असले, तरी लगेच त्याची ॲलयुमिनियमाशी विक्रिया होऊन ॲल्युमिनियम ऑक्साइड तयार होते व त्यामुळेमुलाम्याच्या संलग्नतेला बाध येतो. हे टाळण्यासाठी त्याच्या लेपनाला खालील पद्धती वापराव्या लागतात.
(१) धातुमार्जन व धुलाईनंतर १,०००° से. तापमानाच्या हायड्रोजनयुक्त भट्टीतून पोलाद नेतात. त्यामुळे ऑक्सिजन, गंधक व कार्बन हे पाणी, हायड्रोजन सल्फाइड व मिथेन या स्वरूपांत निघून जातात व पृष्ठभागावर हायड्रोजनाचे एक संरक्षक आवरण राहते. पोलाद ॲल्युमिनियमाच्या हौदात शिरून, ॲल्युमिनियमाचे लोहाशी संलग्न असे आंतरधातवीय संयुग तयार होईपर्यंत हे आवरण त्याचे रक्षण करते.
(२) दुसऱ्या एका पद्धतीत पोलादावर प्रक्रिया करण्याऐवजी ॲल्युमिनियमाच्या द्रवामध्येच हाड्रोजन वायृ संपृक्त करून (जास्तीत जास्त प्रमाणात विरघळवून) ठेवतात, त्यामुळे ऑक्सिडीकरण होऊ शकत नाही.
(३) सर्वांत महत्त्वाची पद्धत म्हणजे सेंटझिमीर पद्धत आहे. या पद्धतीत प्रथम पोलाद पृष्ठाचे थोडेसे ऑक्सिडीकरण करून घेतात. मग त्याचे क्षपण करतात व लगेच ते ॲल्युमिनियमामध्ये बुचकळतात. नुकत्याच तयार झालेल्या लोहाशी ॲल्युमिनियमाचा चटकन संयोग होऊन आंतरधातवीय संयुग तयार होते.
ॲल्युमिनियमाचा मुलामा दिलेले पोलाद लाटल्यानंतर शुद्ध ॲल्युमिनियमासारखे दिसू लागते. ४५०° से. तापमानापर्यंत रंग न जाता तो मुलामा पोलादाचे रक्षण करतो. त्यापुढे त्याची पोलादाशी वाढत्या प्रमाणात मिश्रधातू तयार होऊन तापरोधक आंतरधातवीय संयुग तयार होते. ह्या मुलाम्याची संलग्नता इतकी चांगली असते की, कसाही बाक दिला, तरी तो तुटत नाही वा त्याचे छिलके (पापुद्र्यांचे तुकडे) उडत नाहीत. जास्त महागड्या मिश्रपोलादापेक्षा ॲल्युमिनियमाचा मुलामा दिलेले साधे पोलाद तेच काम करूनही स्वस्तात पडते. भट्ट्या, धुराडी, परावर्तक, घरबांधणीचे सांगाडे, शेतांची कुंपणे इ. ठिकाणी ते वापरतात.
शिशाचा मुलामा : पोलादावर शिशाचा मुलामा देण्यासाठी पोलादावर प्रथम कथिलाचा एक पातळ थर तरी बसवून घ्यावा लागतो नाहीतर शिसे व कथिलाची मिश्रधातू तरी वापरावी लागते. कारण एकटे शिसे पोलादाबरोबर आंतरधांतवीय संयुग करण्यास असमर्थ आहे. एरवी मुलाम्याची पद्धत अम्लमार्जन, धुलाई, द्रवधातू बुचकळी अशीच असते. शिसे आणि कथिलाच्या मिश्रघातूचा मुलामा दिलेल्या पोलादी पत्र्यास ‘टर्न प्लेट’ म्हणतात. छपराचे पत्रे, पेट्रोल आणि तेल ठेवण्याच्या मोठमोठ्या टाक्या, पिंपे व हौद यांकरिता शिशाचा मुलामा दिलेले पत्रे वापरतात. द्रवधातू बुचकळी पद्धतीमध्ये वस्तूवरील छोट्या खोबणी एकतर मुलामारहित तरी राहतात किंवा त्यांच्यावर इतर ठिकाणांपेक्षा जास्त जाडीचा थर येतो. साधे आकार सोडले, तर ह्या पद्धतीमुळे नेहमीच असमांगी मुलामे मिळतात तरीही स्वस्त धातूंचे जाड मुलामे देण्यास द्रवधातू बुचकळी पद्धत विद्युत् विलेपनापेक्षा स्वस्त पडते.
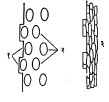
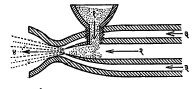
धातूचा फवारा : ह्या पद्धतीत मुलाम्याच्या धातूचे तापविलेले बारीक कण जोराने धातुपृष्ठावर सोडतात. जेव्हा हे सूक्ष्म कण धातुपृष्ठावर आपटतात तेव्हा ते एकदम चपटे होतात व धातूच्या उंचसखल भागात अडकून बसतात. अशा रीतीने चपटे झालेले असंख्य कण एकमेकांत व धातूच्या उंचसखल भागात गुंतून एक सलग पण थोडासा सच्छिद्र मुलामा तयार होतो. ही घटना आ. ५ मध्ये दाखविली आहे.
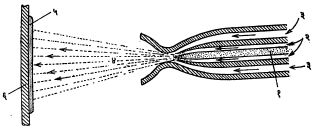
तार फवारणी यंत्रामध्ये हवेवर चालणाऱ्या टरबाइनाच्या साहाय्याने दोन रुळांचे लाटण यंत्र फिरविले जाते. त्या यंत्राने मुलाम्याच्या धातूची तार सतत पुढे ढकलली जाते. तिचा वेग ०·५ ते १५ मी./मि. पर्यंत ठेवता येतो. त्या तारेच्या भोवतीच ऑक्सि-ॲसिटिलिन किंवा ऑक्सि-प्रोपेन ज्योत ठेवली जाते. त्या ज्योतीने तार वितळल्याबरोबर तिच्यावर चहूबाजूंनी येणाऱ्या संपीडित (दाबाखालील) हवेच्या झोताचा मारा केला जातो. त्यामुळे तारेच्या धातुरसाचे असंख्य कणांत रूपांतर होऊन ते कण पुढे फेकले जाऊन वस्तूवर जोराने आपटतात. ऑक्सि-ॲसिटिलिनाचा दाब १ किग्रॅ./सेंमी. तर हवेच्या झोताचा दाब ४ किग्रॅ./सेंमी. असतो. ज्योतीने वितळू शकणाऱ्या व तारेच्या आकारात मिळणाऱ्या कुठल्याही धातू ह्या पद्धतीने वापरता येतात. सामान्यतः जस्त, शिसे, ॲल्युमिनियम, उच्च पोलाद, कथिल, तांबे, कासे, पितळ, बॅबिट, कॅडमियम, निकेल, मोनेल, अगंज पोलाद वगैरे धातू व मिश्रधातू वापरात आहेत. धातूच्या गुणधर्माप्रमाणे तारेची जाडी ठरवतात. उच्च वितळबिंदू असलेल्या धातूची बारीक तार वापरली, तर ती सुलभतेने वितळते. साधारणतः ३ ते ४·५ मिमी. व्यासाच्या तारा वापरतात. ही पद्धत आ. ६ मध्ये दाखविली आहे.
वायुज्योतीऐवजी विद्युत् प्रज्योत वापरल्यास उष्णतेचा वापर जास्त कार्यक्षमतेने होतो. असे यंत्र इकडे तिकडे नेण्यास सोपे होते व फवारण्याचा वेग ३ ते ५ पटींनी वाढविता येतो. द्रव धातूचे तापमानही वाढून मुलामा जास्त घट्ट होतो व पायिक धातूशी चांगला संलग्नही होतो. बहुतेक यंत्रांमध्ये मुलाम्याच्या धातूच्याच दोन तारांमध्ये प्रज्योत निर्माण केली जाते. जसजशी तारांची पुढची टोके वितळून फवारली जातात तसतशा दोन्ही तारा सारख्याच वेगाने पुढे ढकलल्या जाऊन प्रज्योत कायम राहते. फवारण्याचे काम मात्र वरच्याप्रमाणे संपीडित हवेच्या झोतानेच केले जाते.
धातूच्या फवाऱ्याने मुलामा देण्याच्या दुसऱ्या पद्धतीत यंत्राला धातुचूर्ण पुरविले जाते. १५ ते ७५ मायक्रॉन व्यासाचे कण असलेले चूर्ण संपीडित हवेच्या प्रवाहात शोषले जाते, चोषले (ओढून घेतले) जाते किंवा वरच्या नरसाळयात चूर्णाचा रस होतो आणि हवेच्या दाबाने व गुरुत्त्वाकर्षणाने त्यात मिसळते. ऑक्सि–ॲसिटिलिनाच्या किंवा तत्सम ज्योतीने चूर्ण वितळून त्या रसाचा फवारा धातुपृष्ठावर जोराने मारला जातो (आ.७) ही पद्धत फक्त नीच वितळबिंदू असलेल्या धातूंच्या बाबतीतच उपयोगी आहे. चूर्णाची किंमत तारेपेक्षा कमी असेल, तरच ही पद्धत किफायतशीर पडते. उदा., जस्ताच्या निष्कर्षणात (कच्च्या धातूपासून शुद्ध धातू मिळविताना) त्याचे थोडे चूर्णही तयार होते. त्याची किंमत तारेपेक्षा कमी असते. ते या पद्धतीत वापरता येते. ज्या धातू तारेच्या स्वरूपात मिळू शकत नाहीत, त्यांची फवारणी फक्त याच पद्धतीने होऊ शकते. तसेच दोन धातूंची चूर्ण मिसळून मुलाम्याची घटना बदलणेही शक्य होते. दुर्गलनीय (वितळण्यास कठीण असलेल्या) धातूचे चूर्ण नीच वितळबिंदू असलेल्या धातूच्या चूर्णात मिसळून फवारल्यास नीच वितळबिंदू असलेली धातू दुर्गलनीय धातूला मुलाम्यात सामावून घेते. उदा., निकेल-क्रोमियम-बोरॉन यांच्या मिश्रणात टंगस्टन कार्बाइड मिसळून फवारल्यास रॉकवेल सी ६० [ → कठिनता] किंवा त्याहीपेक्षा जास्त कठिनता असलेले मुलामे मिळू शकतात.
मुलाम्याची आवश्यक ती जाडी मिळविण्याकरिता एकापेक्षा जास्त थरही द्यावे लागतात. उदा.,जस्ताच्या एका फवारित थराची जाडी ०·५ मिमी. असते. एकूण जाडी १·२५ मिमी. पाहिजे असल्यास दोन किंवा तीन थर द्यावे लागतात.
बहुतेक सर्व फवारित मुलाम्यांत ऑक्साइडाचा थोडा अंश असतोच. शिवाय सूक्ष्म कण आपटून चपटे होण्यामुळे पृष्ठाचे थोडे कठिनीकरणही होते. त्यामुळे बऱ्यापैकी कठीण व झीजरोधक मुलामे तयार होतात परंतु त्यांतील सच्छिद्रतेमुळे ते काजळी वगैरे अडकून मलिन दिसतात. हे टाळण्याकरिता छिद्रे बुजवणारे तेल किंवा रंग लावणे आवश्यक असते. सच्छिद्रतेमुळे रंग चांगले धरून ठेवले जातात.
चूर्ण फवारित मुलामे वायुज्योतीने किंवा भट्टीत घालून १,०००° ते १,१००° से.पर्यंत तापवून वितळविले असता मुलाम्याची घनता, कठिनता, गुळगुळीतपणा आणि झीजरोध, ऑक्सिडीभवनरोध आणि गंजरोध हे गुण वाढतात.
फवारणी पद्धतीने इतर पद्धतींपेक्षा झटपट काम होते. विशाल पृष्ठेही सहजपणे आच्छदित करता येतात आणि फक्त थोड्याच पृष्ठभागावर जाड थर देण्याची सोय असते. प्रचंड आणि संपूर्ण तयार झालेल्या वस्तूंवर मुलामा देण्यासाठी फवारणी ही एकमेव पद्धत आहे उदा., पूल, मनोरे, जहाजे, साठवणाचे मोठमोठे हौद वगैरेंना दुसऱ्या कुठल्याही पद्धतीने मुलामे देणे अशक्य असते. जोडकाम संपूर्ण झाल्यावर मुलामा देण्यामुळे जोडकामामध्ये होणारी मुलाम्याची नासधूस टळते. जरी सुरूवातीला ही पद्धत रंगापेक्षा महाग वाटली, तरी दीर्घकालीन टिकाऊपणामुळे ती कालांतराने स्वस्त असल्याचे दिसून येते. उदा., १·३ ते २·५ मिमी. जाडीचा जस्ताचा मुलामा काहीही दुरूस्ती न करता १० वर्षे सहज टिकतो.
यंत्रांच्या झिजलेल्या भागांचे (उदा., मोटारींच्या भुजादंडांच्या धारव्यातील-बेअरिंगातील-झिजलेल्या भागांचे) पुनरुज्जीवन करण्यासाठी ही पद्धत फार उपयुक्त आहे. हे मुलामे सच्छिद्र असल्यामुळे त्यांत बरेच तेल राहू शकते व वंगणक्रिया नीट प्रकारे होऊ शकते. तसेच ह्या पद्धतीत वस्तूचे तापमान फारसे वाढत नसल्यामुळे वस्तू वाकण्याची शक्यता कमी असते. वितळावयाची धातू द्रव असताना फारच थोडा काळ पायिक धातूच्या संपर्कात असते व लगेच ती घन होते. त्यामुळे तापमान कमी राहते, पण मिश्रधातू तयार होत नाही. त्यामुळे फक्त एकमेकांत गुंतण्यामुळे व उंचसखल जागेत अडकल्यामुळे जी संलग्नता येईल तेवढीच. फवारण्यापूर्वी वस्तुपृष्ठ खडबडीत करून घेणे आवश्यक असते. हे काम वालुकाझोताने करतात. पृष्ठ कठीण असेल, तर त्यावर विद्युत्प्रज्योतीने धातूचे काही ठिपके चिकटवितात. म्हणजे फवारित मुलामा पृष्ठाला घट्ट धरून बसतो. फवारा यंत्र कुठेही सुलभपणे नेता येत असल्यामुळे मोठाल्या टाक्या, मनोरे, पोलादी पूल वगैरेंच्या भागावर जागेवरच फवारणी करता येते. झिजून मापे लहान झालेल्या यंत्रभागावर धातू फवारतात व त्याचे यंत्रण (घासणे, खरवडणे इ. क्रिया) केले की, ते पुन्हा वापरता येतात. चिमटयाचे आकडे, एंजिनाच्या निष्कास (ज्वलन झालेला इंधन वायू बाहेर टाकणाऱ्या) झडपा, मापन ठोकळे, गवत कापायच्या यंत्राची पाती, पंपाचे दट्टये आणि मळसूत्री वाहक यांची पृष्ठे झीजरोधी करण्याकरिता कठीण मुलामे याच पद्धतीने देतात. रासयनिक अभियांत्रिकीय उद्योगधंद्यात बऱ्याच ठिकाणी जस्त, शिसे, कथिल आणि ॲल्युमिनियम यांचे मुलामे याच पद्धतीने देतात.
संधानन पद्धती : उच्च तापमानास मुलाम्याच्या धातूंचे पायिक (वस्तूच्या) धातूंत विसरण (शिरवून केलेले मिश्रण) घडवून हे मुलामे तयार करतात. पायिक धातुपृष्ठावर मुलाम्याच्या धातूचे चूर्ण पसरून वा वस्तू धातुचूर्णात ठेवून खूप तापवतात. चूर्णाच्या सूक्ष्म कणांचे वस्तूच्या पृष्ठात विसरण होते. ह्यामुळे पृष्ठावर वेगवेगळ्या प्रमाणांतील मिश्रणांचे थर निर्माण होतात. पायिक धातूलगतचा थर आंतरधातवीय संयुग असू शकेल, घन विद्राव असू शकेल वा नुसतेच कणसीमांतर्गत विसरण झालेले असेल. बाह्य थर अर्थातच नुसत्याच मुलाम्याच्या धातूचा असतो. एकूण मुलाम्याची जाडी ही तापमान व प्रक्रियेचा कालखंड यांवर अवलंबून असते. नट, बोल्ट, स्क्रू असे आटे असलेले भाग, झडपा, मापन उपकरणे इत्यादींवर ह्या पद्धतीने मुलामे चढवणे सोयीचे जाते परंतु एक अट म्हणजे मुलाम्याची धातू वस्तूच्या धातूमध्ये शिरून मिश्रधातू करण्यास समर्थ असली पाहिजे. म्हणूनच लोखंडावर फक्त जस्त, ॲल्युमिनियम व क्रोमियम यांचे मुलामे ह्या पद्धतीने देता येतात. ह्या पद्धतीने जस्ताचा मुलामा देण्याच्या पद्धतीस शेरर्डायझिंग, ॲल्युमिनियमाचा मुलामा देण्याच्या पद्धतीस कॅलरायझिंग व क्रोमियम मुलामा देण्याच्या पद्धतीस क्रोमायझिंग असे म्हणतात.
शेरर्डायझिंगमध्ये पायिक धातुवस्तू एका पिंपात जस्ताच्या चूर्णाने वेष्टित करून तापवितात. जस्ताचे ऑक्सिडीभवन टाळण्यासाठी जस्ताचे चूर्ण घट्ट दाबून बसविलेले असते. हे पिंप ३१५° ते ३७०° से.पर्यंत तापविले जात असताना हळूहळू फिरविलेही जाते. त्यामुळे ३ ते १२ तासांत आपणास हवा त्या जाडीचा मुलामा तयार करता येतो. ही पद्धत नट, बोल्ट, धातूच्या खिडक्या, जहाजबांधणीतील पोलादी वस्तू इत्यादींकरिता वापरतात.
कॅलरायझिंगमध्ये वस्तू ॲल्युमिनियमाचे चूर्ण, ॲल्युमिनियम ऑक्साइड आणि ॲल्युमिनियम क्लोराइड यांच्या मिश्रणात ठेवून १,०००° से.पर्यंत तापवितात. तयार झालेल्या थराची घटना Al3Fe अशी असते, म्हणजेच त्यात सु. ७५% ॲल्युमिनियम असते. ही पद्धत मृदू व कार्बनाचे प्रमाण कमी असलेल्या पोलादाचा ऑक्सिडीकरणरोध वाढविण्यासाठी उपयोगात आणतात.
क्रोमायझिंगकरिता ५५% क्रोमियम आणि ४५% ॲल्युमिनियम ऑक्साइड यांच्या मिश्रणात वस्तू ठेवून तापवतात. तापमान १,३००° ते १,४००° से. व कालखंड ३ ते ४ तास ठेवतात. क्रोमियमाच्या चूर्णाचे कण एकमेकांस चिकटू नये म्हणून ॲल्युमिनियम ऑक्साइडाची योजना केलेली असते. ही पद्धत पायिक धातूची कठिनता व गंधरोध वाढविण्यासाठी वापरतात.
क्रोमायझिंगच्या दुसऱ्या पद्धतीत वायुरूप क्रोमस क्लोराइड आणि हायड्रोजन यांची पोलादाशी अन्योन्य विक्रिया घडवून आणतात. ह्या पद्धतीत क्रोमियमाचे विसरण जास्त वेगाने व कमी तापमानाला (१,०५०° से.) होते. या पद्धतीत क्रोमियम खालील विक्रियांनुसार तयार होते असे मानले जाते.
|
Fe लोह |
+ |
CrCl2 क्रोमस क्लोराइड |
⇌ |
FeCl2 फेरस क्लोराइड |
+ |
Cr (स्थानांतर) क्रोमियम |
|
CrCl2 क्रोमस क्लोराइड |
+ |
H2 हायड्रोजन |
⇌ |
Cr क्रोमियम |
+ |
2HCl हाड्रोक्लोरिक अम्ल (क्षपण) |
|
CrCl2 क्रोमस क्लोराइड |
⇌ |
Cr क्रोमियम |
+ |
Cl2 क्लोरीन |
(उष्णतेचे विघटन) |
|
या मुलाम्यात पोलादाच्या पृष्ठभागावर १० ते २०% क्रोमियम घन विद्रावाच्या स्वरूपात उपस्थित असते आणि त्यामुळे या मुलाम्याचा गंजरोध फेरिटिक अगंज पोलादाइतकाच असतो. मॉलिब्डेनम धातूचे उच्च तापमानास ऑक्सिडीकरण होऊ नये म्हणून तिच्यावर सिलिकॉन या धातूचा मुलामा देतात. त्याला सिलिकॉनायझिंग म्हणतात. सिलिकॉन टेट्राल्कोराइडाचे मॉलिब्डेनमाच्या पृष्ठभागावरच क्षपण केल्यास नव्यानेच तयार झालेल्या सिलिकॉनाचे सहजगत्या मॉलिब्डेनमामध्ये विसरण होते व मुलामा तयार होतो.
आयनद्रायु-विद्युत् प्रज्योत फवारा : उच्च तापमानामुळे अतिशय उच्च आयनीभवन (विद्युत् भारित अणू वा अणुगटांत रूपांतर) झालेल्या आणि ज्यात इलेक्ट्रॉन व धन आयन यांचे प्रमाण जवळजवळ सारखे आहे, अशा वायूस आयनद्रायू असे म्हणतात. एखाद्या पेटीत विद्युत् प्रज्योत निर्माण करून तीमध्ये संपीडित वायू सोडतात. विद्युत् प्रज्योतीमुळे वायूचे आयनद्रायूमध्ये रूपांतर होते आणि तो अत्यंत तप्त व तेजस्वी स्वरूपात धनाग्राच्या मध्यभागी मुद्दाम ठेवलेल्या भोकांतून बाहेर येतो.
आयनद्रायू झोतामध्ये १७,०००° से.पर्यंत तापमान मिळू शकते व त्यामुळे कुठल्याही पदार्थाचा (धातू, कार्बाइड, नायट्राइड, सेरमेटे-धातू व मृत्तिका यांचे अतिशय समांगी मिश्रण-काच, प्लॅस्टिके इ.) मुलामा देणे शक्य झाले आहे. विशेषेकरून तापरोधक मृदीय पदार्थांचा उपयोग करणे शक्य झाले आहे व टंगस्टन, टॅंटॅलम, मॉलिब्डेनम आणि हीनियम यांसंबंधी प्रयोग चालू आहेत.
जिचा मुलामा द्यायचा आहे ती धातू चूर्णरूपात आयनद्रायूच्या झोतात सोडली जाते. जरी त्या झोताचे तापमान उच्च असले, तरी झोताकडून चूर्णास उष्णता मिळण्यास थोडा वेळ मिळतो. त्यामुळे त्या थोड्या वेळात धातूचे द्रवीकरण होण्यास चूर्ण बारीक असावे लागते व झोतातील उष्णता वाढवावी लागते. आयनद्रायू करण्यास हायड्रोजन वायू सर्वांत चांगला असून त्याखालोखाल हीलियम, हवा, नायट्रोजन आणि आर्गॉन असा क्रम लागतो. जेव्हा हायड्रोजन वापरला जातो तेव्हा मुलाम्यात ऑक्सिजनाचे मिश्रण होण्याचे प्रमाण कमी राहते. मुलाम्याचे आणि त्याखालील धातूचे तापमान एका विशिष्ट मर्यादेपलीकडे जाऊ नये म्हणून वस्तूचे ज्योतीपासून अंतर वाढविणे, ज्योत भरभर पुढे नेणे वा थंड वाऱ्याने तापमान नियंत्रित ठेवणे हे उपाय योजतात.
घूर्णकाच्या पात्यांवरील (टरबाइनाच्या पात्यांवरील) मॉलिब्डेनमाचा मुलामा व रॉकेटामधील ग्रॅफाइटाच्या तोट्यांवरील टंगस्टनाचा मुलामा ही आयनद्रायू पद्धतीच्या उपयोगाची काही उदाहरणे होत.
ज्योत विलेपन : या पद्धतीत धातूचे चूर्ण ऑक्सिजन आणि ॲसिटिलिनामध्ये मिसळून एका बंदुकीच्या नळीत त्यांचा स्फोट करतात. ह्या उष्णतेने धातुकण बिलबिलीत होऊन आवाजापेक्षा अधिक वेगाने नळीतून बाहेर येतात व ते धातुपृष्ठाकडे फेकले जातात. या कणांच्या अतिशय जोराने धातुपृष्ठावर आदळण्यामुळे १% कमी सच्छिद्रता असलेला मुलामा तयार होतो.
निकेल किंवा कोबाल्टबंधित टंगस्टन कार्बाइडाचे थर चढवण्याकरिता व विमानातील काही झडपा, मासे पकडायच्या सामग्रीतील रिळे, घूर्णक यंत्राची भोके बंद करायच्या चकत्या, धातूचे साचे, शिवणयंत्रांचे भाग वगैरे वस्तूंवर मुलामा बसविण्यासाठी या पद्धतीचा वापर होतो.
निर्वात विलेपन : धातूचे बाष्प तयार करून ते हवे तेथे पुन्हा सघन स्वरूपात आणून हे मुलामे तयार करतात. यासाठी १०-३ ते १०-५ टॉर दाब असलेला निर्वात वापरावा लागतो. सर्व धातू, मिश्रधातू व अर्धसंवाहक (धातू व निरोधक यांच्या दरम्यान ज्यांची विद्युत् संवाहकता आहे अशी द्रव्ये) या पद्धतीने निक्षेपित करता येतात (बसविता येतात) सहज निक्षेपित होणाऱ्या धातू म्हणजे ॲल्युमिनियम, कॅडमियम, क्रोमियम, तांबे, जर्मेनियम, सिलिनियम, जस्त वगैरे. टंगस्टन, टॅंटॅलम आणि प्लॅटिनम इलेक्ट्रॉन शलाकेने तापवाव्या लागतात. कागद, प्लॅस्टिक, काच एवढेच नव्हे तर कापडावरही या पद्धतीने मुलामा देता येतो व तसेच ॲल्युमिनियमाचे भाग, परावर्तक व गाळणे यांवरील प्रकाशीय मुलामे, हायड्रोजनजन्य ठिसूळपणा येऊ नये म्हणून विमानातल्या ॲल्युमिनियमाच्या भागांवरचे कॅडमियमाचे मुलामे याच पद्धतीने चढवतात. सूक्ष्म इलेक्ट्रॉनीय मंडलांसाठीही तिचा वाढत्या प्रमाणावर उपयोग होत आहे.
तडतडविणे : निर्वात जागेत ठेवलेल्या ऋणाग्र आणि धनाग्र यांमधून ३,००० ते ५,००० व्होल्ट दाबाचा विद्युत्प्रवाह पाठविल्यास ऋणाग्र तडतडू लागते. या पद्धतीत मुलाम्याची धातू ऋणाग्र म्हणून ठेवतात. धन भारित आयनांच्या माऱ्यामुळे ऋणाग्रपृष्ठाचे बाष्प होऊ लागते. ते उडून वस्तुपृष्ठावर जाऊन बसते व तेथे मुलामा तयार होतो. विद्युत् प्रवाह चालू राहण्यास १०-१ ते १०-२ टॉर पर्यंतच्या दाबाचा निर्वात ठेवावा लागतो. ऋणाग्र व धनाग्र ठेवलेल्या जागेत आरगॉन भरलेला असतो.
मॉलिब्डेनम, टंगस्टन व टँटॅलम यांच्याकरिता ही पद्धत योग्य आहे. ही पद्धत मोठी आणि सूक्ष्म इलेक्ट्रॉनीय मंडले तयार करण्याकरिताही उपयुक्त आहे.
आयन विलेपन : ह्या पद्धतीत जिच्यावर मुलामा द्यायचा आहे, ती वस्तू ऋणाग्री ठेवतात आणि मुलाम्याची धातू धनाग्री ठेवतात. पेटी बंद करून निर्वात करतात व तेथे १०-२ ते ५ x१०-२ टॉर दाब होईल इतक्या बेताने आर्गॉन भरतात. ३,००० ते ५,००० व्होल्ट दाबाला वायूमधून इलेक्ट्रॉन प्रवाह सुरू झाला की, आर्गॉनाचे आयन ऋणाग्रावर आपटून पृष्ठावरील मलद्रव्ये उडवून लावतात. मग धनाग्र तापवितात त्यामुळे त्याचे प्रथम द्रवीभवन व मग बाष्पीभवन होते आणि ते अणू व आयन जोराने ऋणाग्रावर येऊन आपटतात व तेथेच एक मुलामा तयार करतात. उच्च वेगाने येणारे आयन धातुपृष्ठात खोलवर रुतून बसल्यामुळे मुलामा धातुपृष्ठाशी उत्तम रीतीने संलग्न होतो.जेथे दुसरी कुठलीही पद्धत लागू पडत नाही तेथे ही पद्धत वापरता येते उदा., युरेनियमापासून केलेल्या अणुभट्टीच्या काही भागांवर ॲल्युमिनियमाचा मुलामा किंवा काही मृत्तिका वस्तूंवर धातूंचे मुलामे ह्या पद्धतीने देतात.
जागेवरच भाजून केलेले मुलामे : मुख्यत्वे सोने, प्लॅटिनम व पॅलॅडियम या धातूंचे मुलामे चिनी माती व काचेची भांडी सुशोभित करण्याकरिता वापरतात. या धातूंची कार्बनी संयुगे कार्बनी विद्रावकांत विरघळवून ती वस्तूवर लावतात. मग ती वस्तू वाळवून २५०° ते ८००° से.पर्यंत तापवितात. कार्बनी द्रव्य उडून जाते व ०·२५ मायक्रॉन जाडीचा मुलामा मागे राहतो. उन्हापासून किंवा वितळजोडकामाच्या ज्योती किंवा प्रज्योतीपासून डोळ्यांचे संरक्षण करणाऱ्या चष्म्याच्या काचांवर मुलामे द्यावे लागतात. ते याच पद्धतीने दिले जातात.
यांत्रिक मुलामे : एका पिंपामध्ये धातूच्या वस्तू, मुलाम्याच्या धातूचे चूर्ण व काचेचे जरा भरड चूर्ण टाकतात. शिवाय पाणी आणि दुसरेही एखादे रसायन टाकतात. पिंप फिरविल्यावर मुलाम्याच्या धातूचे कण वस्तूच्या धातूच्या पृष्ठावर चिकटतात आणि त्यांच्यावर काचेचे कण आपटतात. ह्या क्रियेमुळे मुलाम्याच्या धातूच्या कणांची पातळ पाने (वर्ख) तयार होऊन ती वस्तूला चिकटून बसतात व मुलामा तयार होतो. ह्या पद्धतीत मुलाम्याची धातू खूप मऊ असली पाहिजे, तरच ती चापट होते आणि चिकटते. उदा., कॅडमियम, जस्त, कथिल, शिसे, पितळ वगैरे.
पहा : कथिलाच्छादित पत्रे गंजणे गॅलव्हानीकरण विद्युत् विलेपन.
संदर्भ: 1. Burns, R. M. Bradley, W. W. Protective Coatings for Metals, New York, 1955.
2. Jastrzebski, Z. D. Nature and Properties of Engineering Material, New York, 1959.
3. Lyman, T., Ed. Metals Handbook, Vol. 2, Novelty, Ohio 1964.
4. Uhlig, H. H. Corrosion Handbook, New York, 1958.
गोखले, अ. अ.
“