धातुमळी : (स्लॅग). धातुकाचे (कच्च्या स्वरूपातील धातूचे) प्रगलन करून (वितळवून) शुद्ध धातूचा रस तयार करताना वापरण्यात येणारे अभिवाह (धातुक लवकर व कमी तापमानाला वितळावे म्हणून त्यात मिसळण्यात येणारी द्रव्ये) आणि धातुकातील अधातवी खनिजे यांमधील रासायनिक विक्रियेने तयार होणारे, धातुरसावर तरंगणारे जाडसर मिश्रण भट्टित प्रगलन प्रक्रिया सुरू झाल्यावर अधातवी खनिजे आणि कोळशाची राख यांचे मिश्रण होऊन काही मलद्रव्ये उत्पन्न होतात. त्यांमध्ये उच्च वितळबिंदू असलेली ऑक्साइडे आणि सिलिकेटे असतात. या द्रव्यांचे रस तयार होण्यासाठी मुख्य धातूच्या वितळबिंदूपेक्षा अधिक तापमान लागते. त्यामुळे जास्त इंधन जाळावे लागते आणि भट्टीमधील उच्चतापसह (उच्च तापमानाला न वितळणाऱ्या) विटांचा ऱ्हास होतो. अभिवाहाचा वापर केला, तर मलद्रव्यांचा वितळबिंदू खाली येतो आणि चांगली पातळ मळी तयार होते. अनुकूल अभिवाहाची निवड करून धातुमळीच्या रासायनिक संघटनावर नियंत्रण ठेवता येते, तिला अधिक क्रियाशील बनविता येते व तिचा वितळबिंदू खाली आणता येतो. तसेच तिची घनता कमी होते आणि तिच्यात अनेक ऑक्साइडांना व बहुतेक मलखनिजांना शोषून घेण्याचे सामर्थ्य आणता येते. त्यामुळे धातूचे शुद्धीकरण करणे सोपे जाते.
भट्टीत धातूचा रस तयार होऊन तळाशी साठू लागला म्हणजे धातुमळीचा पातळ थर धातूपासून अगदी अलग होऊन सायीप्रमाणे धातुरसावर तरंगतो. त्यामुळे भट्टीच्या वरच्या भागात असलेले तप्त वायू आणि त्यांमधील गंधकी संयुगे यांपासून खालच्या धातुरसाचे संरक्षण होते. भट्टीमध्ये चालू असलेल्या प्रगलन प्रक्रियेचे नियंत्रण करण्यासाठी आणि धातुरसाची गुणवत्ता सुधारण्यासाठी धातुमळीचे नियंत्रण करावे लागते.
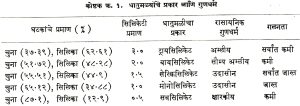
प्रकार : क्षारकीय (अम्लांशी विक्रिया झाल्यास लवणे देणारे पदार्थ, बेसिक) आणि अम्लीय खनिजांपासून धातुमळी तयार होत असली, तरी ती रासायनिक दृष्टीने अगदी उदासीन नसते. चुन्यासारखे क्षारकीय खनिज सिलिकेसारख्या अम्लीय खनिजाशी वेगवेगळ्या प्रमाणात मिसळून कित्येक प्रकारची कॅल्शियम सिलिकेटे उत्पन्न होऊ शकतात. चुना जास्त प्रमाणात असला, तर धातुमळी क्षारकीय हीते आणि सिलिका जास्त असली, तर ती अम्लीय होते. धातुमळ्यांची वर्गवारी करण्यासाठी त्यांच्यातील सिलिकेटांच्या प्रमाणाचा उपयोग करतात.
![]() चुना आणि सिलिका यांच्या निरनिराळ्या प्रमाणातील संयोगामुळे उत्पन्न होणाऱ्या पाच प्रकारच्या धातुमळ्यांचे वर्णन कोष्टक क्र. १ मध्ये दिले आहे.
चुना आणि सिलिका यांच्या निरनिराळ्या प्रमाणातील संयोगामुळे उत्पन्न होणाऱ्या पाच प्रकारच्या धातुमळ्यांचे वर्णन कोष्टक क्र. १ मध्ये दिले आहे.
 सिलिका अम्लीय असते, ॲल्युमिना उभयधर्मी असते. ॲल्युमिना धातुमळीत किती टक्के आहे यावर ती कोणत्या रासायनिक गुणधर्माची आहे, हे अवलंबून असते. जेव्हा धातुमळीत ॲल्युमिना १५% पेक्षा कमी असते तेव्हा ती अम्लीय, १५ ते १८% च्या दरम्यान असते तेव्हा उदासीन संयुगाप्रमाणे व १८% पेक्षा जास्त असते तेव्हा क्षारकीय असते. चुना क्षारकीय आहे. त्याचप्रमाणे इतर काही घटक क्षारकीय असू शकतात. म्हणून धातुमळी एकधर्मी किंवा उभयधर्मी असू शकते. धातुमळ्यांचे मुख्य घटक कॅल्शियम सिलिकेट, मॅग्नेशियम सिलिकेट, लोह सिलिकेट व कॅल्शियम ॲल्युमिनेट असे असतात. पोलाद तयार करताना फॉस्फरस कॅल्शियम फॉस्फेटाच्या रूपाने धातुमळीमध्ये जाते. साध्या परिवर्तकामध्ये (उच्चतापसह विटांच्या अस्तराच्या लोखंडी भट्टीमध्ये) तांबे गाळताना आणि अम्लीय परिवर्तकात पोलाद तयार करताना लोह सिलिकेटाची मळी तयार होते.
सिलिका अम्लीय असते, ॲल्युमिना उभयधर्मी असते. ॲल्युमिना धातुमळीत किती टक्के आहे यावर ती कोणत्या रासायनिक गुणधर्माची आहे, हे अवलंबून असते. जेव्हा धातुमळीत ॲल्युमिना १५% पेक्षा कमी असते तेव्हा ती अम्लीय, १५ ते १८% च्या दरम्यान असते तेव्हा उदासीन संयुगाप्रमाणे व १८% पेक्षा जास्त असते तेव्हा क्षारकीय असते. चुना क्षारकीय आहे. त्याचप्रमाणे इतर काही घटक क्षारकीय असू शकतात. म्हणून धातुमळी एकधर्मी किंवा उभयधर्मी असू शकते. धातुमळ्यांचे मुख्य घटक कॅल्शियम सिलिकेट, मॅग्नेशियम सिलिकेट, लोह सिलिकेट व कॅल्शियम ॲल्युमिनेट असे असतात. पोलाद तयार करताना फॉस्फरस कॅल्शियम फॉस्फेटाच्या रूपाने धातुमळीमध्ये जाते. साध्या परिवर्तकामध्ये (उच्चतापसह विटांच्या अस्तराच्या लोखंडी भट्टीमध्ये) तांबे गाळताना आणि अम्लीय परिवर्तकात पोलाद तयार करताना लोह सिलिकेटाची मळी तयार होते.
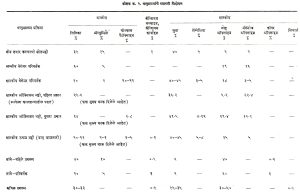
निरनिराळ्या धातुप्रगलन प्रक्रियांत उत्पन्न होणाऱ्या धातुमळ्यांचे विश्लेषण कोष्टक क्र. २ मध्ये दिले आहे.
 प्रगलन प्रक्रियेतील पहिल्या धातुमळीत शक्य तितकी कमी धातू जाऊ दिली, तर ती मळी वर्ज्य करतात. नंतरची मळी धातुविशोधक असल्याने तिच्यात धातूचे प्रमाण जास्त असण्याची शक्यता असते. जर मळीत धातूचे प्रमाण जास्त असले, तर ती मळी वर्ज्य न करता पुन्हा झोतभट्टीत टाकली जाते व मळीचे बरोबर नियंत्रण करून भट्टीबाहेर काढलेल्या मळीत जर जास्त प्रमाणात धातू गेलेली नसेल, तर ती चांगल्या प्रकारची मळी समजली जाते. अशा प्रकारच्या मळीमुळे धातूच्या उत्पादनात घट होत नाही.
प्रगलन प्रक्रियेतील पहिल्या धातुमळीत शक्य तितकी कमी धातू जाऊ दिली, तर ती मळी वर्ज्य करतात. नंतरची मळी धातुविशोधक असल्याने तिच्यात धातूचे प्रमाण जास्त असण्याची शक्यता असते. जर मळीत धातूचे प्रमाण जास्त असले, तर ती मळी वर्ज्य न करता पुन्हा झोतभट्टीत टाकली जाते व मळीचे बरोबर नियंत्रण करून भट्टीबाहेर काढलेल्या मळीत जर जास्त प्रमाणात धातू गेलेली नसेल, तर ती चांगल्या प्रकारची मळी समजली जाते. अशा प्रकारच्या मळीमुळे धातूच्या उत्पादनात घट होत नाही.
उपयोग : धातुमळी ही प्रगलन प्रक्रियेतील उपफल म्हणून जरी उत्पन्न होत असली, तरी तिचा इतर कित्येक कामांसाठी चांगला उपयोग होतो. याची काही उदाहरणे पुढीलप्रमाणे आहेत. (१) पोलाद तयार करावयाच्या कारखान्यात उत्पन्न होणाऱ्या मळीपासून सिमेंट तयार करता येते. (२) धातुमळी उष्णतानिरोधक असते. वाफेच्या किंवा संपीडित (दाबयुक्त) हवेच्या मदतीने मळीपासून बारीक धागे (स्लॅग वुल) तयार करतात व या धाग्यांचा उपयोग करून चांगले मजबूत आणि उष्णतानिरोधक फलक तयार करतात. (३) धातुमळीमध्ये फॉस्फरसाचे प्रमाण जास्त असले, तर त्या मळीच्या चूर्णाचा खत म्हणून उपयोग करता येतो. (४) पक्के रस्ते आणि रूळमार्गांसाठी खडीऐवजी धातुमळीचे खडे वापरता येतात. (५) सिमेंट काँक्रीटचे बांधकाम करताना काँक्रीटमध्ये भर घालण्यासाठी धातुमळीच्या खडीचा उपयोग करता येतो.
आळतेकर, वि. अ.