डायाझोटीकरण : ॲरोमॅटिक प्राथमिक अमाइनांपासून [⟶ ॲरोमॅटिक संयुगे] ⇨ डायाझो संयुगे बनविण्याची प्रक्रिया. सामान्यतः या प्रक्रियेकरिता बनविलेल्या विक्रिया-मिश्रणात वापरलेल्या सोडियम नायट्रॉइटापासून जे नायट्रस अम्ल तयार होते, त्याच्या विक्रियेने कमी तापमानास ही घडवून आणतात. उदा.,
C6H5NH2 + HNO2 + HCl ⟶ C6H5N2Cl + 2 H2Oॲनिलीन नायट्रस अम्ल हायड्रोक्लोरिक अम्ल बेंझीन डायाझोनियम क्लोराइड पाणी
ॲझो रंजकद्रव्ये [⟶ ॲझो संयुगे रंजक व रंजकद्रव्ये] बनविण्यासाठी हिचा उपयोग होत असल्यामुळे औद्योगिक दृष्टीने या प्रक्रियेला विशेष महत्त्व आहे. त्याचप्रमाणे कित्येक कार्बनी संयुगांच्या संश्लेषणात (मूलद्रव्यांपासून किंवा साध्या संयुगापासून रासायनिक विक्रियेने एखादे संयुग बनविण्यात) ही उपयोगी पडते. पीटर ग्राइस यांनी १८५८ मध्ये ही प्रक्रिया शोधून काढली.
सामान्य प्रक्रिया : सामान्य परिपाठाप्रमाणे इष्ट प्राथमिक अमाइन विरल हायड्रोक्लोरिक अम्लात (एक रेणू अमाइनास सु. तीन रेणू हायड्रोक्लोरिक अम्ल) विरघळवून विद्राव ०° से. तापमानाइतका थंड करतात व त्यात सोडियम नायट्रॉइटाचा विरल विद्राव (एका अमाइनाच्या रेणूस एक नायट्रॉइट रेणू) मिश्रण ढवळले जात असता हळूहळू सोडतात. विक्रिया पूर्णपणे होण्यासाठी मिश्रणाचे तापमान ०° ते ५° से. च्या दरम्यान राखावे लागते. त्याचप्रमाणे मिश्रण अम्लधर्मी आहे आणि त्यामध्ये सोडियम नायट्राइट व हायड्रोक्लोरिक अम्ल यांपासून बनलेले नायट्रस अम्ल अतिरिक्त आहे हे जाणण्यासाठी काँगो रेड कागद (काँगो रेड या नावाने ओळखण्यात येणाऱ्या रंजकद्रव्याच्या जलीय विद्रावात बुडविलेला कागद) व स्टार्च आयोडाइड कागद यांचे रंग निळे होत आहेत, याची शेवटपर्यंत खात्री करून घ्यावी लागते. विक्रिया त्वरेने घडते आणि अमाइनाचे डायाझोनियम क्लोराइड बनते. ॲनिलीन, टोल्यूइडिने, झायलिडिने व क्लोरोॲनिलिने यांचे डायाझोटीकरण या पद्धतीने घडविता येते.
विक्रिया-मिश्रण अम्लधर्मी नसेल, तर डायाझोटीकरण होऊन बनलेले डायाझोनियम लवण आणि उरलेले अमाइन यांचे संयुग्मीकरण [⟶ डायाझो संयुगे] होण्याचा संभाव असतो.
डायाझोनियम लवणे अस्थिर असल्यामुळे तापमान सु. १०° से.वर गेले, तर ती विघटन पावतात. हे विघटन होऊ नये म्हणूनच तापमान ०°–५° से. दरम्यान ठेवावे लागते. प्रक्रियेतील फेरफार : नायट्रो ॲनिलिने, ट्रॉयहॅलोजनो ॲनिलिने यांसारख्या दुर्बल क्षारकांवर (अम्लाशी विक्रिया झाल्यास लवणे देणाऱ्या पदार्थांवर) ही विक्रिया होण्यासाठी प्रथम कोमट व संहत (विद्रावातील प्रमाण जास्त असलेले) हायड्रोक्लोरिक अम्ल वापरून त्यांचे हायड्रोक्लोराइड बनवावे लागते. नंतर त्याचा विद्राव ०º से. इतका थंड करून ढवळणे चालू असताना त्यात सोडियम नायट्रॉइटाचा विद्राव त्वरेने ओतला म्हणजे कार्यभाग साधतो. सल्फानिलिक अम्लावर ही विक्रिया करण्यासाठी ते प्रथम क्षारामध्ये (अल्कलीमध्ये) विरघळवितात. नंतर त्यात हायड्रोक्लोरिक अम्ल मिसळले म्हणजे सूक्ष्मकणी सल्फानिलिक अम्ल वेगळे होते त्यावर डायाझोटीकरण प्रक्रिया घडविता येते किंवा सोडियम सल्फानिलेट व आवश्यक त्या प्रमाणात सोडियम नायट्राइट यांचे मिश्रण पाण्यात विरघळवून तो जलीय विद्राव हायड्रोक्लोरिक अम्लात तापमान ०°–५° से. असताना सोडतात. ही पर्यायी पद्धत मेटानिलिक अम्ल, नॅप्थायॉनिक अम्ल, क्लोरोॲनिलीन सल्फॉनिक अम्ल इत्यादींसाठी त्याचप्रमाणे ज्यांच्या संरचनेत (रेणूमधील अणूंच्या मांडणीत) दोन नायट्रो गट आहेत अशा आणि ज्यांची दोन्ही ऑर्थो स्थाने (बेंझीन वलयातील १ व २ ही स्थाने) प्रतिष्ठापित (या जागच्या हायड्रोजनांऐवजी तेथे दुसरे अणुगट जोडले गेले असलेली) आहेत, अशा अमाइनांसाठी उपयुक्त ठरते. २, ४ – डायनायट्रो ॲनिलीन ३, ५ – डायक्लोरो ॲमिनो फिनिल आर्सेनिक अम्ल २, ६– डायक्लोरो, ४ – नायट्रो ॲनिलीन यांसारख्या क्षीण क्षारकीय आणि अविद्राव्य (न विरघळणाऱ्या) अमाइनांसाठी एक विशेष तऱ्हेची योजना वापरतात. तीमध्ये पोटॅशियम मेटा-बायसल्फाइटमिश्रित संहत नायट्रिक अम्लात इष्ट अमाइन मिसळतात. मेटा-बायसल्फाइटाने नायट्रिक अम्लाच्या काही अंशाचे ⇨ क्षपण होऊन नायट्रस अम्ल बनते व त्याने अशा अमाइनांचे डायाझोटीकरण घडून येते.
नायट्रिक अम्लापासून स्टार्च किंवा आर्सेनिक अम्ल यांच्या विक्रियेने नायट्रोजन सेस्क्वी ऑक्साइड N2O3 बनविता येते. त्याचा उपयोग करूनही डायाझोटीकरण प्रक्रिया घडविण्याची एक पद्धत आहे. विक्रियामिश्रणांत विक्रियेनंतर अल्कोहॉल व ईथर घातले, तर डायाझोनियम लवण घनरूपात वेगळे करता येते, हे या प्रक्रियेचे वैशिष्ट्य आहे. सोडियम नायट्राइटाऐवजी अल्किल नायट्राइट (उदा., ॲमिल नायट्राइट) वापरून अल्कोहॉली विद्रावात डायाझोटीकरण करण्याची एक प्रक्रिया आहे. ती पाण्यात न विरघळणाऱ्या अमाइनासाठी सोयीची आहे. विक्रीयेनंतर अल्कोहॉली विद्रावात ईथर मिसळले, तर डायाझोनियम लवण घनरूपात वेगळेही करता येते.
प्राथमिक डाय-अमाइनामध्ये दोन ॲमिनो गट वेगवेगळ्या वलयांत असतील, तर दोन्हींवर विक्रिया होऊन टेट्राझोनियम लवणे बनू शकतात उदा., बेंझिडीन.
H2N – C6H4 – C6H4 – NH2 ⟶
बेंझिडीन
Cl –N = N – C6H4 – C6H4–N = N – Cl बेंझिडीन टेट्राझोनियम क्लोराइड
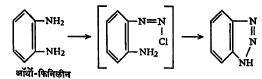
तथापि दोन ॲमिनो गट जर एकाच वलयाला जोडलेले असतील, तर त्यांच्या स्थानपरत्वे डायाझोटीकरण विक्रिया वेगवेगळ्या प्रकारे होते. उदा., मेटा-फिनिलीन डाय अमाइनाच्या दोन्ही ॲमिनो गटांचे डायाझोटीकरण होते, पण ते संपूर्ण होत नाही. जो अमाइनाचा अंश विक्रिया न होता राहिलेला असतो, त्याच्याशी या टेट्राझोटीकरण झालेल्या अंशाचे संयुग्मीकरण होऊन ॲझो रंजकरूपाने तो वेगळा होतो. पॅरा-फिनिलीन डाय-अमाइनापासून डायझोनियम व टेट्राझोनियम ह्या दोन्ही अनुजातांचे (एका संयुगापासून मिळविण्यात येणाऱ्या दुसऱ्या संयुगांचे) मिश्रण मिळते. ओर्थो-फिनिलीन डाय-अमाइनाच्या एका ॲमिनो गटाचे डायाझोटीकरण प्रथम होते व ते झाल्यावर जे संयुग बनते, त्यातील डायाझोनियम गटाची शेजारच्या ॲमिनो गटाशी विक्रिया होऊन वलयीकरणाने ॲझिमिनोबेंझीन बनते.
संदर्भ : 1. Riegel, E. R. Industrial Chemistry, Bombay, 1959.
2. Saunders, K. H. Aromatic Diazo Compounds and their Technical Applications, London, 1949.
दीक्षित, व. चिं.
“
आपल्या मित्रपरिवारात शेअर करा..
