झिर्कोनियम : धातुरूप मूलद्रव्य, रासायनिक चिन्ह Zr. अणुक्रमांक (अणुकेंद्रातील प्रोटॉनांची संख्या) ४० अणूभार ९१·२२ नैसर्गिक समस्थानिकांचे (अणुक्रमांक तोच पण भिन्न अणुभार असलेल्या त्याच मूलद्रव्याच्या प्रकारांचे) अणुभार ९०, ९१, ९२, ९४ व ९६ आवर्त सारणीमधील (इलेक्ट्रॉन रचनेनुसार केलेल्या मूलद्रव्यांच्या कोष्टकरूप मांडणीतील) चौथ्या गटाच्या ब विभागात स्थान शुद्ध स्थितीत धातूची तार काढता येते, परंतु अशुद्धी असल्यास ठिसूळ झळाळी चांगली वर्ण चांदीसारखा पांढरा, घनता ६·४९ ग्रॅ./ सेंमी.३ (तापमान २०°से. असताना) वितळबिंदू १,८५०°से. उकळबिंदू ३,५८०°से. ८६२° से. च्या खाली स्फटिकरचना षट्कोणी (आल्फा प्रकारची) व त्याच्या वर तापमान असल्यास शरीरकेंद्रित समघनी (बीटा प्रकाराची) [⟶ स्फटिकविज्ञान] विद्युत् रोधकता तांब्याच्या २५ पट व नायक्रोम धातूच्या निम्मी उच्च तापमानास अतिशय क्रियाशील कठिनता ३ [मोस मापक्रमानुसार ⟶ कठिनता] संयुजा (इतर अणूंशी संयोग पावण्याची क्षमता दर्शविणारा अंक ४).
इतिहास : १७८९ साली झिर्कॉन (ZrSiO4) नावाच्या धातुकापासून (कच्च्या स्वरूपातील धातूपासून) एम्. एच्. क्लापरोट यांनी झिर्कोनिया (ZrO2) नावाची नवी माती निराळी केली व तीतील झिर्कोनियम हे मूलद्रव्यही ओळखले. पुढे १८२४ मध्ये जे.जे. बर्झीलियस यांनी अशुद्ध स्वरूपात झिर्कोनियम धातू मिळविली . त्यांनी K2ZrF6 हे धातुक पोटॅशियम, सोडियम वा ॲल्युमिनियम यांच्या बरोबर तापवून ही धातू मिळविली. १९२५–३० या काळात ए. ई. व्हॅन आर्केल आणि जे. एच्. द बोअर यांनी टंगस्टनाची तार झिर्कोनियम आयोडाइडाच्या वाफेत तापवून शुद्ध धातू मिळविली. १९४५ च्या सुमारास डब्ल्यू. जे. क्रोल यांनी ही धातू मिळविण्याची एक अधिक स्वस्त पद्धत शोधून काढली. अणुकेंद्रीय विक्रियकात (अणुभट्टीमध्ये) या धातूचा होणारा उपयोग १९५० च्या सुमारास कळून आल्यानंतर या धातूचे महत्त्व वाढले.
उपस्थिती : झिर्कोनियम मूलद्रव्य भूपृष्ठावर बऱ्याच प्रमाणात सर्वत्र विखुरलेले आढळते. ते क्रियाशील असल्यामुळे नेहमी संयुक्तावस्थेत आढळते. झिर्कॉन (ZrSiO4) व बादेलेयाइट (ZrO2) ही याची महत्त्वाची धातुके होत. पुष्कळदा झिर्कोनियम आणि टिटॅनियम हे एकत्र आढळतात. टिटॅनियमाच्या उत्पादनाबरोबर झिर्कोनियमाचे उत्पादनही वाढले आहे. झिर्कोनियमाच्या धातुकांत ०·५ ते ५ टक्क्यांपर्यंत हाफनियम हे मूलद्रव्यही आढळते. झिंक ब्लेंडाप्रमाणेच झिर्कोनियमाला राळेप्रमाणे तकाकी असते. श्रीलंकेत तसेच रशियातील उरल, ऑस्ट्रेलिया व अमेरिकेच्या संयुक्त संस्थानांतील उत्तर कॅरोलायना येथे आढळणाऱ्या बारीक चिकट वाळूत झिर्कोनियमाचे धातुक आढळते. बादेलेयाइट नावाचे झिर्कोनियमाचे ऑक्साइड श्रीलंकेत व ब्राझीलमध्ये आढळते. त्याचप्रमाणे झिर्काइट नावाचे ऑक्साइड आणि सिलिकेटांचे मिश्रणही आढळते. भारताच्या समुद्रकिनाऱ्यावरील वाळूत झिर्कॉन सापडते [⟶ झिर्कॉन].
प्राप्ती : शुद्ध स्थितीत झिर्कोनियम धातू तार काढण्याजोगी असते. पण ऑक्सिजन, नायट्रोजन, हायड्रोजन यांसारख्या वायूंच्या अल्प उपस्थितीमुळेही ती ठिसूळ बनते. त्यामुळे शुद्ध झिर्कोनियम बनविणे कठीण होऊन बसते. सध्या झिर्कोनियमाच्या उत्पादनाच्या खालील दोन पद्धती वापरात आहेत.
क्रोल पद्धत : या पद्धतीत द्रव मॅग्नेशियमाने झिर्कोनियम टेट्राक्लोराइडाच्या वाफेचे ⇨क्षपण केले जाते. ऑक्सिजन, नायट्रोजन व हवा यांचा संपर्क टाळणे अत्यावश्यक असल्यामुळे एकूण पद्धत गुंतागुंतीची आहे. ही पद्धत एकूण पुढील सहा टप्प्यांत पुरी होते. (१) प्रथम झिर्कॉन (ZrSiO4) व कोळसा यांचे मिश्रण विद्युत् प्रज्योत भट्टीत तापवले जाते. त्यातील सिलिकॉनाचे रूपांतर सिलिकॉन मोनॉक्साइडाच्या वाफेत होऊन ते बाहेर पडते व झिर्कोनियम कार्बाइड बनते. (२) हे कार्बाइड क्लोरीन वायूच्या वातावरणात तापवून त्याचे रूपांतर झिर्कोनियम टेट्राक्लोराइडामध्ये होते. (३) निष्क्रिय वातावरणात टेट्राक्लोराइड तापवून त्याचे संप्लवन (द्रवरूप न होता एकदम वायूत रूपांतर) करतात. त्यामुळे त्यातील ऑक्साइडे निराळी होऊन शुद्ध झिर्कोनियम मिळते. ही ऑक्साइडे वेगळी झाली नाहीत, तर शेवटी धातू ठिसूळ बनते. (४) टेट्राक्लोराइडाची वाफ करून द्रव मॅग्नेशियमाबरोबर विक्रिया होऊ देतात. ही क्रिया होताना काळजीपूर्वक नियंत्रण ठेवून धातू भुकटीच्या रूपात मिळणार नाही याची खबरदारी घ्यावी लागते. (५) तयार झालेले मॅग्नेशियम क्लोराइड वितळवून झिर्कोनियमापासून निर्वात स्थितीत वेगळे केले जाते. (६) मिळालेले छिद्रिष्ट झिर्कोनियम कुटून, दाबून त्याचे रूळ बनविले जातात आणि नंतर निष्क्रिय वातावरणात प्रज्योत भट्टीत वितळवून तिचे गोळे बनवितात. या गोळ्यांचे काठिण्य तपासून पाहतात. काठिण्य जास्त असल्यास गोळा त्याज्य ठरवितात.
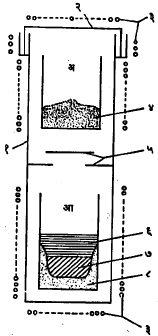
या पद्धतीत वापरण्यात येणाऱ्या उपकरणात एक अगंज (स्टेनलेस) पोलादाचे दंडगोलाकार पात्र असून त्याच्या बाहेरच्या बाजूस अनेक विद्युत् तापक घटक बसविलेले असतात. या पात्रात दोन भांडी (अ व आ) व त्यांच्यामध्ये आडव्या तबकड्या असून त्या दोन भांड्यांच्या मधे उष्णता निरोधकाचे काम करतात. अ हे भांडे झिर्कोनियम टेट्राक्लोराइडाने व आ हे भांडे मॅग्नेशियमाने भरण्यात येते. पात्राचा खालचा भाग मॅग्नेशियम वितळेल इतका तापवितात व वरच्या भागाचे तापमान ZrCI4 च्या वाफेचा पुरेसा दाब मिळेल इतके ठेवतात. ZrCI4 च्या वाफेने पात्र भरले की, ती वाफ खालील भागात जाऊन तेथील वितळलेल्या मॅग्नेशियमाच्या सान्निध्यात येते आणि हळूहळू मॅग्नेशियमाचे रूपांतर मॅग्नेशियम क्लोराइडात होऊन तयार झालेली झिर्कोनियम धातू भांड्याच्या तळाशी साचते. विक्रिया पूर्ण होऊन उपकरण थंड झाले म्हणजे आ हे भांडे दुसऱ्या एका पात्रात उलटे ठेवतात व हे पात्र निर्वात स्थितीत तापवितात. त्यामुळे मॅग्नेशियम व मॅग्नेशियम क्लोराइड यांची वाफ होऊन झिर्कोनियम धातू पात्रात शिल्लक राहते.
आयोडाइड पद्धत : ही पद्धत व्हॅन आर्केल व द बोअर यांनी शोधून काढली. या पद्धतीत ऑक्सिजनाचे प्रमाण जास्त असलेली छिद्रिष्ट झिर्कोनियम धातू प्रथम बनविली जाते. नंतर तिचे रूपांतर आयोडाइडामध्ये केले जाते व नंतर विघटनाच्या विक्रियेमुळे शुद्ध झिर्कोनियम धातू मिळवितात.
या पद्धतीत उच्च तापमानास कॅल्शियम धातूच्या साहाय्याने झिर्कोनियमाचे क्षपण होते. दळलेल्या कॅल्शियम ऑक्साइडामध्ये झिर्कोनियम ऑक्साइडाची पूड मिसळली जाते. विरल हायड्रोक्लोरिक अम्लाच्या प्रद्रावण क्रियेने धातू निराळी केली जाते. ओल्या धातूचा गिलावा एका दंडगोलाकार पात्राच्या आतल्या बाजूने पात्राची भिंत व त्यावरील मॉलिब्डेनमाच्या पत्र्याची जाळी यांमध्ये लेपला जातो. पात्राच्या मध्यभागी टंगस्टनाची किंवा मॉलिब्डेनमाची तार असते. त्यात थोडे आयोडीन घालून पात्रामधील हवा काढून घेतली जाते. पात्राची भिंत २००°से.पर्यंत तापविली जाते. या तापमानास झिर्कोनियम आणि आयोडीन यांच्यात विक्रिया होऊन टेट्रा-आयोडाइड बनते. टंगस्टनाच्या तारेवर झिर्कोनियम धातूचा थर जमतो. टंगस्टनाच्या तारेमधून विद्युत् प्रवाह पाठवून तापमान १,३००°से.पर्यंत वाढवितात. या वेळी धातूच्या पट्ट्या सुटू लागतात. विद्युत् प्रवाह सतत चालू ठेवून टंगस्टन तारेचे तापमान १,३००°से.इतके सतत ठेवावे लागते म्हणजे अशुद्ध छिद्रिष्टामधून झिर्कोनियम सतत निघून तारेवर शुद्ध स्वरूपात जमा होत जाते व धातूस ठिसूळपणा आणणारे पदार्थ मागे राहतात. शेवटी टंगस्टन तारेवर झिर्कोनियमाचा दांडा तयार होतो.
वरील दोनही पद्धतींत हाफनियमाचे धातूमधील प्रमाण मात्र बदलत नाही. मूळ धातुकात जे प्रमाण असते तितकेच कायम राहते. अणुकेंद्रीय विक्रियकांत झिर्कोनियमाचा वापर करावयाचा असल्यास हाफनियम काळजीपूर्वक काढून टाकावी लागते कारण ती झिर्कोनियमापेक्षा ७०० पट न्यूट्रॉन शोषण करू शकते. यासाठी हाफनियममुक्त (हाफनियम ०·०२ टक्क्यापेक्षा कमी) झिर्कोनियम बनवावी लागते. हाफनियम काढून टाकण्यास क्षपण क्रियेच्या आधीच ⇨आयन-विनिमय पद्धत वापरून हाफनियम आयन सल्फेट विद्रावातून काढावे लागतात.
गुणधर्म : अणुकेंद्रीय विक्रियकाच्या बांधणीत उपयोगात आणावयाची झिर्कोनियम धातू अतिशय शुद्ध असावी लागते. हायड्रोजन, ऑक्सिजन व नायट्रोजन हे वायू झिर्कोनियमामध्ये बऱ्याच मोठ्या प्रमाणात शोषले जातात. हाफनियमाचे झिर्कोनियमामधील अल्प प्रमाणसुद्धा अणुकेंद्रीय विक्रियकाच्या बांधणीत धोकादायक ठरते. ८६२° से. तापमानाच्या वरील तापमानास असणारे झिर्कोनियमाचे भौतिक गुणधर्म आणि त्याखालील तापमानास असणारे त्याचे गुणधर्म यांत खूप फरक पडतो. अनेक वायू झिर्कोनियमात शोषले जातात. १,०००° से. तापमान असताना ऑक्सिजन झिर्कोनियमात इतका शोषला जातो की, त्याचे वाढलेले आकारमान दिसू शकते. शोषकाची मर्यादा संपल्यावर झिर्कोनियमाबरोबर ऑक्सिजन संयोग पावतो आणि त्याचे ऑक्साइड (ZrO2) होऊ लागते. झिर्कोनियमाचे ऑक्सिजन वायूच्या बाबत इतके आकर्षण आहे की, उच्चतापसह (उच्च तापमान सहन करू शकणाऱ्या) मुशीतील MgO, BeO अथवा ThO2 अशा संयुगांमधील ऑक्सिजनही खेचून घेतला जातो. कोठी तापमानास (सर्वसाधारण तापमानास) झिर्कोनियमावर ऑक्सिजनाचा तसा परिणाम होत नसला, तरी २००°– ३००° से. तापमानास झिर्कोनियमावर काळे पुट चढते. छिद्रिष्ट झिर्कोनियम व हवेतील बाष्प यांच्यात स्फोटक विक्रिया घडू शकते. झिर्कोनियम व नायट्रोजन यांमधील विक्रियाही वरीलप्रमाणेच असल्या, तरी तितक्या नेत्रदीपक नाहीत.
८००° से. तापमान असता हायड्रोजनाबरोबर झिर्कोनियम ठिसूळ बनून झिर्कोनियम हायड्राइड (ZrH2) बनते.
१००° से. तापमानासही नायट्रिक अम्लाची झिर्कोनियमाबरोबर विक्रिया होत नाही. तसेच इतर अकार्बनी उच्च संहती ( प्रमाण उच्च असलेल्या) अम्लांच्या बरोबर कोठी तापमानास विक्रिया होत नाही. ओलसर क्लोरीन अथवा ओलसर आयोडीन वायुरूपात व अम्लराज (एक भाग नायट्रिट व तीन भाग हायड्रोक्लोरिक अम्ल यांचे मिश्रण) यांची झिर्कोनियमाबरोबर विक्रिया होते. बहुतेक सर्व कार्बनी अम्लांची झिर्कोनियमावर विक्रिया होत नाही.
झिर्कोनियम शुद्ध असल्यास त्यावर उच्चदाबयुक्त पाण्याचा (३००° से. तापमान अथवा त्यापेक्षा जास्त तापमानाला) परिणाम होत नाही, परंतु त्यात नायट्रोजनची अशुद्धी थोडी जरी असली, तरी वाईट परिणाम होतो. हा वाईट परिणाम २ ते ३ टक्के कथिल झिर्कोनियमामध्ये मिसळून टाळता येतो. उच्च दाबाखालील पाण्याचा झिर्कोनियम शुद्ध असल्यास परिणाम होत नाही ही गोष्ट महत्त्वाची आहे. ज्या विक्रियकांत शीतक म्हणून उच्च दाबाखालील पाणी वापरले जाते (नॉटिलस नावाच्या अणुऊर्जेवर चालणाऱ्या पाणबुडीवर असा विक्रियक आहे) त्याच्या कार्यक्षमतेवर कोणताही दुष्परिणाम होणे धोक्याचे असते [⟶ अणुकेंद्रीय अभियांत्रिकी].
संयुगे : झिर्कोनियम हे आवर्त सारणीच्या चौथ्या ब गटातील आहे. त्याची नेहमीची संयुजा ४ आहे. झिर्कोनियम ऑक्साइडासारख्या उच्च वितळबिंदू असलेल्या संयुगात आयनिक (विरुद्ध विद्युत् भार असलेल्या दोन आयनांतील) बंध असतात, तर कमी वितळबिंदू असलेल्या संयुगांत ते बंध अंशतः सहसंयुजी (ज्यात दोन अणूंत इलेक्ट्रॉन सामान्यतः दोन, समाईक असतात असे) असतात.
झिर्कोनियमाची ऑक्साइडे, सल्फाइडे, नायट्राइडे आणि कार्बाइडे अतिस्थिर असतात म्हणजे त्यांच्यापासून धातुक्षपण होणे कठीण असते. झिर्कोनियमाची हॅलाइडे मध्यम स्थिर असतात.
झिर्कोनियमाची संयुजा चार असली, तरी चार विद्युत् भार असणारा झिर्कोनियम आयन (Zr4+) जलविद्रावात अस्तित्वात नसतो. त्याचा लहान आकार पण उच्च विद्युत्भार यांमुळे तो ऋण आयनांशी संयुक्त असलेला दिसतो. सर्वांत सुलभ असाविद्रावातील आयन झिर्कोनिल आयन (ZrO++) होय.
झिर्कोनियम डाय-ऑक्साइड (वा झिर्कोनिया, ZrO2) याच्या निरनिराळ्या तापमानांस निरनिराळ्या स्फटिकाकृती असतात. १,०००° से. खाली स्थिर असलेली एकनताक्ष १,०००° ते १,९००° से.च्या दरम्यान स्थिर चतुष्कोणीय व १,९००° से.च्यावर स्थिर असलेली समघनी. हिचा वितळबिंदू २,६८०° से. आहे. बराच वेळ तापविल्यास झिर्कोनियाचा भेद होऊन एका प्रकारातून दुसऱ्या प्रकारात बदल होतो. ५ टक्के MgO किंवा CaO मिसळून भेद टाळता येईल कारण मग झिर्कोनिया समघनी प्रकारातच राहील. या प्रकाराला स्थिरीकृत झिर्कोनिया असे म्हणतात. हा अतिस्थिर असून त्याचा उकळबिंदू ४,०००° से.च्यावर असतो. झिर्कोनियम हायड्रोजन वायू शोषून घेतो. त्यामुळे झिर्कोनियम हायड्राइड (ZrH2) तयार होते.
काही संयुगांत झिर्कोनियमाची संयुजा चारापेक्षा कमी असते. उदा., ZrN, ZrB. या संयुगांचे वितळबिंदू उच्च असतात आणि काठिण्य मोस मापक्रमानुसार ८ ते ९ पर्यंत असते.
उपयोग : झिर्कोनियमाचा महत्त्वाचा उपयोग अणुकेंद्रीय विक्रियकात इंधन म्हणून वापरले जाणारे युरेनियमाचे रूळ बंदिस्त करण्यासाठी आवरण म्हणून केला जातो. युरेनियमाबरोबर मिश्रधातू करण्यासाठी व विक्रियकातील गाभ्याच्या रचनेतही तिचा उपयोग करण्यात येतो. झिर्कोनियम सहज गंजत नसल्यामुळे रासायनिक प्रक्रिया करण्याच्या साधनांत म्हणजे पंप, झडपा, उष्णता विनिमयक (दोन द्रायू म्हणजे द्रव वा वायू एकमेकांपासून अलग ठेवून अधिक तापमानाच्या द्रायूतील उष्णतेने कमी तापमानाच्या द्रायू तापविण्याचे साधन), गाळण्या इ. बनविण्यामध्ये तिचा उपयोग होतो. मॅग्नेशियमाच्या मिश्रधातू तयार करण्यासाठीही तिचा मिश्रक घटक म्हणून उपयोग करतात.
काच, मृत्तिका उद्योग (सिरॅमिक्स) व एनॅमल या उद्योगांत झिर्कोनियम ऑक्साइडाचा उपयोग होतो. वस्त्रांवर वातावरणाची आणि सूक्ष्मजीवांची क्रिया होऊ नये यांसाठी करण्यात येणाऱ्या संस्करणात, कातडी कमावण्यासाठी, छायाचित्रणात लागणाऱ्या स्फुरदीपांत (क्षणिक तीव्र प्रकाश देणाऱ्या दिव्यांत) व खनिज तेलाच्या भंजनासाठी (घटक वेगळे करण्यासाठी) झिर्कोनियमाच्या संयुगांचा उपयोग होतो. ओतकामाकरिता साचे तयार करण्याच्या वायूमध्ये, उष्णता विनिमयक व उष्णता निरोधक यांतील मृत्तिकेचे पन्हळीदार घटक व उच्चतापसह पदार्थ बनविण्यासाठी झिर्कोनियम सिलिकेटाचा (झिर्कॉनाचा) उपयोग करतात. झिर्कोनियमाच्या संयुगांचा औषधांतही (उदा., शरीराचा दुर्गंध घालविणारी द्रव्ये) उपयोग करण्यात येत आहे. झिर्कोनियम हायड्राइड लष्करामधील सांकेतिक ज्वालांमध्ये, विस्फोटकामध्ये, मृत्तिका वस्तू आणि धातू यांच्या झाळकामात, तसेच फेसाळ ॲल्युमिनियम तयार करण्यासाठी वापरतात.
संदर्भ : Meller, J. W. A Comprehensive Treatise on Inorganic and Theoretical Chemistry, Vol. VII, London, 1963.
जमदाडे, ज. वि.
“