कलिल : (कलॉइड). आणवीय किंवा साध्या रेणवीय परिमाणांपेक्षा बरेच मोठे परंतु नुसत्या डोळ्याला दिसू शकणाऱ्या कणांपेक्षा बरेच लहान असलेल्या अशा कणांमध्ये विभाजित झालेला पदार्थ म्हणजे कलिल होय.
विद्युत (विरघळणारा पदार्थ) जेव्हा विद्रावकात (विरघळविणाऱ्या पदार्थात) विरघळते तेव्हा त्याचे रेणूच्या किंवा आयनाच्या (विद्युत् भारित अणू, रेणू वा अणुगट याच्या) रूपात विभाजन होते. उदा., साखर जेव्हा पाण्यात विरघळते तेव्हा तिचे रेणूच्या रूपात विभाजन होते, तर मीठ (सोडियम क्लोराइड) जेव्हा पाण्यात विरघळते तेव्हा त्याचे आयनांत विगमन (संयुगातील आयन एकमेकांपासून वेगळे होणे) होते. विद्रावात विद्रुत कणांचे आकारमान अतिशय लहान असल्यामुळे सूक्ष्मदर्शक किंवा अतीत सूक्ष्मदर्शक (पदार्थाची स्थिती समजण्यासाठी प्रकाशाच्या विखुरण्याच्या गुणधर्माचा उपयोग करणारा सूक्ष्मदर्शक) वापरूनही ते कण दिसू शकत नाहीत. याउलट निलंबनात (लोंबकळणाऱ्या अवस्थेत) विभाजित कणांचा आकार इतका मोठा असतो की, नुसत्या डोळ्यांनी किंवा सूक्ष्मदर्शकातून ते आपल्याला दिसू शकतात. गढूळ पाणी काही काल स्थिर राहू दिल्यानंतर त्यातील मातीचा बराच भाग तळाशी बसतो. त्यानंतरही किंचित गढूळ राहिलेले पाणी हे याचे उदाहरण आहे. याच पाण्यात तुरटीचा खडा दोन तीन वेळा फिरविला असता त्यात उरलेला निलंबित मातीचा अंशही खाली बसतो व पाणी स्वच्छ होते. कलिल विद्रावात कणांचे आकारमान या दोहोंच्या दरम्यान असते. म्हणजे कलिल कण रेणूपेक्षा मोठे असतात परतु निलंबनातील कणांपेक्षा त्यांचे आकारमान लहान असल्यामुळे साध्या सूक्ष्मदर्शकातून ते आपणास दिसू शकत नाहीत म्हणजे साध्या सूक्ष्मदर्शकातून दिसू शकणार्या कणांपेक्षा कलिल कणांचे आकारमान लहान असते. ही कलिल कणाच्या आकारमानाची उच्च सीमा म्हणता येईल व रेणूच्या आकारमानापेक्षा मोठा म्हणजे अतीत सूक्ष्मदर्शकातून दिसण्य़ाइतपत मोठा, ही कलिल कणांच्या आकारमानाची नीच सीमा ठरवितायेईल. वस्तुस्थिती अशी असते की, कित्येक वेळा कलिल कण हा अनेक रेणूंच्या संगमनाने (एकत्र येऊन) बनलेला असतो. कलिल विद्रावात (याला सर्वसाधारणपणे ‘सोल’ असे नाव दिले जाते) कलिल कणांचे आकारमान १ ते ५०० मिलिमायक्रॉन (१ मिलिमायक्रॉन = १०-७ सेंमी १ मायक्रॉन = १०-४ सेंमी.) या मर्यादीत असते. सामान्य रेणू एक मिलिमायक्रॉनहून बरेच लहान असतात. ५०० मिलिमायक्रॉनहून मोठ्या आकाराचे कण सूक्ष्मदर्शकातून दिसू शकतात. काही विशिष्ट विद्रुते विद्रावात जरी रेणूच्या रूपात विभाजित झालेली असली तरी त्यांच्या रेणूंचे आकारमान इतके मोठे असते की, त्या विद्रावाचा समावेश कलिल विद्रावात करता येतो आणि अशा विद्रावांचे गुणधर्मही कलिल विद्रावाच्या गुणधर्मांप्रमाणेच असल्यामुळे हा समावेश चुकीचा ठरत नाही. उदा., प्रथिने किंवा उच्च बहुवारिके (अनेक रेणूंच्या संयोगाने तयार झालेल्या जटिल रेणूंनी युक्त असलेली संयुगे) यांचे विद्राव.
मीठ, साखर इत्यादींचे विद्राव समांगी (सर्वत्र सारखे असलेले) असतात. त्यात घन प्रावस्था व द्रव प्रावस्था वेगळ्या करता येत नाहीत याउलट कलिल विद्राव आणि निलंबने विषामांगी असतात. कलिल विद्राव हा दोन प्रावस्थांचा बनलेला असतो. कलिल कण ज्या प्रावस्थेचे बनलेले असतात (घन, द्रव वा वायू) त्याला अपस्कारित प्रावस्था असे म्हणतात व ज्या माध्यमात कलिल कणांचे अपस्करण होते त्या माध्यमास अपस्करण माध्यम असे म्हणतात. म्हणजे सोल हा अपस्कारित प्रावस्था व अपस्करण माध्यम ह्या दोन प्रावस्थांचा बनलेला आहे. कलिली विद्रावाची व्यवहारात आढळणारी नेहमीची उदाहरणे म्हणजे धूर, धुके, ढग तसेच दूध, दही, लोणी, आइस्क्रीम ही होत. धुरामध्ये कलिली कण घन पदार्थापासून बनलेले असतात तर अपस्करण माध्यम वायुरुप असते. धुके आणि ढग यांत कलिली कण द्रवरुप पाण्यापासून बनलेले असतात तर अपस्करण माध्यम वायुरूप असते. दुधात केसीन या प्रथिनाचे घनरुप कण पाणी या द्रव माध्यमात अपस्कारित असतात.
खाद्यपेये, शरीरपेशी. कित्येक रंग, शाई, प्लॅस्टिके, सिमेंट, रबर इ. नित्य परिचित वस्तू कलिल स्वरूपात असल्यामुळे कलिलाच्या अध्ययनास फार महत्त्व आहे. तुरटीतील अल्युमिनियम आयनांमुळे गढूळ पाण्यातील अतिशय सूक्ष्म अशा गाळाचे संगमन होते व तो खाली बसतो आणि आपणास स्वच्छ पाणी मिळते. कातड्यात कलिलरूप प्रथिने असतात. त्यांचे जलशोषण व तदोत्तर अवक्षेपण (साका तयार होणे) यामुळे कातडी कमावून त्याचे उत्तम चामडे बनविता येते. कित्येक औषधे सोलस्वरुप असल्याने शरीरात ती सहज शोषिली जातात व त्यामुळे ती अधिक प्रभावी होत असल्याचे दिसून आले आहे. कारखान्यांच्या धुरामुळे तयार होणारे धूसर वातावरण, कलिल धुलिकणांचे विद्युतीय किलाटन करून (विजेच्या साहाय्याने कलिल कण वेगळे करुन), निर्मळ बनविता येते. छायाचित्रण करण्याच्या काचेवर किंवा कागदावर जिलेटिनामधील सिलव्हर ब्रोमाइडाचा कलिली विद्राव लावलेला असतो. कापडावर रंग पक्का बसावा म्हणून कलिली साहाय्यक वापरावा लागतो. साबणाची निर्मिती व त्याचे कार्य यात कलिल विद्रावांच्या गुणधर्माचाच उपयोग केलेला असतो. टूथ-पेस्ट ही देखील कलिल विद्रावच आहे. डब्ल्यू. डी. बँक्रॉफ्ट यांनी १९२६ साली पृथ्वी, जीवसृष्टी व जीवनसामग्री यांच्या सखोल व समग्र ज्ञानासाठी कलिलांचे अध्ययन आवश्यक आहे असे म्हटले आहे.
कलिल विद्रावांचे सर्वसाधारण गुणधर्म : कलिल विद्राव समांगी नसून दोन प्रावस्थांचा बनलेला असतो. प्रत्येक कलिल कण आणि अपस्करण माध्यम यांना विलग करणारा पृष्ठभाग असतो. हा पृष्ठभाग अधिशोषण (पृष्ठभागाकडून होणारे शोषण) आणि विद्युत् वर्चस् (विद्युत् स्थिती) असे पृष्ठीय गुणधर्म दाखवितो. कलिल विद्रावांचे हे पृष्ठीय गुणधर्म कलिल कणांच्या पृष्ठभागाचे क्षेत्रफळ आणि कणांचे आकारमान यांचे गुणोत्तर जास्त असल्यामुळेच आलेले असतात. जेव्हा हे गुणोत्तर लहान असते, उदा., निलंबनात कणांचा आकार कलिल कणांपेक्षा बराच मोठा असल्यामुळे या गुणोत्तराचे मूल्य कमी येते, तेव्हा वरील पृष्ठीय गुणधर्म विशेषत्वाने जाणवत नाहीत.
प्रकाशीय गुणधर्म : कलिल कण सूक्ष्मदर्शकातून जरी दिसू शकत नसले तरी त्यांचे अस्तित्व प्रकाशाच्या साहाय्याने दाखविता येते. प्रकाशाचे किरण आयनी किंवा रेणूरूपी विद्रावातून जाऊ दिले तर त्यांचा मार्ग सहजासहजी कळू शकत नाही. विद्रावात कलिल कंण असतील तर मात्र किरणांचा मार्ग सहजपणे दिसू शकतो. यात कलिल कणांमुळे प्रकाश किरणांचे प्रकीर्णन (विखुरले जाणे) होते आणि त्यामुळे त्यांचा मार्ग दिसू शकतो. कलिल कणांमुळे प्रकाशाच्या होणार्या प्रकीर्णनाचा अभ्यास टिंड्ल यांनी केला व त्यामुळे वरील प्रकारास टिंड्ल परिणाम असे नाव आहे. झीडेन्टोफ व झिगमोंडी यांनी अतीत सूक्ष्मदर्शक बनविला. यात प्रत्येक कणाने प्रकीर्णित केलेला प्रकाश चमकण्याच्या स्वरूपात दिसतो व त्यामुळे कलिल कणाचे अस्तित्व जाणवू शकते. जर कलिल विद्रावात विद्युत् विच्छेद्य (विद्रावात असताना आयनांत विभागणारे व विद्युत् प्रवाह वाहून नेणारे पदार्थ) मिसळले, तर कलिल कण संगमित (एकत्रित) होऊ लागतात व कलिल कणांचा अवक्षेप तयार होऊन तो द्रवाच्या तळाशी बसू लागतो. या प्रकारास किलाटन असे म्हणतात. किलाटनासाठी विद्युत् विच्छेद्याचे किती प्रमाण मिसळावे लागते, हे कलिलाच्या प्रकारावर अवलंबून असते. उदा., द्रवद्वेषी (द्रवाला विरोध करणार्या) कलिलात विद्युत् विच्छेद्य अल्प प्रमाणात मिसळले तरी त्याचे किलाटन होते. याउलट द्रवस्नेही (द्रवाचे आकर्षण असणार्या) कलिलाचे किलाटन करण्यासाठी विद्युत् विच्छेद्य जास्त प्रमाणात कलिल विद्रावात मिसळावे लागते.
इतिहास : क्लॉइड हा शब्द १८६१ साली ग्रॅहॅम यांनी प्रथम वापरला. त्यांना असे आढळून आले की, पार्चमेंट कागद (पाणी व तैल पदार्थ यांना रोध करणारा कागद) किंवा प्राणिज पटले यांतून साखर, मीठ इ. पदार्थांचे त्वरेने विसरण (एकमेकांत मिसळण्याची क्रिया) होते, याउलट जिलेटीन, आगर इ. पदार्थांच्या विसरणाचा वेग अतिशय मंद असतो. तो इतका की, या पदार्थाचे त्या पटलातून विसरण होतच नाही असे वाटते. ज्या पदार्थांचे पटलातून लगेच विसरण होते अशा पदार्थांना त्यांनी स्फटिकधर्मी असे नाव दिले, कारण असे पदार्थ सर्वसाधारणपणे स्फटिकाच्या रूपात आढळतात. याउलट ज्या पदार्थाचा पटलातून विसरणाचा वेग अतिशय कमी असतो, अशांना त्यांनी कलाॅइड (कलिल) अशी संज्ञा दिली. यावरुन त्यांनी असे अनुमान काढले की, पदार्थांचे स्फटिकधर्मी व कलिलधर्मी असे वर्गीकरण शक्य आहे. परंतु पुढे असे आढळून आले की, कित्येक कलिलधर्मी पदार्थ स्फटिकाच्या रूपात आढळतात. तसेच लांब शृंखला असलेल्या वसाम्लांची सोडियम लवणे पाण्यातील विद्रावात कलिल विद्रावांचे गुणधर्म दाखवितात, परंतु अल्कोहॉलामधील विद्रावात मात्र स्फटिकधर्मी गुणधर्म दाखवितात. त्याचप्रमाणे कित्येक स्फटिकांचे (उदा., गंधक, ग्रॅफाइट) कलिल विद्रावात रुपांतर करण्यात आले. त्यामुळे पदार्थाचे स्फटिकधर्मी व कलिलधर्मी वर्गीकरण शक्य नाही हे स्पष्ट झाले. हल्ली कलिलांचा ‘कलिल पदार्थ’ असा उल्लेख न करता ‘कलिल स्थिती’ असा करतात व कलिल विद्रावात कलिलांचे गुणधर्म दाखविणारे पदार्थ कलिल स्थितीत आहेत असे म्हणतात. पदार्थाच्या वायू, द्रव आणि घन यांसारखीच कलिल ही सुद्धा एक स्थिती आहे असे मानतात. कलिल विद्राव ग्रॅहॅम यांच्या प्रयोगांच्या आधीपासून बनविण्यात आले आहेत. उदा., सोन्याचा कलिल विद्राव फॅराडे यांनी १८५७ साली बनविला, तर सिलिसिक अम्लाचा कलिल विद्राव बर्गमन यांनी १७७९ साली आणि बर्झीलियस यांनी १८४४ मध्ये आर्सेनियस सल्फाइडाचा कलिल विद्रावबर्गमन यांनी १७७९ साली आणि बर्झीलियस यांनी १८४४ मध्ये आर्सेनियस सल्फाइडाचा कलिल विद्राव बनविला. या शास्त्रज्ञांशिवाय शुल्ट्से, हार्डी, झिगमोंडी, झीडेन्टोफ, पेरिन इ. अनेकांनी कलिल क्षेत्रात महत्त्वाचे संशोधन कार्य केले आहे.
वर्गीकरण : कलिलांचे वर्गीकरण अनेक प्रकारे केले जाते. अपस्करण माध्यम व अपस्कारित प्रावस्था यांवरून ओस्टव्हाल्ट यांनी कलिल विद्रावांचे म्हणजेच सोलांचे खालीलप्रमाणे वर्गीकरण केले व कलिल विद्रावाला अपस्करण माध्यमाचे नाव प्रथम घालून नावे दिली. जसे एरोसोल (अपस्करण माध्यम वायुरूप), हायड्रोसोल (अपस्करण माध्यम पाणी). तसेच ऑर्गॅनोसोल (अपस्करण माध्यम कार्बनी द्रव पदार्थ) कलिलांचे नैसर्गिक व कृत्रिम कलिल अशा दोन गटांतही वर्गीकरण केले जाते.प्रथिनासारखी काही नैसर्गिक कलिले पाण्यात (अपस्करण माध्यमात) सहज अपस्करण पावून सोल तयार होतो. सोने, चांदी, प्रशियन ब्ल्यू यांची कलिले कृत्रिम म्हणून गणली जात.
| अपस्करण माध्यमाची प्रावस्था | कलिल कणांची प्रावस्था | उदाहरणे |
| वायुरूप
वायुरूप द्रवरूप द्रवरूप द्रवरूप घनरूप घनरूप घनरूप |
द्रवरूप
घनरूप वायुरूप द्रवरूप घनरूप वायुरूप द्रवरूप घनरूप |
ढग, धुके
धूर फेस पायस धातवीय कलिल, प्रथिन सोल काही खनिजे घन पायस घन सोल, काही मौल्यवान खडे |
कलिलांचे द्रवस्नेही कलिल व द्रवद्वेषी कलिल असेही वर्गीकरण करण्यात येते. द्रवस्नेही कलिलात कलिल कणांवर अपस्करण माध्यमाचे दृढ आवरण असते, याउलट द्रवद्वेषी कलिलात अपस्करण माध्यम व कलिल कण यांचे विशेष सख्य नसल्यामुळे कलिल कणांवर माध्यमाचे आवरण नसते. द्रवस्नेही व द्रवद्वेषी कलिलांचे अपस्करण माध्यम पाणी असल्यास त्यांना जलस्नेही व जलद्वेषी अशा संज्ञा देतात. काही कलिले संपूर्णपणे द्रवस्नेही व द्रवद्वेषी नसतात. त्यांचे गुणधर्म या दोन टोकांच्या मध्ये असतात. द्रवस्नेही व द्रवद्वेषी कलिलांच्या गुणधर्माची तुलना पुढे दिली आहे.
(१) कणात्मक घटकाचे माध्यमाशी प्रमाण मोठे असताही द्रवस्नेही कलिल स्थायी असते. द्रवद्वेषी कलिलात स्थैर्थासाठी कलिल कणांचे प्रमाण अत्यल्प असावे लागते.
(२) लवण, अम्ल इ. विद्युत् विच्छेद्य द्रवद्वेषी कलिलांत अल्प प्रमाणातही मिसळले, तर ते कलिल अस्थाथी होते व कलिलांचे किलाटन होऊन कलिल कण तळाशी जमू लागतात. विद्युत् विच्छेद्याच्या अल्पांश मिसळीने द्रवस्नेही कलिल अस्थाथी होत नाही. द्रवस्नेही कलिल अस्थाथी होण्यासाठी विद्युत् विच्छेद्य मोठ्या प्रमाणावर मिसळावे लागते.
(३) दीर्घकाल अपोहन (प्राणिज पटलाच्या किंवा पार्चमेंट कागदाच्या साहाय्याने कलिल कण व रेणुरूप कण वेगळे करण्याची क्रिया) केले तरी द्रवस्नेही कलिल स्थायीच राहते याउलट द्रवद्वेषी कलिल दीर्घ अपोहनाने अस्थायी होते.
(४) सुकविलेले द्रवस्नेही कलिल अपस्करणमाध्यामाच्या सान्निध्यात ठेवून त्याचा सोल परत मिळविता येतो. याउलट द्रवद्वेषी कलिल एकदा सुकविले की, त्याचा सोल नुसत्या अपस्करण माध्यामाच्या सान्निध्यात ठेवून परत मिळविता येत नाही.
(५) द्रवद्वेषी कलिलाचा पृष्ठताण अपस्करण माध्यमाएवढाच असतो. द्रवस्नेही कलिलांचा पृष्ठताण मात्र अपस्करण माध्यमाहून बराच कमी असतो.
(६) द्रवद्वेषी कलिलांची श्यानता (दाटपणा) अपस्करण माध्यमाएवढीच असते, तर द्रवस्नेही कलिलांची श्यानता अपस्करण माध्यमाहून बरीच जास्त असते.
(७) द्रवद्वेषी कलिलात कलिलांचे कण अतीत सूक्ष्मदर्शकातून सहज दिसू शकतात. द्रवस्नेही कलिलात कलिलांचे कण अतीत सूक्ष्मदर्शकातून सहज दिसू शकत नाहीत.
(८) द्रवद्वेषी कलिलात कलिल कण विद्युत् क्षेत्रात कुठल्यातरी एका दिशेने मार्ग आक्रमू लागतात. काही द्रवस्नेही कलिलांत कलिल कण विद्युत् क्षेत्रात कुठल्या तरी दिशेने मार्ग आक्रमू लागतात, तर काही द्रवस्नेही कलिलांतील कण स्थिर राहतात.
(९) प्रकाश किरणांचे प्रकीर्णन द्रवस्नेही कलिलातून जाताना कमी प्रमाणात होते, तर द्रवद्वेषी कलिलात ते जास्त प्रमाणात होते.
अलीकडे कलिलांचे व्युत्क्रमी कलिल (योग्य माध्यमात ज्याचे सहज अपस्करण होते व किलाटन झाल्यानंतर पुन्हा अपस्करण होऊ शकते असे कलिल) व अव्युत्क्रमी कलिल असे वर्गीकरण करण्य़ात येते. वर म्हटल्याप्रमाणे द्रवस्नेही कलिले व्युत्क्रमी असतात आणि द्रवद्वेषी कलिले अव्युत्क्रमी असतात. व्युत्क्रमी आणि अव्युत्क्रमी कलिलांत वरील प्रकारांचा समावेश करण्यात येतो.
| अव्युत्क्रमी कलिले | व्युत्क्रमी कलिले |
| द्रवद्वेषी कलिले
पायस फेस पेस्ट |
द्रवस्नेही कलिले
कलिली विद्युत् विच्छेद्य जेली |
कलिल विद्राव तयार करण्याच्या पद्धती : या पद्वतींचे अपस्करण पद्धती व संघनन (रेणू एकत्र करण्याची) पद्धती असे वर्गीकरण करतात. कलिल कणांचे आकारमान, अतिसूक्ष्म सर्वसामान्य रेणू व सूक्ष्मदर्शकातून दिसू शकणारे कण, यांच्यामध्ये असते म्हणून या दोहोंपासून कलिलावस्थेकडे जाणे शक्य असते. अतिसूक्ष्म रेणूरूप विद्र्युताच्या संघननाने तसेच मोठ्या कणांच्या पुरेशा विभाजनाने कलिल कण मिळू शकतील.
(अ) अपस्करण पद्धती : (१) कलिल कणांच्या आकारमानाएवढे, मोठ्या कणांचे विभाजन करणारे कलिल पेषणी (चक्की) नावाचे यंत्र असते. यात दोन पोलादी चकत्यांमध्ये अतिसूक्ष्म फट असते आणि त्या चकत्या एकमेकींच्या विरुद्ध दिशेने अतिशय वेगात फिरविण्याची योजना असते. पेषणीत अपस्करण माध्यम, ज्या पदार्थाचे अपस्करण करावयाचे तो पदार्थ व स्थैर्यदायी माध्यम एकदमच घालतात. पेषणी चालू झाल्यावर काही वेळाने कलिल विद्राव मिळतो.
(२) पेप्टीकरण : ताज्या फेरिक हायड्रॉक्साइडाच्या अवक्षेपामध्ये जर फेरिक क्लोराइडाचा अल्पांश मिसळला, तर पेप्टीकरणाने (सोलमध्ये रूपांतर करण्याने) फेरिक हायड्रॉक्साइडाचा कलिल विद्राव मिळतो. ज्या पदार्थामुळे कलिल विद्राव मिळतो त्याला पेप्टीकारक असे म्हणतात. (वरील उदाहरणात फेरिक क्लोराइड). तसेच ताज्या अल्युमिनियम हायड्रॉक्साइडाच्या अवक्षेपात जर हायड्रोक्लोरिक अम्लाचा अल्पांश मिसळला तर ॲल्युमिनियम हायड्रॉक्साइडाचा कलिल विद्राव मिळतो. यात हायड्रोक्लोरिक अम्ल हे पेप्टीकारक आहे. काही वेळेस पेप्टीकारक वेगळा मिसळण्याची आवश्यकता नसते. उदा., जिलेटीन किंवा स्टार्च या पदार्थाचे पाण्याच्या सान्निध्यात पेप्टीकरण होऊन त्यांचा द्रवस्नेही कलिल विद्राव मिळतो. यात अपस्करण माध्यमाचा, म्हणजे पाण्याचाच, पेप्टीकारक म्हणून उपयोग होतो. तसेच अमोनियम व्हॅनेडेटावर हायड्रोक्लोरिक अम्लाची क्रिया करून जलयुक्त व्हॅनेडियम पेंटॉक्साइडाचा अवक्षेप मिळतो. हा अवक्षेप पुन:पुन्हा पाण्याने धुऊन त्याचा सोल मिळविता येतो.
(३) ब्रेडिक यांची पद्धती : ही पद्धती मिश्र स्वरूपाची आहे.
या पद्धतीत प्रारंभी धातूचे अणुप्राय बाष्प बनते व नंतर त्याचे संघनन होऊन कलिल कणांच्या आकारमानाएवढे कण मिळतात. शुद्ध पाण्यात दाहक सोड्याचा अल्पांश विरघळवून त्या विद्रावात ज्या धातूचे (उदा., सोने, चांदी, प्लॅटिनम) कलिल हवे असेल त्यांची बनविलेली विद्युत् अग्रे बुडवून ठेवतात. विद्युत् अग्रे उच्च विद्युत् दाब देणार्या उपकरणास जोडतात व विद्युत् अग्रांमध्ये विद्युत् स्फुल्लिंग (ठिणगी) पडू देतात. धातू बाष्पीभूत होऊन धातुबाष्पाचे कलिली कणांत संघनन होते. कलिल कणांवर हायड्रॉक्साइड आयन अधिशोषित केले जातात. ब्रेडिक यांच्या पद्वतीत स्व्हेड्बॅरी यांनी सुधारणा करून ती टिकाऊ धातवीय कलिलांची निर्मिती करण्यास योग्य अशी केली. त्यांनी प्रत्यावर्ती (उलट सुलट दिशेने वाहणारा) व अधिक प्रभावी वीजप्रवाह वापरला. या पद्धतीने पाण्याव्यतिरिक्त अन्य द्रव माध्यमांतही (उदा., अल्कोहॉल, बेंझीन इ.) धातवीय कलिले मिळविता येतात.
(आ) संघनन पद्वती : (१) शीतन : पेंटन या द्रवात पाणी ओतून मिश्रण ढवळत ठेवून थंड केल्यास बर्फाचा कलिल विद्राव मिळतो.
(२) क्षपण : या पद्धतीने धातवीय कलिल सुलभपणे मिळविता येते. चांदी, सोने यांच्या लवणांच्या सौम्य विद्रावाचे कार्बनी क्षपणक [क्षपण घडविण्यास मदत करणारा पदार्थ, → क्षपण] वापरून क्षपण करतात. आयन किलाटन घडवीत असल्यामुळे आयनिक क्षपणक वापरत नाहीत. झिगमोंडी यांनी ०⋅६% क्लोरोऑरिक अम्लाच्या जलीय विद्रावामध्ये ०⋅१८ सममूल्याचा धुण्याच्या सोड्याचा विद्राव दीडपटीने टाकला. त्यात हजारपट पाणी मिसळून मिश्रण १००० से. पर्यंत तापविले. नंतर तापविणे थांबवून त्यात जेवढे क्लोरोऑरिक अम्ल प्रारंभी घेतले, तेवढा ०⋅३% फॉर्माल्डिहाइडाचा विद्राव मिसळला. तेव्हा त्यांना सोन्याचा गुलाबी सोल मिळाला. तसेच ०⋅१% क्लोरोप्लॅटिनिक अम्लाच्या विद्रावात पोटॅशियम कार्बोनेटाच्या विद्रावाचे थोडे थेंब टाकून त्यात ऍक्रोलिनाचा विद्राव हळूहळू मिसळला असता प्लॅटिनमाचा पिवळसर सोल मिळतो.
(३) ऑक्सिडीकरण : ऑक्सिडीकरणाचा [→ऑक्सिडीभवन] वापर करुन विद्राव मिळविता येतो. उदा., सल्फर डाय-ऑक्साइडाच्या जलीय विद्रावात त्याचा वास जाईतो हायड्रोजन सल्फाइड वायू सावकाश जाऊ द्यावा म्हणजे गंधकाचा कलिल विद्राव प्राप्त होईल. याप्रमाणेच हायड्रोजन सेलेनाइडाचे ऑक्सिडीकरण करून सेलेनियमाचा सोल मिळविता येईल.
(४) जलीय विच्छेदन : जलयुक्त ऑक्साइड व हायड्रॉक्साइड यांचे सोल मिळविण्यासाठी ही पद्धती वापरतात. उदा., उकळत्या शुद्ध पाण्यात फेरिक क्लोराइडाचा विद्राव थेंब थेंब टाकून ढवळल्यास फेरिक क्लोराइडाचे जलीय विच्छेदन होऊन (पाण्याची संयुगावर विक्रिया होऊन) फेरिक हायड्रॉक्साइडाचा कलिल विद्राव मिळतो.
(५) अवक्षेपण : आर्सेनिक ऑक्साइड शुद्ध गरम पाण्यात विरघळवून त्याचा १% विद्राव तयार करावा. हायड्रोजन सल्फाइडाचा पाण्यातील संतृप्त (विद्रावातील विरघळणाऱ्या पदार्थाचे जास्तीत जास्त प्रमाण असलेला) विद्राव घेऊन त्यात दुप्पट पाणी मिसळावे. नंतर त्यात आर्सेनिस ऑक्साइडाचा विद्राव हळूहळू मिसळून त्यातून हायड्रोजन सल्फाइड वायू सावकाश बुडबुडू दिल्यास आर्सेनिक सल्फाइडाचा सोल मिळतो. या पद्धतीचा उपयोग करुन सिल्व्हर हॅलाइडाचा सोल मिळविता येईल.
(६) माध्यम द्रव बदलणे : एखादा पदार्थ एका द्रवात अविद्राव्य पण दुसऱ्या द्रवात बराच विरघळत असल्यास, विद्राव ज्यात तो अविद्राव्य आहे त्यात हळूहळू ओतून ढवळल्यास कलिल विद्राव मिळ्तो. अल्कोहॉलमध्ये गंधकाचा संतृप्त विद्राव ढवळत पाण्यात ओतला म्हणजे गंधकाचा पाण्यातील सोल मिळेल. नंतर पाणी तापवून अल्कोहॉलाचे बाष्पीभवन करावे. मॅस्टिक गोंद किंवा फॉस्फरस यांचे सोल असेच तयार करतात.
कलिल विद्रावाचे शुद्धीकरण : वरील प्रकारांनी कलिल विद्राव मिळाल्यावर त्याच्यातील विद्युत् विच्छेद्य आणि इतर अशुद्वी खाली दिलेल्या साध्या किंवा विद्युत् अपोहनाने किंवा अतीत गालनाचा उपयोग करुन काढून टाकतात. जलद्वेषी कलिल विद्रावांच्या स्थैर्यासाठी विद्रावात अगदी अल्पप्रमाणात विद्युत विच्छेद्य असणे आवश्यक असते.
अपोहन : कलिल कण आणि रेणूरूप कण हे एकमेकांपासून विलग करण्यासाठी अपोहनाचा उपयोग करतात. प्राणिज पटलाच्या किंवा पार्चमेंट कागदाच्या साहाय्याने ग्रॅहॅम यांनी कलिल कण व रेणूरूप कण यांचे विलगीकरण (वेगळे करणे) केले. प्राणिज पटलातून रेणुरूप कणांचे विसरण (एकमेकांत मिसळण्याची क्रिया) त्वरेने होते, परंतु कलिल कणांचे विसरण इतक्या त्वरेने न होता अगदी मंदपणे होते. हे विसरण इतके मंद असते की, कित्येक वेळा विसरण होतच नाही असे वाटते. या विलगीकरण पद्बतीस अपोहन व ज्यात अपोहन करतात त्या उपकरणास अपोहक म्हणतात.
अशा प्रकारे होणारी अपोहन क्रिया फार सावकाश घडून येते. ती अधिक वेगाने व कार्यक्षम करण्यासाठी विद्युत् अपोहनाचा उपयोग करतात.
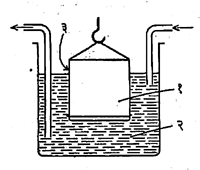
यात पार्चमेंट कागदाच्या दोन्ही बाजूंस विद्युत् घटाची विद्युत् अग्रे जोडलेली असतात. यामुळे कलिल विद्रावातील आयनी अशुद्धी विरुद्ध विद्युत् भाराच्या विद्युत् अग्राकडे त्वरेने खेचल्या जातात. या पद्धती आ. २ व आ. ३ मध्ये दर्शविल्या आहेत.

अतीत गालन : बेकहोल्ड यांनी अतीत गालन पद्धती शोधून काढली. कलिल कणांचे आकारमान लहान असल्यामुळे बाजारात मिळणार्या लहानात लहान छिद्र असलेल्या गालन पत्रातूनही ते आरपार जाऊ शकतात. बेकहोल्ड यांनी या गालन पत्रावर कलोडियन (ईथर व अल्कोहॉल यांमधील नायट्रीकृत सेल्युलोजांचा विद्राव) किंवा जिलेटीन या विद्रावाचा थर देऊन तो सुकू दिला व अशा तर्हेने अतीत गालन पत्र तयार केले. यामुळे गालन पत्रावरील छिद्रांचे आकारमान बरेच सूक्ष्म झाले व त्यांतून कलिल कण आरपार जाऊ शकले नाहीत, मात्र कलिल विद्रावातील रेणुरूप व आयनी विशुद्धी या छिद्रांतून आरपार जाऊ शकल्या. गालन पत्रावरील छिद्रांचे आकारमान हे त्यावर पसरण्यात येणार्या कलोडियन किंवा अन्य विद्रावाच्या संहतीवर (त्यातील विद्रुताच्या प्रमाणावर) अवलंबून असल्यामुळे वेगवेगळ्या आकारमानाची छिद्रे असलेली गालन पत्रे आता तयार होऊ लागलेली आहेत.
कलिलांचा रेणुभार निश्चित करणे : कलिल विद्रावाचा तर्षण दाब (विद्राव आणि विद्रावक, पातळ पटलामुळे अलग केले असताना जर फक्त विद्रावक रेणूच पटलातून पार जाऊ शकत असतील, तर निर्माण होणारा जास्तीत जास्त दाब) बराच कमी असतो. यावरुन त्याचा रेणुभार बराच जास्त असला पाहिजे. कलिल कण सरासरीने हायड्रोजन अणूपेक्षा किती पट जाड आहे, त्या जडत्वदर्शक अंकास त्याचा रेणुभार म्हणतात. कलिलात कमी रेणुभाराच्या (आयनी वा इतर) अशुद्धी असल्यास त्यांचा कलिलाच्या रेणुभारमापनात अडथळा होतो. उदा., ०.०५% मिठामुळे हीमोग्लोबिन कलिलाचा रेणुभार ६६,००० वरून तर्षण दाब पद्धतीत अर्ध्याने घसरतो. आयनी अशुद्धीचा परिणाम कमी करण्यासाठी डॉनन समतोलाचा उपयोग करतात [→तर्षण].
कलिलांचे रेणुभार जास्त असल्यामुळे त्यांच्यामुळे विद्रावकाच्या उकळबिंदूत किंवा गोठणबिंदूत फारसा फरक पडत नाही. तसेच कलिल विद्रावातील आयनी अशुद्धी रेणुभाराच्या या उकळ किंवा गोठण बिंदूमापन पद्धतींतही अडथळा निर्माण करतात. यामुळे कलिलांचे रेणुभार ठरविण्यासाठी या पद्धतींचा उपयोग करता येत नाही.
हर् झाॅग यांनी कलिलांचे रेणुभार काढण्यासाठी विसरण-गुणांकांच्या पद्धतीचा उपयोग केला. विसरण-गुणांक खालील समीकरणाने दिला जातो.
| D = | RT | … … …. (१) |
| 6 π r N η |
ह्या समीकरणात D = विसरण-गुणांक, R = वायु-स्थिरांक, T = तापमान, N = ॲव्होगाड्रो संख्या (पदार्थाच्या रेणुभाराइतके ग्रॅम एककातील वस्तुमान असणार्या राशीमध्ये म्हणजे ग्रॅमरेणूमध्ये असणारी रेणूंची संख्या, सु. ६.१ X १०२३), r = कलिल कणाची त्रिज्या व n = श्यानता गुणांक [→ श्यानता]. कलिल कण जर गोलाकार असतील तर त्यांची त्रिज्या व ग्रॅमरेणवीय घनफळ खालील समीकरणाने जोडता येतील.
Mv = 4/3 π r3 N … …. …. (२)
ह्यात M हा कलिल कणांचा रेणुभार असून v हे एक ग्रॅम कलिल कणांनी व्यापलेले घनफळ आहे. समीकरण (१) मधून r चे मूल्य काढून ते समीकरण (२) मध्ये घातले म्हणजे पुढील समीकरण मिळेल.
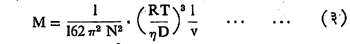
ह्या समीकरणाचा उपयोग करून हर्झॉग यांनी कलिल कणांचा रेणुभार काढला.
स्व्हेड्बॅरी यांनी अवसादन (कण खाली बसून साका होण्याच्या) पद्धतीन कलिल कणांचा रेणुभार काढला. द्रवात खाली बसण्याचा कणाचा वेग हा कणाच्या त्रिज्येवर, त्याच्या घनतेवर व द्रवाच्या श्यानतेवर अवलंबून असतो. कणाच्या अवसादनाचा वेग, कणाची त्रिज्या आणि द्रवाची श्यानता यांना जोडणारे सूत्र स्टोक्स यांनी पुढीलप्रमाणे मांडले :
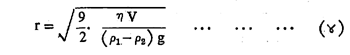
ह्या समीकरणात V= अवसादनाचा वेग म्हणजेच कणाचा खाली बसण्याचा वेग, η=द्रवाच्या श्यानतेचा गुणांक, g= गुरुत्वीय प्रवेग, P1=कलिल कणाची घनता आणि P2= द्रव माध्यमाची घनता. हे सूत्र फक्त गोलाकार कणांना व ज्या कणांचे अवसादन मुक्त रीतीने होते अशांच्याच बाबतीत वापरता येईल.
कलिलाच्या लहान कणांचे आकारमान वर दिलेल्या पद्धतींनी काढता येत नाही. लहान कणांना खाली खेचण्यास गुरुत्वाकर्षण प्रेरणा पुरेशी पडत नाही. ही प्रेरणा कृत्रिम रीत्या केंद्रोत्सारकाचा (केंद्रापासून दूर नेणाऱ्या प्रेरणेचा उपयोग करणाऱ्या साधनाचा) उपयोग करून वाढविली जाते. जेव्हा कण गुरुत्वाकर्षणाखाली मुक्तपणे द्रवात खाली येतो तेव्हा त्यावर दोन प्रेरणा विरुद्ध दिशेने कार्य करीत असतात. पाहिली म्हणजे गुरुत्वाकर्षण प्रेरणा व दुसरी म्हणजे द्रवाच्या श्यानतेवर अवलंबून असलेली घर्षण प्रेरणा. केंद्रोत्सारकाच्या पद्धतीत गुरुत्वाकर्षण प्रेरणेची जागा केंद्रोत्सारित प्रेरणा घेते. याकरिता वापरण्यात येणारे समीकरण पुढीलप्रमाणे दिले आहे :
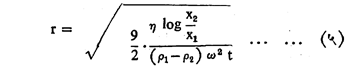
ह्या समीकरणात x१ हे कणाचे केंद्रबिंदूपासून सुरुवातीचे अंतर, x२ हे कणांचे t ह्या वेळानंतर केंद्रबिंदूपासूनचे अंतर, p1 आणि p2 अनुक्रमे कणाची व माध्यमाची घनता आणि ω म्हणजे कोनीय वेग होय. जर कण गोलाकार असेल व त्याची त्रिज्या r ही ज्ञात असेल तर त्याचे घनफळ 4/3 π r3 इतके येईल. कलिल कणाची घनता p1 कळल्यावर त्या कलिल कणाचे वजन m=4/3 π r3 p1 कळेल व त्याला ऍव्होगाड्रो संख्येने गुणल्यावर रेणुभार मिळेल. जर कण गोलाकार नसतील तर ही पद्धत वापरता येणार नाही.
अतिकेंद्रोत्सारणाचा (अति-उच्च वेगाच्या केंद्रोत्सारणामुळे कलिल व तत्सम लहान कणांचे अवसादन) होण्याच्या क्रियेचा वापर करून कलिलांचे रेणुभार काढता येतात. या पद्धतीत अवसादन समतोलाचा उपयोग करतात. चक्रिय गती काही वेळ चालू ठेवल्यास, केंद्रापासून दूर जाण्यास कारणीभूत होणारी केंद्रोत्सारी प्रेरणा व कणांची त्याविरुद्व विसरण पावण्याची प्रवृत्ती यांत समतोल साध्य होईल. समतोल साध्य झाल्यावर केंद्रबिंदूपासून वेगवेगळ्या अंतरांवरील कणांची संख्या स्थिर राहील. ह्या तत्त्वाचा उपयोग करून स्व्हेड्बॅरी यांनी कलिलांचा रेणुभार काढला व त्यासाठी पुढील समीकरण त्यांनी वापरले :
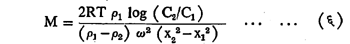
यात C2 = केंद्रबिंदूपासून x2 ह्या अंतरावरील कणांची संहती आणि C1 = केंद्रबिंदूपासून x1 ह्या अंतरावरील कणांची संहती. ह्या पद्धतीत तापमान T स्थिर ठेवलेले असते. त्यामुळे वेगवेगळ्या अंतरांवरील कणांची संहती फक्त चक्रीय गतीनेच बदलते.
या पद्धतीतील समतोल स्थापण्यास पूर्वी कित्येक दिवस किंवा आठवडे लागत. तेवढया अवधीत बर्याच वेळेस कलिल विद्रावांचे अपघटन होत असे. या पद्धतीत केल्या गेलेल्या यांत्रिक व प्रकाश तंत्राच्या सुधारणेमुळे आता वेगवान चक्रीय गतीने एका लहान घटात केंद्रोत्सारी प्रेरणा व कणांची विरुद्ध दिशेने विसरण पावण्याची प्रवृत्ती यांतील हा समतोल २–३ तासांत प्रस्थापित करतो येतो. मेसेलसन, स्टाल व विनोग्राद यांनी असे दाखविले की, सिझियम क्लोराइड जलमाध्यमात विरघळवून तयार कलिलाचा लहान थर प्रारंभी पसरविला तर रेणुभार बिनचूक व अल्पावधीत मोजता येतो.
विनोग्राद यांनी अवसादन वेगमापन पद्धतीत माध्यम म्हणून जडपाणी (D2O) वापरले. त्यावर कलिल मिश्रणाचा थर टाकून मोठी चक्रीय गती दिल्यावर कलिल मिश्रणातील घटकांचे कलिलांच्या वाढत्या रेणुभारानुसार केंद्रापासून वाढत्या अंतरावर भिन्नभिन्न पट्टे मिळाले. तंबाखूतील मोझाइक व्हायरसमधील डीऑक्सिरिबोन्यूक्लिइक अम्ल [डीएनए, → न्यूक्लिइक अम्ले] या बहुमोल घटकाचा रेणुभार या पद्धतीने काढला गेला.
काही कलिलांचे रेणुभार वानगीदाखल दिले आहेत. मानवरक्तातील हीमोग्लोबिन ६३,०००, पेप्सीन ३५,५००, इन्शुलीन ४१,०००, क्षयजंतूचे प्रथिन ३२,०००.
अतीत सूक्ष्मदर्शक व इलेक्ट्रॉन सूक्ष्मदर्शक यांच्या साहाय्याने कलिलांचा अभ्यास : अणू, रेणू वा कलिल कण नेहमीच्या सूक्ष्मदर्शकातून दिसू शकत नाहीत. कलिल कणांमुळे प्रकाशाचे जे प्रकीर्णन होते त्याच्या साहाय्याने कणांचे आकारमान, लांबी, रुंदी यांचा अभ्यास करता येतो. उदा., कलिल विद्रावाला येणारा रंग हा त्यातील कणाच्या आकारमानावर अवलंबून असतो. प्रकाशाच्या ज्या तरंगलांबीच्या तरंगाचे प्रकीर्णन होते ते कणांच्या आकारमानावर अवलंबून असते व कलिल विद्रावाला येणारा रंग हा ह्या प्रकीर्णनावरच अवलंबून असतो. कलिल कण जर गोलाकार आहेत असे मानले, तर निरनिराळ्या कलिल विद्रावांना येणार्या रंगावरून कलिल कणांचे आकारमान आपल्याला काढता येईल. माय, शुमन व फिक यांनी असा प्रयत्न करून सिल्व्हर व मर्क्युरी सोलमधील कलिल कणांचे आकारमान काढले. विद्रावाला येणार्या रंगावरुन कलिल कणांचे आकारमान काढण्याबाबतचे सिद्धांत अतिशय क्लिष्ट आहेत. ही आकारमान काढण्याची पद्धत दरवेळेस फलदायी होईलच असे नाही. अपस्करण माध्यम व कलिल कण यांच्या प्रणमनांकांत (वक्रीभवनांकांत) जेवढा अधिक फरक, तेवढे कणांनी होणारे प्रकाशाचे प्रकीर्णन अधिक. द्रवद्वेषी कलिलाचा प्रणमनांक अपस्करण माध्यमापेक्षा बराच जास्त असतो. त्यामुळेच द्रवद्वेषी कलिलांमुळे प्रकाशाचे प्रकीर्णन जास्त होते. द्रवस्नेही कलिलांचा प्रणमनांक प्राय: माध्यमाएवढाच असल्यामुळे असे कलिल विद्राव अल्प प्रकीर्णन करतात.
झीडेन्टोफ व झिगमोंडी यांनी १९०३ मध्ये प्रकाश प्रकीर्णनाचा उपयोग करून अतीत सूक्ष्मदर्शक बनविला.

प्र. या केंद्रापासून निघणारा प्रकाश भ१ या भिंगामुळे एकवटला जातो. फ या अरुंद फटीतून घेतलेला त्याचा अल्पभाग भ२ या भिंगाने कलिल भरलेल्या घटातून जाताना केंद्रित केला जातो. घटात कलिल कणांनी प्रकीर्णित केलेला प्रकाश हा त्याच्या पथाला काटकोन करणार्या दिशेने स ह्या सूक्ष्मदर्शकातून पाहिला जातो. कलिल कण तेजस्वी बिंदूप्रमाणे दिसतात. माध्यमाची पृष्ठभूमी मात्र काळीच राहते. कलिल विद्राव पाण्याने विरल करून तो घटात घेऊन घटाच्या घनफळात असलेल्या व केंद्रित प्रकाशाच्या प्रकीर्णनाने दिसणार्या कलिल कणांची संख्या मोजतात. त्यावरुन एक लिटर मूळ सोलमधील कणंसख्या काढता येते. तेवढया सोलमध्ये किती वजनाचे कलिल द्रव्य घेतले आहे आणि त्याची घनता किती आहे, हे माहीत असल्यास प्रत्येक कणाचे वजन व आकारमान मिळू शकते.
अतीत सूक्ष्मदर्शकातून कलिल कणांकडे पाहिल्यास ते सातत्याने इतस्तत: भटकताना दिसतात. १८२७ मध्ये ब्राउन ह्या वनस्पतिशास्त्रज्ञांनी परागकणांची ‘गती सूक्ष्मदर्शकातून प्रथम पाहिली कणांच्या अशा (तापजन्य) गतीला ब्राउनीय गती असे नाव दिले आहे. कलिल कणांवर पाण्याच्या रेणूंचा सतत मारा होत असल्याने त्या कणांना ही गती मिळालेली असते. कोणत्याही कणाला त्याच्या तापमानानुसार गती ही असतेच. कणाने ब्राउनीय गतीने t ह्या वेळात कापलेले अंतर जर Δ असेल व विसरण –गुणांक D असेल, तर कणाची त्रिज्या r, वायुस्थिरांक R, तापमान T, ॲव्होगाड्रो संख्या N व माध्यमाचा श्यानता गुणांक η आहे असे समजल्यास त्यांतील संबंध दर्शविणारी समीकरणे पुढीलप्रमाणे आहेत :
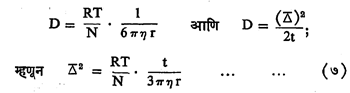
ह्यांतील N सोडून बाकीच्या सर्व गोष्टी माहीत असल्यामुळे N चे मूल्य काढता येते.
इलेक्ट्रॉन सूक्ष्मदर्शकातून कलिल कणांचे आकारमान व लांबीरुंदी आदीची माहिती मिळविता येते. इलेक्ट्रॉनांच्या अंगी तरंगाचे गुणधर्मही असतात. समकेंद्री विद्युत् क्षेत्रे व चुंबकीय क्षेत्रे यांमुळे इलेक्ट्रॉन तरंग वाकविता येतात व एका बिंदूत केंद्रित करता येतात. इलेक्ट्रॉन तरंगाचे विद्युतीय वा चुंबकीय क्षेत्रांनी प्रणमन (वक्रीभवन) होते. इलेक्ट्रॉन तीव्र वर्चसाने (५०,००० — ६०,००० व्होल्ट) प्रवेगित करुन निर्वात उपकरणात कलिलाच्या पातळ थरातून जाऊ देतात. कलोडियनाच्या पातळ पत्र्यावर प्रथम कलिल विद्रावाचा थर दिलेला असतो व तो नंतर सुकवून कलिलाचा पातळ थर केला जातो. नंतर हे तरंग पडद्यावर घेण्यात येतात. इलेक्ट्रॉनांच्या मार्गतील वस्तूंच्या छाया पडद्यावर पडतात. पडद्याला लावलेले रसायन इलेक्ट्रॉन तरंगांनी उद्दीपित झाले म्हणजे चमकते. म्हणून तरंग अडविले गेल्यास पडद्यावर अडथळ्याच्या आकारमानानुसार छाया पडते. इलेक्ट्रॉन तरंगाची लांबी ०⋅०५ Åइतकीच (Å म्हणजे अँगस्ट्रॉम एकक = १०-८ सेंमी.) असल्याने मोठे रेणू, कलिल कण आदीचे अवलोकन इलेक्ट्रॉन सूक्ष्मदर्शने करता येते [→ इलेक्ट्रॉन सूक्ष्मदर्शक].
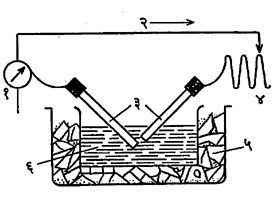
द्रवद्वेषी कलिले : विद्युतीय गुणधर्म : द्रवद्वेषी कलिल विद्रावातील कलिल कण विद्युत् क्षेत्रामध्ये एका ठराविक दिशेने सरकताना आढळतात. यावरून कलिल विद्रावातील कलिल कण विद्युत् भारित असतात असे अनुमान काढता येते. विद्युत् वर्चसामुळे होणार्या कलिल कणांच्या संचलनास विद्युत निस्सरण म्हणतात. विद्युत निस्सरण पुढील प्रयोगाने दाखविता येईल (आ.५). इंग्रजी यू (U) अक्षराच्या आकाराच्या एका नलिकेच्या तळाशी फेरिक हायड्रॉक्साइडाचा सोल घेऊन त्यावर शुद्व पाणी हळूहळू सोडल्यास पाणी व सोल यांना विलग करणारी सीमा स्पष्ट दिसेल. दोन विद्युत् अग्रे ह्या पाण्यात बुडतील अशी ठेवल्यास विद्युत वर्चसामुळे हायड्रॉक्साइड सोलमधील कलिल कणांचे संचलन होईल व त्यांमुळे सोल व पाणी यांना विलग करणारी सीमा कलिल कणावरील भाराच्या विरोधी विद्युत अग्राकडे सरकताना.दिसेल. एक व्होल्ट / सेंमी. अशा विद्युत् वर्चस पतनामुळे मिळणार्या कलिल कणाच्या गतीस विद्युत् निस्सरण गती म्हणतात.

कलिल कणांवर विद्युत भार आढळ्तो. त्याची उपपत्ती पुढीलप्रमाणे आहे: द्रवद्वेषी कलिलात त्या कलिलाच्या स्थैर्यासाठी विद्युत् विच्छेद्य अल्प प्रमाणात असावे लागते. अपस्करण माध्यमात विरघळलेल्या या विद्युत् विच्छेद्याच्या आयनीकरणामुळे (आयन सुटे होण्यामुळे) निर्माण झालेले धन व ऋण आयन कलिल कणांच्या पृष्ठभागावर अधिशोषित होतात. या अधिशोषणांमुळे कलिल कण विद्युत् भारित होतात. दोन समभारित कलिल कणांमध्ये प्रतिसारण होते, त्यामुळे कलिल कण एकमेकांजवळ येऊ शकत नाहीत व त्यामुळे किलाटन होत नाही. म्हणजे कलिल कणांवरील विद्युत् भारास व कलिल विद्रावाच्या स्थैर्यास, विद्रावात अल्पप्रमाणात असलेले आयनच कारणीभूत असतात. ज्या भाराचे आयन अधिशोषित होतात त्याच्या विरुद्व भाराचे आयन हे विद्रावातच मुख्यत: विद्युत् भारित कणांजवळच राहतात.
विद्युत् विच्छेद्याचे अल्प प्रमाण द्रवद्वेषी कलिलाच्या स्थैर्यासाठी आवश्यक असते, परंतु विद्युत् विच्छेद्य जास्त प्रमाणात असेल तर मात्र कलिल कणांचे किलाटण होऊन अवक्षेप तयार होतो. वेगवेगळ्या विद्युत् विच्छेद्यांमुळे होणार्या कलिलांच्या अवक्षेपणासंबंधी बरेच संशोधन झालेले आहे. हार्डी व शुल्ट्से यांनी याबाबत पुढील नियम मांडला आहे : कलिल कणावरील विद्युत् भाराच्या विरुद्ध भाराचे आयन त्या कलिलाच्या अवक्षेपणासाठी विशेष परिणामी असतात व त्या आयनावरील संयुजा [अणूंची परस्परांशी संयोग पावण्याची क्षमता दर्शविण्यारा अंक, → संयुजा] जितकी जास्त तितका तो आयन कलिलाच्या अवक्षेपणासाठी ऋण जास्त परिणामी ठरतो. म्हणजे कलिल कण जर धन भारित असतील तर त्यांच्या अवक्षेपणासाठी ऋण भारित आयन जास्त परिणामी ठरतील व जितकी त्या ऋण भारित आयनाची संयुजा जास्त तितका तो आयन अवक्षेपणासाठी ऋण भारित आयन जास्त तितका तो आयन अवक्षेपणासाठी जास्त परिणामी होईल. म्हणजेच त्या आयनाचे थोडेसेच प्रमाण अवक्षेपणासाठी पुरेसे होते. उदा., फेरिक हायड्रॉक्साइड सोलच्या अवक्षेपणासाठी लागणार्या वेगवेगळ्या ऋण भारित आयनांचे कमीत कमी प्रमाण पुढीलप्रमाणे आहे.
| विद्युत् विच्छेद्य | आयन संयुजा | फेरिक हायड्रॉक्साइड सोल (कलिल कण धन भारित) अवक्षेपणासाठी लागणारी आयनाची कमीत कमी संहती (मिलिमोलमध्ये) |
| पोटॅशियम क्लोराइड
पोटॅशियम डायक्रोमेट पोटॅशियम फेरिसायनाइड |
१
२ ३ |
१०३.०००
०.३२५ ०.०९०६ |
कलिल कण धन वा ऋण आयन अधिशोषित करतात हे वर सांगितलेच आहे. हे आयन कलिल कणाभोवती दृढ व स्थिर, धन वा ऋण अशा विद्युत भाराचे स्तर बनवितात. या विद्युत भारित कणांभोवती त्या भाराच्या विरुद्व भाराचे आयन द्रव वा अपस्करण माध्यमामध्ये विरुद्व भाराचा दुसरा स्तर बनवितात. अशा तर्हेने हेल्महोल्ट्स यांनी सुचविल्याप्रमाणे धन वा ऋण भाराचा एक विद्युतीय द्विस्तर तयार होतो. द्रवातील विद्युत भाराचा स्तर किंचितसा विसृत (विसरण झालेला) व विसरणशील असतो. या स्तरामध्ये जास्त करुन कणावरील भाराच्या विरोधी भाराचेच आयन असतात व या स्तराचा परिणामी भार कणावरील भाराएवढाच असतो. यामुळे स्थिर व दृढ स्तर आणि विसरणशील व किंचितसे विसृत स्तर यांच्या विलगीकरणसीमेवर आणि द्रवाचे अंग यांमध्ये एक प्रकारचे विद्युतीय वर्चस तयार होते. याला झीटा वर्चस किंवा विद्युतीय शुद्व-गतिकी वर्चस म्हणतात. तथापि पाहिलेच नाव वापरण्याचा प्रघात आहे. हे वर्चस ζ (झीटा) या ग्रीक अक्षराने दर्शवितात.
या विद्युतीय द्विस्तरामुळे कलिल विद्रावाच्या स्थैर्याचे स्पष्टीकरण शक्य होते. दोन स्तरांच्या परस्परांतील प्रतिसारणामुळे दोन कण एकत्र येऊन किलाटित होऊ शकत नाहीत. तसेच हे झीटा वर्चस् जितके जास्त तितके त्या कलिल विद्रावाचे स्थैर्य जास्त. शुल्ट्से आणि हार्डी यांचा नियम देखील या विद्युतीय द्विस्तरावर स्पष्ट करता येईल . ज्यावेळी कणावर असलेल्या भाराच्या विरोधी भाराचे आयन अधिशोषित होतील त्या वेळी झीटा वर्चस् कमी होऊन दोन कणांचे परस्परांतील प्रतिसारण कमी होऊन दोन आयन एकत्र येऊन मोठा कण तयार करु शकतील व अशा तर्हेने किलाटन होऊ शकेल. त्याचप्रमाणे विरोधी भाराच्या एक संयुजी आयनांपेक्षा अधिक संयुजी आयनांपेक्षा अधिक संयुजी आयन जास्त लवकर झीटा वर्चस् कमी करतील व त्यामुळे या आयनांच्या किलाटनासाठी लागणारे कमीत कमी प्रमाण एक संयुजी आयनांच्या मानाने कमी असते.
ज्यावेळी बाहेरून विद्युत वर्चस दिले जाते त्यावेळी कलिल कण त्यांच्या अधिशोषित केलेल्या आयनांसह संचलन करतात, या गोष्टीस विद्युत् निस्सरण म्हणतात. विद्युत् क्षेत्रातील आयनाचा वेग (u), बाहेरुन दिलेले विद्युत् वर्चस् (E), झीटा वर्चस (ζ) , माध्यामाचा विद्युत् अपार्यता स्थिरांक (K, एकक वर्चस् पाताकरिता एकक घनफळात साठविलेली स्थिर विद्युतीय ऊर्जा दर्शविणारा अंक) व माध्यामाचा श्यानता गुणांक (η) यांचा संबंध दर्शविणारे समीकरण पुढीलप्रमाणे आहे.
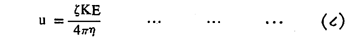
दंडगोल कलिल कणांऐवजी गोलाकार कणांसाठी वरील सूत्रात छेदस्थानातील चाराऐवजी सहा घ्यावेत. वरील समीकरणारून असे दिसून येईल की, इतर सर्व गोष्टी स्थिर असल्यास विद्युत क्षेत्रातील आयनांची संचलन गती झीटा वर्चसावर अवलंबून असते. हे झीटा वर्चस् जितके जास्त तितका कणांचा संचलन वेग जास्त. हे समीकरण वापरुन काही कलिल कणांचे काढलेले झीटा वर्चस व संचलनाचा वेग खाली दिला आहे.
|
कलिल |
विद्युत् निस्सरणीय संचलनाचा वेग (सेंमी. / सेकंद / व्हेल्ट / सेंमी. |
झीटा वर्चस् (व्होल्ट) |
|
प्रशियन ब्ल्यू सुवर्ण कलिल फेरिक हायड्रॉक्साइड |
४ x १०-४ ३.९ X १०-४ ३ x १०-४ |
– ०.०५८ – ०.०५६ + ०.०४४ |
विद्युत् क्षेत्रातील आयनांची गती व कलिल कणांची गती यांत फारसा फरक नसतो, पण कणांचे संख्याबल कमी असल्यामुळे सोलची विद्युत् संवाहकता लवण विद्रावांपेक्षा बरीच कमी असते.
वरील समीकरणात जर दिलेले विद्युत क्षेत्र एक व्होल्ट/सेंमी. असेल, तर मिळणारी संचलन गती ही विद्युत् निस्सरण गती असते.
कलिल कण हळूहळू सान्निध्यात येताना त्यांतील अंतर व त्यांतील आकर्षण व प्रतिसारण अनेक प्रकारे बदलू शकते. त्यांतील दोन नमुने खाली दिले आहेत (आ. ६).
एकमेकांपासून फार दूर असणार्या दोन (अ किंवा य च्या उजवीकडे) कणांत आकर्षण नसते. नंतर ते सुरु होऊन प्रथम (आ किंवा र पर्यत) वाढत जाते व पुन्हा घटू लागून त्याचे प्रतिसारणात रुपांतर होते. प्रतिसारण इ किंवा ल पर्यत वाढून ते नंतर. (ई आणि व पर्यत) घटून जेव्हा कण फारच जवळ येतात तेव्हा प्रकर्षाने वाढत जाते.
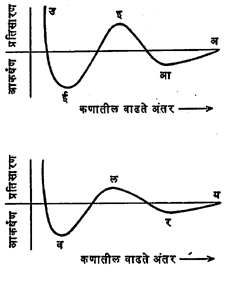 ल ची उंची कमी असल्याने या प्रतिसारण उंचवटयावर अधिम वेगवान कण मात करतात आणि ते ल पासून व भागात येतात. व ची खोली पुरेशी असल्यास कण या अंतरावर असताना त्यांतील प्रतिसारण गेलेले असल्याने व्हॅन डर व्हाल्स आकर्षणाने (व्हॅन डर व्हाल्स यांनी शोधून काढलेल्या, रेणूंतील दुर्बल आकर्षण प्रेरणांनी) ते बद्व होऊन त्यांचे गट बनू लागतात व सरतेशेवटी किलाटन होते. ल ची उंची जेवढी कमी तेवढे कणांच्या टकरीमध्ये संघटन होण्याची प्रवृत्ती अधिक असते. ल बिंदू प्रतिसारणाच्या बाजूस नसून क्कचित आकर्षणाच्या बाजूसही असू शकतो आणि असे असल्यास किलाटन त्वरेने होते. कारण प्राय: प्रत्येक टकरीत कण भेटताच त्यांची पुन्हा ताटातूट होत नाही. याउलट पहिला उंचवटा (इ) उंच व अधिक उभट असल्यास या उंचवटयाहून कमी अंतरावर कणास येणे शक्य होत नाही. कणांत इतके प्रतिसारण असते की, मीलन व किलाटन शक्य नसते. पण आ ची खोली फार असल्यास आ आकर्षण खळग्यातून कणांना पुन्हा दुरावणे कठीण होते. आ खोल असताना तात्पुरते किलाटन घडते पण अशा किलाटित पदार्थाचे पुन्हा सोलमध्ये रुपांतर करता येते. झीटा वर्चस जेवढे अधिक तेवढी पहिल्या प्रतिसारण उंचवटयाची उंची अधिक आणि सोलचे स्थैर्य अधिक.
ल ची उंची कमी असल्याने या प्रतिसारण उंचवटयावर अधिम वेगवान कण मात करतात आणि ते ल पासून व भागात येतात. व ची खोली पुरेशी असल्यास कण या अंतरावर असताना त्यांतील प्रतिसारण गेलेले असल्याने व्हॅन डर व्हाल्स आकर्षणाने (व्हॅन डर व्हाल्स यांनी शोधून काढलेल्या, रेणूंतील दुर्बल आकर्षण प्रेरणांनी) ते बद्व होऊन त्यांचे गट बनू लागतात व सरतेशेवटी किलाटन होते. ल ची उंची जेवढी कमी तेवढे कणांच्या टकरीमध्ये संघटन होण्याची प्रवृत्ती अधिक असते. ल बिंदू प्रतिसारणाच्या बाजूस नसून क्कचित आकर्षणाच्या बाजूसही असू शकतो आणि असे असल्यास किलाटन त्वरेने होते. कारण प्राय: प्रत्येक टकरीत कण भेटताच त्यांची पुन्हा ताटातूट होत नाही. याउलट पहिला उंचवटा (इ) उंच व अधिक उभट असल्यास या उंचवटयाहून कमी अंतरावर कणास येणे शक्य होत नाही. कणांत इतके प्रतिसारण असते की, मीलन व किलाटन शक्य नसते. पण आ ची खोली फार असल्यास आ आकर्षण खळग्यातून कणांना पुन्हा दुरावणे कठीण होते. आ खोल असताना तात्पुरते किलाटन घडते पण अशा किलाटित पदार्थाचे पुन्हा सोलमध्ये रुपांतर करता येते. झीटा वर्चस जेवढे अधिक तेवढी पहिल्या प्रतिसारण उंचवटयाची उंची अधिक आणि सोलचे स्थैर्य अधिक.
अव्युत्क्रमी कलिले : या वर्गात पायस (एकमेकांत न मिसळणार्या दोन द्रवाचे मिश्रण), फेस व पेस्ट यांचा समावेश करतात. पैकी पायसात अपस्करण माध्यम व अपस्कारित प्रावस्था ही द्रव स्थितीतच (उदा., कॉडलिव्हर ऑईल) असतात. पायसाचे पुढील दोन वर्गांत वर्गीकरण करता येते : (१) पहिल्या वर्गात तेल ही अपस्कारित प्रावस्था असून पाणी हे अपस्करण माध्यम असते. ह्यात पाणी (W) ही अखंड प्रावस्था असते. जे द्रव पदार्थ पाण्यात अमिश्रणीय आहेत त्यांचा पायसात तेले (O) असा उल्लेख केला जातो. पहिला वर्ग O/W असा दर्शवितात. (२) दुसर्या वर्गात पाणी ही अपस्कारित प्रावस्था असून तेल हे अपस्करण माध्यम असते. ह्या प्रकारच्या पायसात तेल ही अखंड प्रावस्था आहे. हा वर्ग W/O असा दर्शवितात. पायसांच्या स्थैर्यासाठी तिसर्या पदार्थाची उपस्थिती बर्याच वेळेला आवश्यक असते. त्या पदार्थाला पायसीकारक असे म्हणतात [→ पायस].
फेसामध्ये वायू ही अपस्कारित प्रावस्था असून द्रव पदार्थ हा अपस्करण माध्यम असतो. फेस काही वेळ स्थिर राहण्यासाठी तिसर्या पदार्थाची उपस्थिती आवश्यक असते. त्या पदार्थास फेनकारक असे म्हणतात. शुद्ध द्रव पदार्थ फेस देत नाहीत पण फेनकारकाच्या उपस्थितीत मात्र फेस होतो. उदा., पाण्यात साबण घातल्यावर आपणास फेस मिळतो. साबणाप्रमाणेच प्रथिने, जिलेटीन हे फेनकारक पदार्थ आहेत.
द्रव पदार्थात जर अतिसूक्ष्म असे घन पदार्थाचे कण बर्याच प्रमाणात मिसळले तर पेस्ट तयार होते. ह्या पेस्टमध्ये द्रव पदार्थ ही अखंड प्रावस्था व अपस्करण माध्यम असते आणि घन पदार्थ ही अपस्कारित प्रावस्था असते. टूथ-पेस्ट हे पेस्टचे सामान्य उदाहरण होय. रंग, सिमेंट, इ. पदार्थ वापरण्यासाठी पेस्टच्या स्वरूपात तयार करावे लागतात. पेस्टची प्रवाहिता ही नुसती घन पदार्थांच्या संहतीवर अवलंबून नसते, तर धन पदार्थाच्या कणांच्या आकारमानावर तसेच त्यांच्या विभाजनावर आणि तयार होणार्या कलिल विद्रावाच्या स्थैर्यावर अवलंबून असते. काही पेस्ट क्षोभ प्रवाहित्व दाखवितात म्हणजे ढवळल्यावर त्या पेस्ट पातळ होतात व ढवळणे थांबल्यावर हळूहळू घट्ट होतात. उदा., रंगाच्या कलिल विद्रावात क्षोभ प्रवाहित्व असणे आवश्यक आहे, त्यायोगे रंग देणे सोपे होते.
द्रवस्नेही कलिले : जिलेटीन, ⇨आगर, गोंद इ. जलस्नेही कलिलांचे कलिल विद्राव सहज करता येतात. वरील पदार्थ शुष्क अवस्थेत पाण्याच्या सान्निध्यात ठेवले असताना त्यांचा कलिल विद्राव तयार होतो. ह्या प्रकारच्या कलिल विद्रावात कलिल कणांवर द्रवाचे एक संरक्षक कवच तयार होते. कलिल कणांबरोबर अपस्करण माध्यमाचे कण जोडले गेल्यामुळेच या कलिल विद्रावांचा श्यानता गुणांक अपस्करण माध्यमापेक्षा जास्त असतो.
जलद्वेषी कलिलांच्या स्थैर्यासाठी विद्युत् विच्छेद्यांचे अल्पप्रमाण आवश्यक असते तसे ते जलस्नेही कलिलांच्या स्थैर्यासाठी आवश्यक नसते. कलिल विद्रावात कित्येक वेळा जास्त रेणुभार असलेल्या संयुगांचे रेणूच, उदा., प्रथिने, कलिल कण म्हणून वावरत असतात, तर काही वेळेस रेणूंच्या संगमनाने कलिल कण तयार होतात. द्रवस्नेही कलिले काही वेळेस विद्युत् निस्सरण दाखवितात. या द्रवस्नेही कलिलांत कलिल कणांवरील विद्युत् भाराची उपपत्ती पुढीलप्रमाणे आहे : काही वेळेस कलिल कणांच्या आयनीकरणामुळे कलिल कण विद्युत् भारित होतात, तर काही वेळेस अपस्करण माध्यमातील आयन कलिल कणाच्या क्रियाशील गटाशी संयोगित झाल्यामुळे कलिल कण विद्युत् भारित होतात. उदा., प्रथिने किंवा त्याच्याशी संबंधित पदार्थाची विद्युत् क्षेत्रातील दिशा माध्यमाच्या pH मूल्यावर [अम्लता आणि क्षारकता, म्हणजे विकिया झाल्यास लवण देणार्या पदार्थाचे गुणधर्म असण्याची क्षमता, दर्शविणाऱ्या मूल्यावर, → पीएच मूल्य] अवलबूंन असते. प्रथिने ही ऍमिनो अम्लांची बनलेली असतात आणि ती NH2 – R – COOH ह्या सर्वसाधारण संज्ञेने दाखविता येतात. जेव्हा अपस्करण माध्यम अम्लीय असेल त्या वेळेला माध्यमातील H+ आयन – NH2 ह्या क्रियाशील गटाशी संयोगित होऊन प्रथिन कण धन भारित करतील व तयार होणारा कण NH3+ – R – COOH असा दाखविता येईल. विद्युत् क्षेत्रात हा आयन ऋण अग्राकडे आकर्षिला जाईल. क्षारीय (अल्कलाइन) माध्यमात – COOH ह्या क्रियाशील गटाचे आयनीकरण होईल व तयार होणारा कण NH2 – R – COO- ऋण भारित असून विद्युत् क्षेत्रात तो धन अग्राकडे आकर्षिला जाईल. अम्लीय माध्यमात प्रथिन कणावरील भार धन असतो तर क्षारीय माध्यमात त्यावरील भार ऋण असतो. या दोहोंमधील एका विशिष्ट pH मूल्याला प्रथिन कणावरील विद्युत् भार शून्य असतो, त्या वेळी प्रथिन कण NH3+ – R – COO- ह्या स्वरूपात असतो. ह्या वेळी विद्युत् क्षेत्रामध्ये तो संचलन दाखविणार नाही. ह्या अवस्थेला समविद्युती अवस्था म्हणतात. वेगवेगळी प्रथिने समविद्युती अवस्थेत आणण्यासाठी pH चे वेगवेगळे मूल्य असते.
द्रवस्नेही कलिलांत प्रवाहीपणा कमी असतो. गोलाकार कणांच्या सोलचा श्यानता गुणांक त्यांच्या प्रवाहाच्या गतीच्या प्रमाणात वाढत नाही. यासंबंधी आइंस्टाइअन यांचे समीकरण पुढीलप्रमाणे आहे :
|
η |
– 1 = |
5 |
Φ |
… … … (९) |
|
η० |
2 |
ह्या समीकरणात η = कलिल विद्रावाचा श्यानता गुणांक, η० = अपस्करण माध्यमाचा श्यानता गुणांक व Φ अपस्कारित माध्यम आणि कलिल विद्राव यांच्या घनफळांचे गुणोत्तर. कलिल विद्रावांच्या श्यानता गुणांकासाठी सिन्हा, स्टॉडींजर आदींनी अधिक व्यावहारिक समीकरणे दिलेली आहेत.
द्रवस्नेही कलिलांच्या विद्युत् निस्सरणीय गतीचे सखोल अध्ययन ए. टिसेलियन यांनी केले. एका ठराविक अम्लतेला प्रत्येक प्रथिनाची विद्युत् निस्सरणीय गती विशिष्ट असल्यामुळे एखादे प्रथिन ओळखण्यास किंवा मिश्रणातील भिन्न प्रथिनांचे सापेक्ष प्रमाण काढण्यास टिसेलियस यांचे तंत्र फार उपयोगी पडते. यासाठी U आकाराची द्विशाखी नळी वापरतात. ती दोन भाग जोडून केलेली असून ते भाग विलग करता येतात. नलीचा छेद अरुंद काटकोन चौकोनी असतो. नळीच्या खालच्या भागात स्थिर अम्लतेच्या द्रवाबरोबर [उभयप्रतिरोधी (म्हणजे क्षारकीय व अम्लीय हे दोन्ही गुणधर्म असणारा) विद्राव] कलिल घेतात. नळीच्या वरच्या भागात तोच उभयप्रतिरोधी विद्राव घेतात. कलिल व उभयप्रतिरोधी विद्राव यांतील सीमा स्पष्ट दिसणे आवश्यक आहे. या सीमेचे जंबुपार (वर्णपटातील जांभळ्या रंगाच्या पलीकडील अद्दश्य अग्रे ठेवलेली असतात. आवश्यक तेवढा एकदिश विद्युत् प्रवाह U- नलिकेतून सोडला म्हणजे कलिल आणि उभयप्रतिरोधी विद्राव यांतील सीमा धन वा ऋन अग्राकडे सरकू लागते व या सरकण्याचा वेग मोजतात. त्यावरुन मिळणार्या आलेखात प्रत्येक घटकाचा पर्यायी उंचवटा मिळतो व त्या उंचवट्याचे क्षेत्रफळ मोजून मिश्रणातील घटकाचे सापेक्ष प्रमाण मिळविता येते. अशा प्रकारे विद्युत् निस्सरणाच्या अध्ययनाने प्रथिने आदींचा गुणात्मक व परिमाणात्मक बोध होऊ शकतो.
द्रवस्नेही कलिलात कलिल कणांचा रेणुभार अति-केंद्रोत्सारी पद्धतीने काढला जातो. द्रवस्नेही कलिलाचे अवक्षेपण पुढील पद्धतीने करतात. द्रवस्नेही कलिल विद्रावास दोन गोष्टींमुळे स्थैर्य आलेले असते. पहिली म्हणजे कणांवर असलेला विद्युत् भार व दुसरी म्हणजे या कणांभोवती असलेले द्रव माध्यमाचे संरक्षक कवच. द्रवस्नेही कलिलात कणांभोवती असलेले द्रवकवच नाहीसे केले, तर द्रवद्वेषी कलिलांप्रमाणे विद्युत् विच्छेद्याच्या साहाय्याने कलिल कणांचे अवक्षेपण करता येईल. हे संरक्षक कवच दोन प्रकारांनी नाहिसे करता येते. उदाहरण म्हणून जलस्नेही कलिल घेऊ. यात कलिल कणांभोवती जल माध्यमाचे आवरण असते. जर या जलस्नेही कलिलात अल्कोहॉल किंवा ॲसिटोन यांसारखे जलाकर्षी पदार्थ टाकले, तर कलिल कणांभोवती असलेले जलसंरक्षक कवच नष्ट होईल व विद्युत् विच्छेद्याच्या साहाय्याने कलिल कणांचे किलाटन करता येऊन त्यांचा अवक्षेप मिळविता येईल. विद्युत् विच्छेद्याचे जास्त प्रमाण जरी जलस्नेही विद्रावात मिसळले गेले, तरीदेखील कलिल कण अवक्षेपित करता येतील. यात विद्युत् विच्छेद्याचे आयनीकरण होते व ते आयन जल संयोगित होतात. त्यामुळे साहजिकच कलिल कणांना जलकवच तयार करण्यास लागणारे पाण्याचे प्रमाण कमी होते. अशा तऱ्हेने संरक्षक जलकवचाचा नाश होतो. कलिल कणाचे किलाटन होण्यास लागणारे आयनाचे कमीत कमी प्रमाण हे आयनाच्या संयुजेवर अवलंबून असते. वेगवेगळ्या धनायनांचा (धन विद्युत् अग्राकडे आकर्षिले जाणाऱ्या आयनांचा) किलाटनाबाबतचा क्रम पुढीलप्रमाणे लावता येईल :

वरील क्रमास हॉफ माइस्टर श्रेणी असे म्हणतात. वरील धनायन श्रेणीत किलाटनासाठी SO42- हे आयन जास्त परिणामी असून Cl- हे कमीतकमी परिणामी आहे. तसेच ऋणायन श्रेणीत Mg2+ आयन जास्त परिणामी आहेत.
द्रवद्वेषी कलिलात द्रवस्नेही कलिलाचा अल्पांश मिसळला तर द्रवद्वेषी कलिलास अस्थैर्य प्राप्त होते. द्रवद्वेषी कलिल कणांनी आपल्या भाराच्या विरोधी भाराच्या द्रवस्नेही कलिल कणांचे अधिशोषण केल्यामुळे हे अस्थैर्य उद्भवते. परंतु जर द्रवद्वेषी कलिलात द्रवस्नेही कलिल जास्त प्रमाणात टाकले तर मात्र ते द्रवद्वेषी कलिल आधिक स्थिर वा स्थायी होते. ही संरक्षणशीलता द्रवस्नेही कलिलाचा द्रवयुक्त असा थर द्रवद्वेषी कणांवर बसल्यामुळे येते. द्रवविरोधी कलिलांचे प्राय: द्रवस्नेही कलिलात रूपांतर होते. वेगवेगळ्या द्रवस्नेही कलिलांमुळे सोन्याच्या द्रवद्वेषी कलिलाची संरक्षणक्षमता दर्शविण्यासाठी झिगमोंडी यांनी सुवर्णांंकाचा उपयोग केला. सुवर्णांकाची व्याख्या पुढीलप्रमाणे करतात. विशिष्ट १० घ. सेंमी. विशिष्ट सुवर्ण सोलमध्ये १ घ. सेंमी. १०% मिठाचा विद्राव टाकल्यास गुलाबी सुवर्ण कलिल किलाटन पावून निळा अवक्षेप मिळतो. द्रवस्नेही कलिलाचे किती प्रमाण (मिग्रॅ. मध्ये) हे किलाटन रोखू शकेल हे सुवर्णाकाने दर्शवितात. काही द्रवस्नेही कलिलांचे सुवर्णाक पुढीलप्रमाणे आहेत: जिलेटीन ०⋅००५ ते ०⋅०१, बाभळीचा गोंद ०⋅१५, सोडियम ओलिएट ०⋅१ ते ०⋅४.
द्रवस्नेही कलिले प्रकाशाचे प्रकीर्णन कमी प्रमाणात करतात तरीही कलिल कणाने केलेल्या प्रकीर्णनाचे मापन करून कलिल कणाचे आकारमान ठरविता येते. याच मापनावरून कलिल कणाचा रेणुभार अचूकपणे काढता येतो. याकरिता वापरण्यात येणारे समीकरण पुढीलप्रमाणे आहे :
| HC | = | 1 | (1+2BC+… …) | … | (१०) |
| T | M |
वरील समीकरणात C कलिल विद्रावाची संहती (ग्रॅम/लीटरमध्ये), T विद्रावाचा गढूळपणा, M कलिल कणांचा रेणुभार, H आणि B हे स्थिरांक आहेत.
कलिल विद्रावाच्या श्यानता गुणांकासाठी आइनस्टाइन यांच्या समीकरणात २⋅५ ऐवजी स्थिरांकाचे जे मूल्य येते, त्यावरुनही द्रवस्नेही कलिल गोल, लांबट, अंडाकार का इतर आकाराचे आहे हे जाणून घेता येते. साखळ्या बनून कलिल तयार झाल्यास सोलच्या श्यानता गुणांकावरून स्टॉडीजर यांच्या समीकरणाने रेणुभार मिळतो. ते समीकरण पुढीलप्रमाणे :
[ η ] = KMa … … … (११)ह्या समीकरणात [ η ] = अंगभूत श्यानता गुणांक, M = रेणुभार व K आणि a हे स्थिरांक आहेत. K चे मूल्य विद्रावक व विद्रुत यांच्या रासायनिक गुणधर्मावर अवलंबून असते. दंडाकार कणासाठी a चे मूल्य १ च्या जवळ असते, तर तंतुप्राय कणमालिकेसाठी ते ०⋅५ इतके असते.
कार्बनी सोल : यामध्ये अपस्करण माध्यम म्हणून कार्बनी द्रवांचा उदा., अल्कोहॉल, बेंझीन, ईथर ह्यांचा उपयोग करतात. ब्रेडिक यांच्या सुधारलेल्या पद्धतीचा उपयोग करुन स्व्हेड्बॅरी यांनी कार्बनी द्रव माध्यम वापरुन कार्बनी सोल मिळविले. कार्बनी सोलचे कण अतीत सूक्ष्मदर्शकातून स्पष्ट दिसतात व ब्राउनीय गती दाखवितात. कार्बनी कलिल विद्राव अल्प व अनियमित विद्युत् निस्सरण दाखवितो. माध्यमाचे रेणू ध्रुवीय असल्यास किंवा माध्यमात पाण्याचा अल्पांश असला तरी कणावर विद्युत् भार संभवतो, कित्येक कार्बनी कलिलात प्रत्येक कलिल कण म्हणजे एक रेणूच असतो. मॅग्नेशियमाचा साबण व रबर हे अशा प्रकारचे कलिल विद्राव देतात. कार्बनी कलिलाचे स्थायित्व प्रामुख्याने संरक्षक द्रव कवचामुळेच असते. रेणवीय कार्बनी कलिल विद्रावात कलिल कणांचा रेणुभार अवाढव्य असतो.
जेल : कधीकधी किलाटनास आवश्यक परिस्थितीत कलिल कण घन माध्यम म्हणून विलग न होता, द्रव माध्यमातसुद्वा सर्व सोल घनरूप होतो, यास जेलीकरण (जेलेशन) म्हणतात. आगराचा जेल लवचिक असतो तर सिलिका जेल टणक असतो. सोडियम सिलिकेटाच्या जलीय विद्रावात अम्ल टाकल्यास जी सिलिका मिळते ती फार जलसंयुगी असल्यामुळे जेलरूप होते.हा जेल बराच शुष्क करता येतो. जेलामध्ये रेणूंची जाळी असून त्यात द्रव माध्यम बद्ध असते. काचेप्रमाणे दिसणार्या सिलिका जेलामध्ये

अशा साखळ्या असतात. या जेलामधून पाणी काढून टाकल्यावर त्यात रासायनिक विक्रियेस वेग देणारे उत्प्रेरक शोषून त्या विक्रियेची क्षमता वाढविता येते. जेव्हा शुष्क सिलिका जेलामध्ये पाणी शोषले जाते तेव्हा ते प्रारंभी अधिक त्वरेने व आसक्तीने शोषले जाते. याउलट जलयुक्त सिलिका जेलामधून पाण्याचे बाष्पीभवन फारच कमी वेगाने होते. सिलिका जेलाच्या शुष्कीकरण व जलसंयोग या क्रिया पुन:पुन्हा केल्यास त्या ह्याच प्रकारे होतात (आ. ७).
जेलांचे त्यांच्या गुणधर्मावरुन त्यांचे स्थितिस्थापक (लवचिक) जेल व अस्थितिस्थापक जेल असे वर्गीकरण करता येते. उदा., जिलेटीन हे स्थितिस्थापक जेलाचे उदाहरण होय. तर सिलिसिक अम्ल व जेलरूप हायड्रॉक्साइडाचे अवक्षेप ही अस्थितिस्थापक जेलांची उदाहरणे होत.

फेरिक ऑक्साइडाच्या संहत कलिल विद्रावात जर योग्य विद्युत विच्छेद्य अल्पप्रमाणात मिसळले, तर फेरिक ऑक्साइडाचा जेल तयार होतो. जेल हलवल्यास परत कलिल विद्राव मिळतो व हलवणे थांबविल्यास परत जेल तयार होतो. ही क्रिया पुन:पुन्हा करून सोल व जेल मिळविता येतात. अल्युमिना, व्हॅनेडियम पेंटॉक्साइड, झिकोंनियम डाय-ऑक्साइड, स्टॅनिक ऑक्साइड, इत्यादीचे कलिल विद्राव तसेच बेंटोनाइटाच्या अतिसूक्ष्म कणांचे निलंबन हा गुणधर्म दाखवितात व या गुणाला क्षोभ प्रवाहित्व म्हणतात.
समजा, एखाद्या जेलाने आपल्याला हवा तेवढा पुरेसा द्रव पदार्थ त्याच्या बाष्पाच्या स्वरूपात शोषून घेतलेला आहे. असा जेल त्या पदार्थात ठेवला तर तो आणखी द्रव शोषतो व फुगतो याला अंत:चोषण म्हणतात. द्रवात असणार्या विद्युत विच्छेद्याचा जेलाच्या फुगण्यावर परिणाम होतो. फुगण्याचा हा गुणधर्म काही स्थितिस्थापक जेलच दाखवितात. याउलट काही जेल जर वातावरणात उघडे ठेवले तर त्यांतील द्रव पदार्थाचे बाष्पीभवन होऊन जेलाचे आकारमान घटते याला सायनेरेसीस म्हणतात.
कलिलांचा एक विशेष वर्ग : कलिली विद्युत् विच्छेद्य : काही कलिलांच्या अतिसौम्य विद्रावात त्यांच्या रेणूंचे आयनीकरण होते. पण विद्रुताचे प्रमाण जसजसे वाढत जाते तसतसे ऋणायन व धनायन यांच्यात संगमन होऊन विद्रावातील कणांची संख्या झपाट्याने घटते. विद्रावातील कणसंख्येवर अवलंबून असणारे तर्षण दाब व विद्युतामुळे कमी होणारा विद्रावकाचा गोठण बिंदू हे गुणही त्या प्रमाणात घटू लागतात. साबण व सेटिल ट्रायमिथिल अमोनियम ब्रोमाइड ही या वर्गातील कलिलांची उदाहरणे होत. तथापि कलिल कण बनताना साबणाचा धनायनी हायड्रोकार्बनी भाग कणाच्या गाभ्यात लपतो व त्याचा आयनी भाग जलासक्तीमुळे पाण्याकडे गेलेला असतो. म्हणजे कलिल हा मोठा बहुभारित आयनच असतो आणि त्याचा आयनभार संगमित आयनांच्या भारांच्या बेरजेबरोबर असतो. म्हणून कलिल विद्रावाची संवाहकता बरीच मोठी असते. साबणाचा गोलाकार कण आ. ८ मध्ये दर्शविला आहे.
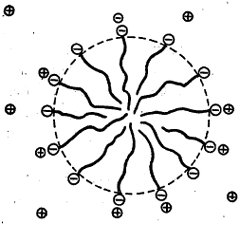
ज्या रेणूंत जलस्नेही (आयनीय) व जलद्वेषी (हायड्रोकार्बनी) भाग समतुल्य असतात. (माध्यमांच्या आकर्षण-प्रतिसारणाबाबत) तेच रेणू असे संगमित कलिल बनविताना आढळतात. भारताच्या नॅशनल केमिकल लॅबोरेटरीचे आद्य संचालक मॅकबेन यांनी संगमनाने कलिलभूत होणार्या आयनांचा व होणारे कलिल विद्युत् विच्छेद्य असल्याचा स्पष्ट पुरावा प्रथम मांडला.
|
संयुग |
संहती |
विद्युत् संवाहकतेत घट (%) |
कणातील संगमन संख्या |
|
पोटॅशियम लॉरेट सोडियम ओलिएट सोडियम पामिटेट |
२५.५ ०.०१ २.९ |
४२ ३३ ५८ |
६३ — — |
कृत्रिम विद्राव्यीकरण : एखादा पदार्थ दुसर्या द्रवात विरघळत नसल्यास त्याच्या विरघळण्यास होणारा विरोध दूर करून तो विरघळविता येतो.
यास कृत्रिम विद्राव्यीकरण म्हणतात. उदा., पाण्यात अविद्राव्य रंग प्रथम पाण्यात साबण विरघळवून त्यात विरघळविता येतो आणि त्याचा पातळ थर कपड्यावर लेपता येतो. या क्रियेत जलद्वेषी भाग पाण्याच्या संपर्कात न राहता संगमन कलिलाच्या जलद्वेषी भागांत (हायड्रोर्बनी भागांत) अवगुंठित होतो. म्हणून पाणी त्या रंगास पाण्याबाहेर हुसकून लावण्यास समर्थ ठरत नाही. कपडे धुताना कपड्यावरील धुळीचे कण वरील प्रकारेच विरघळविले जातात व परिणामत: पाण्यात वाहवून देता येतात.
संदर्भ : 1. Alexander, A. E.; Johnson, P. Colloid Science, 2. Vols., New York, 1952.
2. Alexander, J. Colloid Chemistry, Vol. 8, New York, 1926-46.
3. Bancroft, W. D. Applied Colloid Chemistry, New York, 1932.
4. Hartman, R. J. Colloid Chemistry, Boston, 1947.
5. Jirgensons, B. Straumanis, M. E. A Short Textbook of Colloid Chemistry, London, 1962.
करबेलकर, ना. वि.