कॅल्शियम : धातूरूप मूलद्रव्य रासायनिक चिन्ह Ca अणुक्रमांक (अणुकेंद्रातील प्रोटाॅनांची संख्या) २० अणुभार ४०⋅०८ विद्युत् विन्यास (इलेक्ट्रॉनांची अणूमधील मांडणी) २, ८, ८, २ आवर्त सारणी (मूलद्रव्यांची विशिष्ट पद्धतीने केलेली कोष्टकरुप मांडणी) गट २ वि. गु. १⋅५५ (२०० से. तापमानास) वितळबिंदू ८५०० से. उकळबिंदू १,४९०० से. नैसर्गिक समस्थानिकांचे (अणुक्रमांक तोच पण भिन्न अणुभार असलेल्या त्याच मुलद्रव्याच्या प्रकारांचे) अणुभार ४०, ४२, ४३, ४४, ४६, ४८. पृथ्वीच्या शिलावरणातील प्रमाण ३⋅६३% ; संयुजा [अणूंची परस्परांशी संयोग पावण्याची क्षमता, → संयुजा] २; रंग रुप्यासारखा पांढरा. धातू थोडी वर्धनशील (यांत्रिक पद्धतीने आकार बदलता येणारी) व तन्य (तार काढता येण्यासारखी) आहे.
इतिहास : इ. स. १८०८ साली डेव्ही यांनी असे दाखवून दिले की, चुना (लाइम) हा एका धातूचे ऑक्साइड आहे. त्या धातूला त्यांनी कॅल्शियम हे नाव दिले. त्यानंतर बऱ्याच (सु. ४५) वर्षांनी, ए. मॅथीसेन यांनी कॅल्शियम क्लोराइड, स्ट्राॅशियम क्लोराईड थोडे अमोनियम क्लोराइड यांच्या वितळलेल्या मिश्रणांचे विद्युत् विच्छेदन करून (विद्युत् प्रवाहाने घटक द्रव्ये वेगळी करून) कॅल्शियम धातू अल्प प्रमाणात मिळविली.
उपस्थिती : कॅल्शियम हे अती विक्रियाशील असल्यामुळे निसर्गात मूलद्रव्याच्या स्वरूपात आढळत नाही, पण संयुगाच्या स्वरूपात ते सर्वत्र आढळते. ⇨कॅल्साइट व ⇨ॲरॅगोनाइट ही खनिजे आणि चुनखडक हे मुख्यतः कॅल्शियम कार्बोनेटचे बनलेले असतात. कॅल्शियम हे प्राण्यांस व वनस्पतींस आवश्यक असे द्रव्य असून पोवळी व शंख-शिंपा यांसारखी कवचे व काही वनस्पतींचे सांगाडे ही कॅल्शियम कार्बोनेटाची बनलेली असतात. ⇨डोलोमाइट या पुष्कळ जागी आढळणाऱ्या खडकाचे रासायनिक संघटन CaMg(CO3)3 असते. हाडे, दात व कित्येक प्राण्यांची कवचे ही मुख्यतः कॅल्शियम फॉस्फेटाची बनलेली असतात. कॅल्शियम असलेली अनेक सिलिकेटे व इतर संयुगे पृथ्वीच्या कवचात आढळतात.
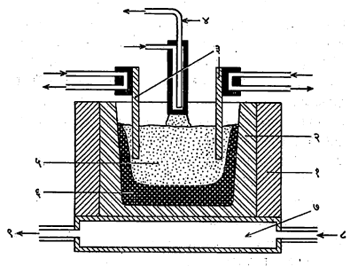
उत्पादन : विद्युत् रासायनिक श्रेणीत (सापेक्ष विद्युत् स्थितीनुसार लावलेल्या मूलद्रव्यांच्या श्रेणीत) कॅल्शियमाचे स्थान बरेच वरचे असल्यामुळे त्याच्या संयुगांचे ⇨क्षपण करून ते धातूच्या स्वरूपात मिळविणे अत्यंत कठीण असते. पूर्वी कॅल्शियमाचे जवळजवळ सर्व उत्पादन विद्युत् विच्छेदनाने होत असे, याकरिता वितळलेले, निर्जल कॅल्शियम क्लोराइड हे विद्युत् विच्छेद्य (ज्याचे विद्युत् विच्छेदन करावयाचे तो पदार्थ) म्हणून वापरले जाते. त्याचा वितळबिंदू कमी करण्यासाठी त्याच्यात थोडे कॅल्शियम फ्ल्युओराइड मिसळतात. विद्युत् विच्छेदनासाठी आकृतीत दाखविल्यासारखा घटाचा उपयोग करतात. पुढील समीकरणात दाखविल्यासारखे विच्छेदन होते :
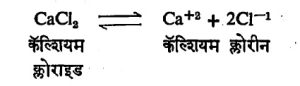
धनाग्रापाशी क्लोरीन व ऋणाग्रापाशी कॅल्शियम धातू ही विमुक्त होतात.
या घटामध्ये एका पोलादी टाकीच्या आतल्या बाजूवर (पहा : आकृती) ग्रॅफाइटाचा जाड लेप दिलेला असतो. त्याच्या आत असलेल्या रिकाम्या जागेत ज्याचे विद्युत् विच्छेदन करावयाचे ते कॅल्शियम क्लोराइड घालतात. प्रक्रियेचे तापमान जवळजवळ ८००० से. म्हणजे कॅल्शियम क्लोराइडाच्या वितळबिंदूपेक्षा किंचित अधिक, इतकेच राहील असे विजेचे नियंत्रण करावे लागते. विद्युत् विच्छेदनाच्या प्रक्रियेत सर्वच्या सर्व कॅल्शियम क्लोराइड वितळत नाही. अधिक आतल्या भागातले वितळते पण ग्रॅफाइटालगतच्या भागातले घन राहते. त्याची लेपातील ग्रॅफाइटशी फारशी विक्रिया होत नाही. ऋणाग्र ग्रॅफाइटाचे असते व ते पाण्याने थंड राहील अशी व्यवस्था केलेली असते. वितळलेल्या कॅल्शियम क्लोराइडात ऋणाग्राचे जे टोक बुडालेले असते त्याच्यावर कॅल्शियम साचू लागते. धातू साचत असताना मधून मधून ऋणाग्र वर उचलतात, त्याच्या टोकाशी साचलेला धातूचा पुंजका आकाराने गाजरासारखा असतो म्हणून त्याला ‘गाजर’ (कॅरट) म्हणतात. पुरेशी धातू साचल्यावर ऋणाग्राच्या टोकापासून ‘गाजर’ वेगळे करतात. त्याच्यात धातूशिवाय काही अशुद्धी असतात. ‘गाजर’ वितळवून बऱ्याच अशुद्धी काढून टाकतात व नंतर उरलेल्या धातूचे ऊर्ध्वपातन करून (धातूची वाफ करून मग ती थंड करून) शुद्ध धातू मिळविली जाते.
विद्युत् विच्छेदनाच्या प्रारंभी म्हणजे कॅल्शियम क्लोराइड सर्वस्वी घन असताना त्याच्यातून विजेचा प्रत्यावर्ती (उलटसुलट दिशेने वाहणारा) प्रवाह जाऊ देतात. नंतर भट्टीतील पदार्थांचे तापमान इष्ट तितके झाल्यावर एकदिश (एकाच दिशेने वाहणारा) प्रवाह वापरून विद्युत् विच्छेदन केले जाते व इष्ट ते तापमान राखले जाते.
कॅल्शियम ऑक्साइडाचे ॲल्युमिनियम धातूने उष्ण्तेच्या साहाय्याने क्षपण करून कॅल्शियम धातू १९४० सालानंतर मिळविण्यात येऊ लागली व आता तिचे व्यापारी उत्पादन या पद्धतीनेही केले जाते. या पद्धतीत पुढील विक्रिया होते.

ही विक्रिया निर्वात भांडयात केली जाते. विक्रियेने तयार होणाऱ्या कॅल्शियमाचे संप्लवन होईल (घनरूपातून एकदम वायुरूप होईल) व नंतर संप्लवित कॅल्शियम गोळा केले जाईल अशी योजना असते. या पद्धतीने मिळणाऱ्या धातूतही थोड्या अशुद्धी असतात व तिचे ऊर्ध्वपातन करून शुद्ध धातू मिळविली जाते.
रासायनिक गुणधर्म : विक्रियाशील व अती धन विद्युत् भार असलेल्या हवेत राहिल्यावर कॅल्शियम धातूच्या पृष्ठावर तिच्या ऑक्साइडाचे व हायड्रॉक्साइडाचे पुट तयार होऊन पृष्ठ मलिन होते. ती तापविली असता तिचा नायट्रोजन, क्लोरीन, गंधक व हायड्रोजन यांच्याशी सरळ संयोग होऊन अनुक्रमे कॅल्शियम नायट्राइड (Ca3N2)कॅल्शियम क्लोराइड (CaCl2)कॅल्शियम सल्फाइड (CaS) व कॅल्शियम हायड्राइड (CaH2) ही संयुगे तयार होतात. थंड पाण्याशी तिची विक्रिया सहज व तापविलेल्या पाण्याशी किंवा अम्लाशी जोरकस होऊन कॅल्शियम हाड्रॉक्साइड [Ca(OH)2], तयार हाते. कॅल्शियम धातू वर क्षारांची (अम्लाशी विक्रिया होऊन लवण देणाऱ्या पदार्थांची, अल्कलींची) क्रिया होत नाही.
उपयोग : अल्कोहॉलासारखे कार्बनी द्रव कोरडे करण्यासाठी धातुकर्मात धातुकातील (कच्च्या धातूतील) ऑक्सिजन काढून टाकून धातू मिळविण्यासाठी, उदा., क्रोमियम सेस्क्विऑक्साइडापासून (Cr2O3) क्रोमियम, तसेच थोरियम, युरेनियम, झिर्कोनियम इ. धातू त्यांच्या ऑक्साइडांपासून मिळविण्यासाठी ॲल्युमिनियम, तांबे, शिसे, मॅग्नेशियम व इतर क्षारीय (अल्कालाइन) धातूंच्या मिश्रधातूंत मिश्रक घटक म्हणून, उदा., थोडे कॅल्शियम मिसळल्यावर शिसे अधिक कठीण होते व ती मिश्रधातू केबलींवरील आवरणासाठी व धारवे (फिरणारे दंड योग्य स्थितीत रहाण्यासाठी देण्यात येणारे आधार, बेअरिंग) करण्यासाठी वापरली जाते. क्रोमियम-निकेल, क्रोमियम-निकेल-लोह व इतर संबंधित उच्च तापमानरोधी मिश्रधातूंमध्ये तसेच निकेल, पोलाद व कथिल यांच्या काशात (ब्राँझमध्ये) कॅल्शियम विऑक्सिडीकारक (ऑक्सिजन काढून टाकण्यास मदत करणार पदार्थ) म्हणून वापरली जाते. तापायनिक नलिका (उष्णतेमुळे निर्माण होणाऱ्या इलेक्ट्रॉनांचा उपयोग करणारी नलिका), रेडिओ व दूरचित्रवाणी यांतील घटक यांत उच्च निर्वात निर्माण करण्यासाठी कॅल्शियमाचा उपयोग होतो. कार्बनी द्रवांचे निर्जलीकरण करण्यासाठी तसेच थायोकिने व मर्कॅप्टने यांच्या उपघटनासाठी (मोठ्या रेणूचे लहान रेणूंत तुकडे करण्यासाठी) याचा वापर करतात.
संयुगे : कॅल्शियम हायड्राइड : CaH2 तापविलेल्या कॅल्शियमावरून हायड्रोजन जाऊ दिल्याने हे तयार होते. ते पांढरे व स्फटिकमयअसून त्याची संरचना Ca+2 2H-1अशी असते. गार पाण्याशीही त्याची सहज विक्रिया होते आणि हायड्रोजन मुक्त होतो. कॅल्शियम हायड्राइड हे एका ठिकाणाहून दुसऱ्या ठिकाणी सहज नेता येते व सोईस्कर रीतीने हायड्रोजन मिळविण्यासाठी त्याचा उपयोग होतो, पण ते महाग असते.
कॅल्शियम ऑक्साइड : (चुनकळी). CaO. भट्टीत ८००० ते १,०००० से. पर्यंत चुनखडक भाजून याचे व्यापारी उत्पादन केले जाते. कॅल्शियम ऑक्साइड हे पांढरे, अस्फटिकी व पुडीच्या स्वरूपात असते. ते अत्यंत स्थिर असून वितळबिंदूच्या खाली त्याचे अपघटन होत नाही. अतितप्त स्थितीत ते तापदीप्त होते व त्याच्यापासून अत्यंत प्रखर असा प्रकाश बाहेर पडतो. त्याची व पाण्याची अतिशय जोरकस विक्रिया होते व त्यांच्यापासून कॅल्शियम हायड्रॉक्साइड तयार होते. ही विक्रिया अतिशय उष्मादायी (उष्णता देणारी) असते. चुनकळीवर पाणी घातले म्हणजे ती अतिशय तापते ही परिचित गोष्ट आहे.
कॅल्शियम ऑक्साइड हे तीव्र क्षार असून त्याची व अम्लांची जोरकस विक्रिया होते व कॅल्शियमाची लवणे तयार होतात. तापविले असता त्याची सिलिकेसारख्या अम्ल-ऑक्साइडांशीही विक्रिया होऊन कॅल्शियम सिलिकेट (CaSiO3) तयार होते. लोह तयार करताना त्याच्या धातुकात असलेली सिलिका काढून टाकण्यासाठी या विक्रियेचा उपयोग करून घेतला जातो.
कॅल्शियम हायड्रॉक्साइड : (विरविलेला चुना). Ca(OH)2. चुनकळीवर पाणी घालून हे तयार करतात. हे रंगाने पांढरे असून पाण्यात अल्प प्रमाणात विरघळते. हे चुन्याच्या निवळीत असते. ह्याची व अम्लांची किंवा अम्ल-ऑक्साइडांची विक्रिया होते आणि कॅल्शियमाची लवणे तयार होतात.
चुन्याच्या निवळीतून कार्बन डाय-ऑक्साइडाचे बुडबुडे जा्ऊ दिले म्हणजे प्रथम कॅल्शियम कार्बोनेटाचा (CaCO3) सूक्ष्मकणी अवक्षेप (न विरघळणारा साका) तयार होतो व ती निवळी दुधासारखी दिसू लागते. त्यानंतर त्यातून अधिक कार्बन डाय-ऑक्साइड जाऊ दिला असता पूर्वी तयार झालेल्या अवक्षेपाचे विद्राव्य अशा कॅल्शियम वाय-कार्बोनेटात [Ca(HCO3)2], रूपांतर होते व ते पाण्यात विरघळून अवक्षेप नाहीसा होतो. कॅल्शियम बायकार्बोनेट विरघळलेले आहे अशा पाण्यात कॅल्शियम हायड्रॉक्साइड घातले असता कॅल्शियम कार्बोनेट अवक्षेपित होते.
कॅल्शियम हायड्रॉक्साइडाची व क्लोरिनाची विक्रिया होऊन निनिराळया तापमानात निरनिराळे पदार्थ तयार होतात. तापमान ३५० से. पेक्षा कमी असताना क्लोरीन व कॅल्शियम हायड्रॉक्साइड यांची विक्रिया होऊन विरंजक चूर्ण (रंग घालविण्यास मदत करणारे चूर्ण) तयार होते. पण त्यापेक्षा अधिक तापमानात कॅल्शियम क्लोराइड (CaCl2) व ऑक्सिजन ही तयार होतात.
ज्याच्यात कॅल्शियम हायड्रॉक्साइड संधारित (लोंबकळत्या स्थितीत) आहे अशा थंड पाण्यात संतृप्ती होईपर्यंत (जास्तीत जास्त प्रमाणात मिसळेपर्यंत) क्लोरीन घातला असता कॅल्शियमाचे हायपोक्लोराइट [Ca(OCl)2], व क्लोराइड (CaCl2) ही तयार होतात. पण ते संधारण उष्ण असताना कॅल्शियम क्लोरेट [Ca (ClO3)2], ही तयार होतात.
कॅल्शियम हायड्रॉक्साइड व अमोनियाची लवणे यांचे मिश्रण तापविले असता अमोनिया वायू मुक्त होतो.
कॅल्शियम हायड्रॉक्साइड हे चुनेगच्ची बांधकामासाठी, शेतजमिनीची अम्लता कमी करण्यासाठी, गॉसेज यांच्या पद्धतीने दाहक कॉस्टिक सोडा तयार करण्यासाठी व अफेनद (फेस न होणारे) पाणी फेनद करण्यासाठी वापरण्यासाठी वापरले जाते.
कॅल्शियम कार्बोनेट : CaCO3 हे चुनखडक व संगमरवर या खडकांच्या व कॅल्साइट व ॲरॅगोनाइट या खनिजांच्या स्वरूपात आढळते. कॅल्साइट व ॲरॅगोनाइट यांचे रासायनिक संघटन सारखेच असते, पण त्यांचे स्फटिक वेगवेगळया प्रकारचे असतात. कॅल्शियम कार्बोनेट हे घन व पांढऱ्या रंगाचे असून शुद्ध पाण्यात ते जवळजवळ अविद्राव्य असते. पण ज्याच्यात कार्बन-डायऑक्साइड आहे अशा पाण्यात त्याचे कॅल्शियम बायकार्बोनेट होते व ते पाण्यात विरघळते. कॅल्शियम बायकार्बोनेट पाण्यात विरघळले म्हणजे ते पाणी अफेनद होते. अशा पाण्यात साबणाचा फेस होत नाही. चुनखडक असलेल्या प्रदेशातील पाणी अफेनद असते याचे कारण त्यांत कॅल्शियम बायकार्बोनेट असते हे होय.
कॅल्शियम कार्बोनेट व अम्ले यांची सहज विक्रिया होऊन ते अम्लात विरघळते व त्याच्यातील कार्बन डाय-ऑक्साइड मुक्त होऊन वायूच्या रूपात निघून जातो. कॅल्शियम कार्बोनट तापविल्यावर त्याच्यापासून कॅल्शियम ऑक्साइड व कार्बन डाय-ऑक्साइड ही तयार होतात.
कॅल्शियम कार्बोनेटाचा उपयोग चुना व सिमेंट करण्यासाठी शेतजमिनीची अम्लता नाहीशी करण्यासाठी लोहाचे धातुक वितळवून त्याच्यातील लोह मिळविण्याच्या प्रक्रियेत व सॉल्व्हे यांच्या पद्धतीने सोडियम कार्बोनेट तयार करण्याच्या प्रक्रियेत केला जातो. शुद्ध कॅल्शियम कार्बोनेटाची पूड दंतधावन म्हणून व सौंदर्यप्रसाधनांत वापरली जाते.
कॅल्शियम सल्फेट : हे संयुग ⇒ ॲनहायड्राइट (CaSO4) जिप्सम (CaSO4⋅2H2O) या खडकांच्या स्वरूपात विपुल प्रमाणात आढळते. ज्या नैसर्गिक पाण्यात ते विरघळलेले असेल ते पाणी कायमचे अफेनद बनते.
जिप्सम हे सु. १२०० से. इतक्या तापमानात तापविले असता त्याचे ‘प्लॅस्टर ऑफ पॅरिस’ (CaSO4.1/2H2O) तयार होते पण २००० से. पेक्षा अधिक तापविले, तर निर्जल कॅल्शियम सल्फेट तयार होते. अती उच्च तापमानात तापविले असता त्याचे अंशतः अपघटन होऊन थोडे कॅल्शियम ऑक्साइड तयार होते.
सल्यूरिक अम्ल व अमोनियम सल्फेट करण्यासाठी ॲनहायड्राइटाचा उपयोग मोठ्या प्रमाणात होतो. समुद्राचे पाणी शिरून शेतजमीन खराब झाली असेल, तर ती सुधारून सुपीक बनविण्यासाठी जिप्सिमाची भर तिच्यात घालतात. प्लॅस्टर ऑफ पॅरिस व सिमेंट बनविण्यासाठीही जिप्सम वापरतात. कागदात पूरण (भर) म्हणून कॅल्शियम सल्फेटाचा उपयोग होतो [→प्लॅस्टर ऑफ पॅरिस] .
कॅल्शियम फॉस्फेट : Ca3(PO4)2. कॅल्शियम ऑक्साइड व फॉस्फरस पेंटॉक्साइड एकत्र तापवून हे तयार करता येते. निसर्गात ते फॉस्फराइट किंवा रॉक फॉस्फेट या नावाने ओळखल्या जाणाऱ्या खडकांच्या रूपात आढळते. ते प्राण्यांच्या हाडांतही असते. पाण्यात ते लेशमात्र विरघळते, परंतु विरल अम्लांत सहज विरघळते. फॉस्फोराइटाचा उपयोग सुपर फॉस्फेट नावाचे जोरखत बनविण्यासाठी व फॉस्फरस मिळविण्यासाठी होतो. हे अमेरिकेच्या संयुक्त संस्थानांतील फ्लॉरिडा, टेनेसी आणि काही पश्र्चिमेकडील संस्थाने येथे तसेच उत्तर आफ्रिकेत फॉस्फोराइट या स्वरूपात आढळते.
कॅल्शियम ल्युओराइड : CaF2 हे निसर्गात फ्ल्युओरस्पार किंवा फ्ल्युओराइड या नावाच्या खनिजाच्या रूपात आढळते. त्याचा वितळबिंदू सु. १,४००० से. आहे. पाण्यात किंवा विरल अम्लात ते विरघळत नाही असे म्हटले तरी चालेल. प्रबल सल्यूरिक अम्लाबरोबर ते तापविले असता पुढील विक्रिया होऊन निर्जल हायड्रोजन फ्ल्युओराइड वायूच्या स्वरूपात तयार होते.
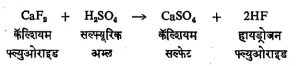
धातुकांचे प्रद्रावण करून (योग्य पदार्थाचा धातुकाशी संयोग करून त्या पदार्थाची मळी व खाली अशुद्ध स्वरूपातील वितळलेली धातू या स्वरूपात रूपांतर करून) धातू मिळविताना अभिवाह (धातू कमी तापमानास वितळावी म्हणून मिसळण्यात येणारा पदार्थ) म्हणून व काचेच्या एनॅमलाचे काम करण्यासाठी फ्ल्युओरस्पार वापरले जाते.
कॅल्शियम कार्बाइड : CaC2 विजेच्या भट्टीत चुना व कोक यांचे मिश्रण सु. २,०००० से. इतके तापवून हे तयार केले जाते. कॅल्शियम कार्बाइड व थंड पाणी यांची विक्रिया सहज होऊन ⇨ॲसिटिलीन (C2H2) वायू तयार होतो. उद्योगधंद्यात ॲसिटिलीन वायूचा उपयोग फार मोठ्या प्रमाणात होतो. कॅल्शियम कार्बाइड हे नायट्रोजनात घालून खूप तापविले असता त्याचे कॅल्शियम सायनामाइडात (CaCN2) रूपांतर होते. त्याचा वापर जोरखत म्हणून करतात.
कॅल्शियम क्लोराइड : CaCl2 कॅल्शियम धातूवर, तिच्या ऑक्साइडावर, हायड्रॉक्साइडावर किंवा कार्बोनेटावर हायड्रोक्लोरिक अम्लाची विक्रिया करून हे तयार करता येते. हे अतिशय प्रस्वेदक (ओलसर होऊन नंतर द्रवीकरण होणारे) असल्यामुळे हवेत अतिशय चिघळते. त्याच्या स्फटिकांचे रासायनिक संघटन CaCl2⋅6H2O असे असते. हे स्फटिक सु. २००० से. इतके तापविल्यास त्यांचे संघटन CaCl2⋅2H2O असे होते. सु. २६०० से. पेक्षा जास्त तापविल्यास त्यांचे निर्जल लवणात CaCl2 रूपांतर होते. निर्जल कॅल्शियम क्लोराइडाचा उपयोग विद्युत् विच्छेदनाने कॅल्शियम धातू मिळविण्यासाठी व काही वायू व कार्बनी द्रव कोरडे करण्यासाठी करतात.
कॅल्शियम नायट्रेट : Ca(NO3)2कॅल्शियमावर किंवा त्याच्या ऑक्साइडावर, हायड्रॉक्साइडावर किंवा कार्बोनेटावर विरल नायट्रिक अम्लाची क्रिया केल्यावर हे मिळते. त्याच्या स्फटिकांचे रासायनिक संघटन Ca(NO3)2⋅ 4H2Oअसे असते. हे अतिप्रस्वेदक असून पाण्यात सहज विरघळते. तापविल्यावर त्याचे पुढे दाखविल्याप्रमाण अपघटन होते. नायट्रोजन पुरविणारे खत म्हणून याचा वापर करतात. शेतजमिनीतील प्राणिज पदार्थांचे अपघटन होऊनही ते तयार होते.
अभिज्ञानः (अस्तित्व ओळखणे). कॅल्शियम असलेल्या संयुगामुळे ज्योतीला विटकरी लाल रंग येतो. अशी लाल विटकरी ज्योत स्ट्रॅंशियम व लिथियम यांच्यामुळेही येते. परंतु कॅल्शियम नायट्रेट विरघळत नाहीत. म्हणून या परीक्षेने ते स्ट्रॅंशियम व लिथियम यांच्यापासून वेगळे ओळखता येते. कॅल्शियम असलेल्या विद्रावात अमोनियम ऑक्झॅलेटाचा विद्राव घातल्यावर कॅल्शियम ऑक्झॅलेटाचा पांढरा अवक्षेप मिळतो. तो अवक्षेप ॲसिटिंक अम्लात विरघळत नाही, पण विरल हायड्रोक्लोरिक अम्लात विरघळतो.
पहा : चुनखडक; विरंजक चूर्ण; सिंमेट.
संदर्भः 1. Abbot, D. Inorganic Chemistry, London, 1965.
2. Hicks. J. Comprehensive Chemistry, London, 1963.
3. Partington, J. R. General and Inorganic Chemistry, London, 1966.
जमदाडे, ज.वि.