बोरॉन : घनरूप अघातवीय मूलद्रव्य. रासायनिक चिन्ह B अणुक्रमांक (अणुकेंद्रातील प्रोटॉनांची संख्या) ५ अणुभार १०.८११ ⇨आवर्त सारणीतील (इलेक्ट्रॉन रचनेनुसार केलेल्या मूलद्रव्यांच्या कोष्टकरूप मांडणीतील) गट ३ ब वितळबिंदू २,२०००-२,३००० से. उकळबिंदू २,५५०० से. वि. गु. (२५-२७० से.ला) २.३५ नैसर्गिक स्थिर समस्थायिक (अणुक्रमांक तोच पण भिन्न अणुभार असलेल्या त्याच मूलद्रव्याचे प्रकार) दोन असून त्यांचे द्रव्यमानांक (अणुकेंद्रातील प्रोटॉन व न्यूट्रॉन यांची एकूण संख्या) १० ते ११ किरणोत्सर्गी (भेदक कण वा किरण बाहेर टाकणाऱ्या) समस्थानिकांचे द्रव्यमानांक ८, ९ व १२ असून या समस्थानिकांची अर्धायुष्ये (किरणात्सर्गाची मूळची क्रियाशीलता निम्मी होण्यास लागणारे कालावधी) अत्यल्प म्हणजे एक सेकंदापेक्षाही कमी आहेत. विद्युत् विन्यास (अणुकेंद्राभोवतील विविध कक्षांतील इलेक्ट्रॉनांची संख्या) २, ३ संयुजा (इतर अणूंशी संयोग पावण्याची क्षमता दर्शविणारा अंक) ३.
इतिहास : इ. स. १७०२ मध्ये डब्ल्यू. हॉमबर्ख यांनी ⇨टाकणखारापासून (बोरॅक्सपासून) बोरिक अम्ल प्रथम तयार केले. जवळजवळ १०० वर्षांनंतर १८०७ साली सर हंफ्री डेव्ही यांनी बोरॉन हे मूलद्रव्य बोरिक अम्लाच्या विद्युत् विच्छेदनाने (विद्युत् प्रवाहाच्या साहाय्याने रेणूचे तुकडे करण्याच्या क्रियेने) प्रथम मिळविले व १८१२ मध्ये त्याला बोरॉन हे नाव दिले. त्याच सुमारास १८०८ साली जे. एल्. गे-ल्युसॅक व एल्. जे. थेनार्ड या दोन शास्त्रज्ञांना बोरिक अम्लाचे पोटॅशियमाने ⇨क्षपण करून बोरॉन मिळविण्यात यश मिळाले. या तयार केलेल्या मूलद्रव्याची शुद्धता फक्त ५०% होती. १८९२ साली आंरी म्वासां यांनी B2O3 चे क्षपण करून ९८% पेक्षाही जास्त शुद्धतेचे अस्फटिकी बोरॉन तयार केले. त्याला म्वासां बोरॉन म्हणत. पूर्वीच्या संशोधकांनी निरनिराळ्या पद्धतींनी तयार केलेल्या बोरॉनामध्ये मोठ्या प्रमाणावर अशुद्ध द्रव्ये (सामान्यतः ऑक्सिजन व क्षपणकारक धातू) असतात, असे म्वासां यांनी दाखवून दिले. मूळ शोधानंतर १०० वर्षांनी १९०९ मध्ये ई. विंट्रॉब यांनी बोरॉन ट्रायक्लोराइड आणि हायड्रोजन यांचे मिश्रण विद्युत् प्रज्योतीतून नेऊन ९९% च्यावर शुद्धता असलेल्या बोरॉनाच्या कांड्या तयार केल्या. आता ९९.९९% शुद्धतेचे बोरॉन तयार करता येते.
उपस्थिती : बोरॉन मुक्त स्वरूपात निसर्गात आढळत नाही. त्याचे टाकणखार हे संयुग पुरातन कालापासून माहीत आहे. ते बोरिक अम्ल आणि विस्तृत प्रमाणात विखुरलेली निरनिराळी बोरेटे या स्वरूपांतही आढळते. यांचे साठे ज्वालामुखीच्या आसपासच्या प्रदेशात आढळतात. बोरॉनाची काही नैसर्गिक खनिजे पुढीलप्रमाणे आहेत : टिंकल (Na2B4O7.10H2O बोरॅक्स), केर्नाइट (Na2.B4O7.4H2O), सॅसोलाइट (H3BO3 बोरिक अम्ल), कोलेमनाइट (Ca2B6O11.5H2O), बोरोनॅट्रो कॅल्साइट (CaB4O7NaBO2.8H2O), ⇨बोरॅसाइट (Mg3B7O13Cl). बोरॉनाचे भूकवचातील सरासरी प्रमाण ०.०००३% असावे असा अंदाज आहे. सुदैवाने सुलभपणे क्रिया करता येईल अशा सजल बोरेट खनिजांच्या निक्षेपांत (साठ्यांत) मोठ्या प्रमाणावर त्याचे संकेंद्रण झालेले असल्याने इतर काही गौण मूलद्रव्यांप्रमाणे ते सापडण्यास व त्याचा उपयोग करण्यास अवघड नाही. अमेरिकेची संयुक्त संस्थाने, तुर्कस्तान, रशिया, तिबेट, भारत, इटली, जर्मनी, अर्जेंटिना, बोलिव्हिया, कॅनडा, चीन, इराण, न्यूझीलंड, न्यू गिनी व सिरिया या देशांत बोरॉन खनिज निक्षेप आढळतात. व्यापारी दृष्ट्या टाकणखार व केर्नाइट ही खनिजे महत्त्वाची आहेत [⟶ टाकणखार बोरिक अम्ल]. अत्यल्प प्रमाणात (एका टनात ५ ग्रॅम) हे मूलद्रव्य समुद्राच्या पाण्यात असते. बहुतेक मृदांमध्ये लेश मूलद्रव्य म्हणून ते आढळते. सर्व तऱ्हेच्या वनस्पतींना हे अत्यल्प प्रमाणात आवश्यक आहे, असे दिसून आले आहे. सर्व वनस्पतींत व प्राण्यांत हे लेश घटक म्हणून आढळते. खडक तयार करणाऱ्या सिलिकेट खनिजांमध्ये हे एक आवश्यक घटक म्हणून असते.
उत्पादन : बोरॉनाचे व्यापारी उत्पादन बऱ्याच पद्धतींनी करता येते. त्यांपैकी काहींचे वर्णन खाली दिले आहे : (१) विपुल प्रमाणात उपलब्ध असणाऱ्या बोरिक ऑक्साइडाचे (B2O3) लिथियम, सोडियम, पोटॅशियम, मॅग्नेशियम, बेरिलियम, कॅल्शियम किंवा ॲल्युमिनियम यासारख्या धातूचे क्षपण करून बोरॉन मिळते. या सर्व धातूंमध्ये मॅग्नेशियम ही चांगली क्षपणकारक आहे. मॅग्नेशियमाने केलेल्या क्षपणाने अंदाजे ९०-९५% शुद्धतेची बोरॉनाची तपकिरी पूड मिळते. यात काही धातवीय बोराइडे तयार होतात. (२) बोरिक ऑक्साइड किंवा बोरॉन ट्रायक्लोराइडाचे कॅल्शियम कार्बाइड किंवा टंगस्टन कार्बाइड या संयुगांनी किंवा हायड्रोजन वायूने विद्युत् प्रज्योत भट्टीत क्षपन करून बोरॉन मिळते. (३) बोरॉन संयुगांचे ऊष्मीय अपघटन (उष्णतेने रेणूचे तुकडे पाडण्याची क्रिया) करून बोरॉन मिळते. या पद्धतीत बोरेने, बोरॉन हॅलाइडे, सल्फाइडे, बोराइड, फॉस्फाइड इ. संयुगांचे अपघटन करून बोरॉन मिळवता येते. (४) बोरॉनाच्या वायुरूप संयुगांचे हायड्रोजनाने १,२००० से.ला बोरॉन हॅलाइडाच्या वातावरणात क्षपण करून विद्युत् अग्रावर तंतुरूपात किंवा कांडीसारख्या रूपात बोरॉन मिळविता येते. या पद्धतीने १९०९ मध्ये ई. विंट्रॉब यांनी पाण्याने थंड केलेल्या तांब्याच्या विद्युत् अग्रावर शुद्ध बोरॉन कांड्या मिळविल्या. १९४३ मध्ये ए. डब्ल्यू. लॅबेंगेयर व त्यांच्या सहकाऱ्यांनी विद्युत् भट्टीत हायड्रोजन व बोरॉन ब्रोमाइड वापरून ८०००-१,३००० से.ला तापवलेल्या टँटॅलमावर स्फटिकी बोरॉन तयार केले. या पद्धतीने ५ सेंमी. व्यासाच्या शुद्ध बोरॉनाच्या कांड्या तयार करता येतात. (५) बोरॉन विद्युत् विच्छेदन पद्धतीनेही मिळवता येते. या पद्धतीत बोरिक ऑक्साइड, मॅग्नेशियम ऑक्साइड व मॅग्नेशियम फ्ल्युओराइड यांचे मिश्रण विद्युत् विच्छेद्य म्हणून वापरले जाते. या पद्धतीत कार्बनाची मूस धनाग्र म्हणून आणि लोखंडाची नलिका ऋणाग्र म्हणून वापरतात. विद्युत् विच्छेदनाची ही क्रिया सु. १,१००० से. तापमानास करतात.
गुणधर्म : बोरॉनाचे धात्वाभ (धातूशी संयोग पावून मिश्रधातू बनविणारे) म्हणून वर्गीकरण करण्यात आलेले असून ज्याच्या बाह्य कवचात चारापेक्षा कमी इलेक्ट्रॉन आहेत, असे हे एकमेव अधातवीय मूलद्रव्य आहे. बोरॉनाची अस्फटिकी (चूर्ण) व स्फटिकी अशी दोन्ही रूपे आहेत. शुद्ध अस्फटिकी बोरॉन काळ्या कुळकुळीत रंगाचे असते परंतु संपुंजित बोरॉन मंद धातवीय चमक दाखवते. त्याची घनता २.३१ ग्रॅ./सेंमी.३ असते.
स्फटिक तीन प्रकारचे मिळतात. ८०००-१,१००० से. तापमानाला मिळणारे स्फटिक आल्फा समांतर षट्फलकीय [⟶ स्फटिकविज्ञान] असून त्याचे वि. गु. २.४६ असते. १,१०००-१,३००० से.ला मिळणारे स्फटिक चतुष्फलकीय असून त्याची घनता २.३१ ग्रॅ./सेंमी.३ असते आणि १,३००० से.च्या वरच्या तापमानाला तयार होणारे स्फटिक बीटा समांतर षट्फलकीय असून त्याची घनता २.३५/सेंमी.३ असते. स्फटिकी रूपातील बोरॉन कार्बोरंडमापेक्षा जास्त व हिऱ्याच्या खालोखाल कठीण असते [कठिनता ९.३ मोस ⟶ कठिनता] तथापि ते सापेक्षतः ठिसूळ असल्याने त्याचा हत्यारांमध्ये उपयोग करता येत नाही.
उपयोग : बोरॉन व बोरॉनाची संयुगे यांचा निरनिराळ्या क्षेत्रांत विविध प्रकारे उपयोग होतो. मूलद्रव्य रूपातील बोरॉन मुख्यत्वे धातू उद्योगात वापरले जाते. उच्च तापमानांना विशेषतः ऑक्सिजन व नायट्रोजन यांच्या बाबतीतील बोरॉनाच्या तीव्र विक्रियाशीलतेमुळे धातूंतील वायू काढून टाकण्यासाठी त्याचा उपयोग करतात. हत्यारी पोलादांचे उच्च तापमानातील बल गुणधर्म त्यांत बोरॉन समाविष्ट केल्यामुळे पुष्कळच वाढतात. खास कठीण पोलादांच्या उत्पादनात बोरॉन अत्यल्प प्रमाणात (०.०००५% ते ०.००५%) वापरतात. ॲल्युमिनियमाच्या ओतिवांमधील कणांचा पोत सुधारण्यासाठी व वर्धनीय (ठोकून वा अन्य प्रकारे आकार देता येणाऱ्या) लोखंडावर उष्णता उपचार सुलभपणे करण्यासाठी बोरॉनाचा उपयोग करतात.
कमी घनता (ॲल्युमिनियमापेक्षा १५% हलके), उच्च कठिनता, उच्च वितळबिंदू व तंतुरूपातील लक्षणीय ताणबल व बोरॉनाच्या गुणधर्मांमुळे क्षेपणास्त्रे व रॉकेटे यांच्या संरचनेत ते उपयुक्त ठरले आहे. एपॉक्सी वा अन्य प्लॅस्टिकाचा वाहक द्रव्य म्हणून उपयोग करून बोरॉन तंतू वापरले जातात. या संयोगाचे बल व कडकपणा पोलादापेक्षा जास्त असून ते ॲल्युमिनियमापेक्षा २५% हलके असते आणि त्यामुळे विमानांत उपयोग करण्यासाठी ते आदर्श समजले जाते.
संयुगे : बोरॉनाची बहुसंख्य संयुगे तयार होण्याचे कारण म्हणजे बोरॉन अणू एकमेकांशी आणि C, O, N, P, As, हॅलाइडे इत्यादींच्या अणूंशी शृंखलायुक्त किंवा वलयी संरचनायुक्त संयुगे तयार करतो. काही संयुगांची माहिती खाली दिली आहे.
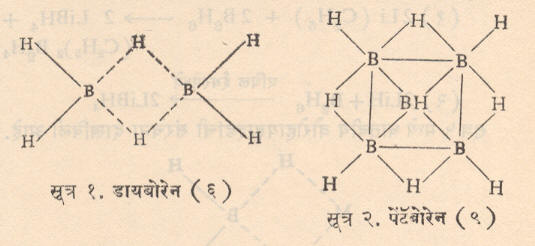
बोरॉन हायड्राइडे किवा बोरेने : आल्फ्रेड स्टॉक व त्यांचे सहकारी यांनी १९१२-३६ या काळात या संयुगांसंबंधी अभ्यास केला. त्यांनी B2H6, B4H10, B5H9, B5H11, B6H10 व B10H14 अशी हायड्राइडे तयार केली. त्यांची व्याप्ती लक्षात घेऊन त्यांना बोरॉनामधील Bor—याला— ane हा प्रत्यय लावून ‘बोरेने’ असे नाव दिले. बोरेनांची नावे लिहिताना ‘बोरेन’च्या मागे बोरॉन अणुसंख्या दर्शविणारा शब्द व पुढे कंसात हायड्रोजन अणूंची संख्या दर्शविणारा आकडा लिहितात. जसे B4H10 म्हणजे टेट्राबोरेन (१०). यांतील B2H6 हे वायुरूप व B10H14 हे घनरूप व बाकीचे द्रवरूप आहेत. स्टॉक यांनी उच्च निर्वात पद्धती व उपकरणे वापरून ही तयार केली. मॅग्नेशियम बोराइडावर १०% हायड्रोक्लोरिक अम्ल ५०० से. तापमानाला हळूहळू टाकून बोरेने तयार होतात. ती हायड्रोजन प्रवाहाने कोरडी व द्रवरूप हवेने किंवा नायट्रोजनाने थंड करतात. या विक्रियेत डायबोरेन (६) तयार होत नाही कारण त्याचे पाण्याने अपघटन होते.
|
|
 |
डायबोरेनावर ⇨हर्बर्ट चार्ल्स ब्राउन यांनी १९५६ मध्ये महत्त्वाचे संशोधन केले. त्यांनी असे शोधून काढले की, ओलेफिनांच्या ईथरातील विद्रावात कोठी तापमानाला डायबोरेन घातल्यास त्याचे ओलेफिनात परिमाणात्मक (संपूर्णपणे) समावेशन होते व कार्बनी बोरेन तयार होतात. या विक्रियेस ‘हायड्रोबोरेनीकरण’ म्हणतात. या विक्रियेचे वैशिष्ट्ये म्हणजे ज्या अल्किल, वलयी अल्किल अगर अरिल संयुगात डायबोरेनाचे समावेशन करावयाचे असेल त्यात कोणताही कार्यकारी गट असला तरी चालतो शिवाय या विक्रियेत त्याच्या मूळ संरचनेत बदल होत नाही व त्याचा विन्यासही (त्रिमितीय अवकाशातील मांडणीही) तसाच राहतो. या त्यांच्या संशोधनामुळे कार्बनी बोरेने ही कार्बनी संश्लेषणात (घटक मूलद्रव्यांपासून वा त्यांच्या संयुगांपासून रासायनिक विक्रियेद्वारे पदार्थ बनविण्याच्या क्रियेत) क्रांतिकारी ठरली आहेत. समघटकीकरण, वलयीकरण, ऑक्सिडीकरण, संयुग्मीकरण, कार्बॉक्सिलीकरण, अल्किलीकरण, अरिलीकरण, संयुग्मी समावेशन इ. विविध कार्बनी संश्लेषणाच्या विक्रियांत कार्बनी बोरेनांचा उपयोग होतो. याचे प्रमुख श्रेय ब्राउन यांच्या प्रदीर्घ संशोधनाला असून त्याकरिता त्यांना १९७९ च्या रसायनशास्त्रातील नोबेल पारितोषिकाचा बहुमान मिळाला.
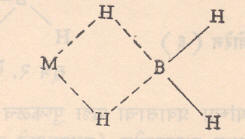
बोरोहायड्राइडे : हायड्राइडे आयन (विद्युत् भारित अणू) H— मध्ये असहधारित (इतर अणूंत वा अणुगटांत वाटले न गेलेले) इलेक्ट्रॉन असल्यामुळे त्याची बंधक शक्ती जास्त असते. त्यामुळे BH3 गट सहजरीत्या सामावून घेऊन BH4— असा स्थिर बोरोहायड्राइड आयन तयार होतो. सोडियम व लिथियम बोरोहायड्राइडांचा प्रयोगशाळेत क्षपणक म्हणून वाढता उपयोग होत असल्याचे पाहून त्यांचे व्यापारी प्रमाणावर उत्पादन करण्यात येत आहे. बोरेन एस्टराची [B (OCH3)3] सोडियम हायड्राइडावर (NaH) विक्रिया करून सोडियम बोरोहायड्राइड (NaBH4) मोठ्या प्रमाणावर तयार करतात. धातवीय अल्किले, अल्कॉक्साइडे व धातवीय हायड्राइडे यांच्यावर डायबोरेनाच्या विक्रियेने बोरोहायड्राइडे मिळतात. उदा.,
(२) 2 LiH + B2H6 एथिल ईथरमध्ये 2 LiBH4
सूत्र ५ मध्ये धातवीय बोरोहायड्राइडांची संरचना दाखविली आहे.
|
|
अशा प्रकारे BH4 गट धातवीय आयनाला जोडलेला असतो. ही संयुगे अत्यंत विक्रियाशील असतात. हवा किंवा पाणी यांच्याशी त्यांची स्फोटक विक्रिया होऊ शकते हायड्रोजन क्लोराइडाबरोबर धातवीय क्लोराइड, डायबोरेन व हायड्रोजन मिळतात.
ऑक्साइडे : माहीत असलेल्या ऑक्साइडांपैकी बोरिक ऑक्साइड किंवा बोरॉन ट्रायऑक्साइड (B2O3) हेच महत्त्वाचे आहे. हे निसर्गात सापडते. तप्त बोरॉन व ऑक्सिजन यांपासून ते तयार करता येते. बोरिक अम्ल तापविले असता प्रथम मेटाबोरिक अम्ल व शेवटी बोरिक ऑक्साइड मिळते. हे मुख्यतः बोरॉन व त्याची संयुगे तयार करण्याकरिता वापरतात. शिवाय अणुऊर्जा उद्योगात ऊष्मीय न्यूट्रॉनशोषक म्हणून याचा उपयोग होतो. याचे कार्बनाने क्षपण होत नाही. B2O3 हे काचउद्योगात, वितळजोडकामात (वेल्डिंगमध्ये) अभिवाहांमध्ये (सांधावयाच्या धातूच्या तुकड्यांना लावण्यात येणाऱ्या आणि भरण धातूंचा वितळबिंदू कमी व्हावा व ऑक्साइडे तयार होऊ नयेत याकरिता वापरण्यात येणाऱ्या पदार्थांमध्ये) व खनिज संस्करणात वापरतात.
हॅलाइडे : बोरॉन ट्रायफ्ल्युओराइड (BF3) हे वायुरूप आहे (उकळबिंदू -१०१० से.). बोरॉन ट्रायक्लोराइड (BCl3) द्रवरूप आहे (उकळबिंदू १२.४० से.) बोरॉन ट्रायब्रोमाइड (BBr3) द्रवरूप आहे (उकळबिंदू ९०.४० से.) व बोरॉन ट्रायआयोडाइड (BI3) घनरूप आहे (वितळबिंदू ४९.६° से.). BF3, BCl3 व BBr3 ही हॅलाइडे बोरॉन किंवा बोराइडे तापवून त्यांवर अनुक्रमे फ्ल्युओरीन, क्लोरीन व ब्रोमीन यांच्या विक्रियेने मिळतात. BI3 मात्र BCl3 वर हायड्रिआयोडिक अम्लाची विक्रिया करून किंवा सोडियम बोरोहायड्राइडावर आयोडिनाची विक्रिया करून मिळते. बोरिक अम्ल, हायड्रोजन (अथवा धातवीय) फ्ल्युओराइड व सल्फ्युरिक अम्ल यांच्या विक्रियेने BF3 सुलभपणे मिळते. या सर्व हॅलाइडांचे जलीय विच्छेदन (पाण्याबरोबर होणाऱ्या रासायनिक विक्रियेमुळे रेणूंचे तुकडे होण्याची क्रिया) होऊन बोरिक अम्ल मिळते. BF3 पासून या विक्रियेत फ्ल्युओबोरिक अम्ल (HBF4) मिळते. यापासून आणि इतर मार्गानेही धातवीय फ्ल्युओबोरेटे (उदा., NaBF4) मिळतात. त्यांचा विद्युत् विलेपन उद्योगात उपयोग होतो. रासायनिक उद्योगात या हॅलाइडांचा (विशेषतः ट्रायफ्युओराइड व ट्रायक्लोराइड यांचा) उत्प्रेरक म्हणून मोठ्या प्रमाणावर उपयोग करतात. ॲल्युमिनियम, मॅग्नेशियम, जस्त व तांबे यांच्या शुद्धीकरणात बोरॉन ट्रायक्लोराइड वापरतात.
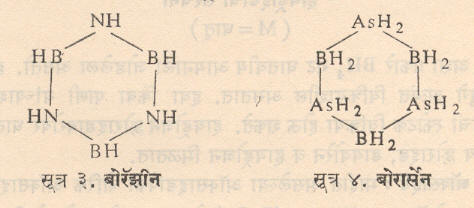
नायट्रोजन संयुगे : बोरॉन व नायट्रोजन यांची पुष्कळ संयुगे तयार होतात. डायबोरेन व अमोनिया २००० से.ला तापवल्यास बोरॅझीन हे बेंझिनाप्रमाणे षट्कोणी, वलयी संरचना असलेले संयुग तयार होते. त्याची संरचना सूत्र ३ मध्ये दिली आहे. यातील बोरॉनाला जोडलेला अणू प्रतिष्ठापित करता येतो. (एका अणूच्या जागी दुसरा अणू वा अणुगट समाविष्ट करता येतो).
कार्बनी संयुगे : बोरॉनाची कार्बनी सयुंगे विविध प्रकारांची व पुष्कळ आहेत. मुख्यत्वे अल्किल व अरिल अनुजात असे यांचे दोन प्रकार कल्पिता येतील. अशा तऱ्हेची संयुगे बोरॉन हॅलाइडावर धातवीय अल्किले किंवा ग्रीन्यार विक्रियाकारक [⟶ ग्रीन्यार विक्रिया] यांच्या विक्रियेने तयार करता येतात. १८६२ मध्ये एडवर्ड फ्रँकलंड यांनी झिंक-डाय-अल्किकाची बोरॉन हॅलाइडावर विक्रिया करून R3B (R = अल्किल गट) यासारखी ट्रायअल्किल बोरॉइने तयार केली. ट्रायमिथिल बोरॉन B (CH3)3 हे वायुरूप असून त्याचा उकळबिंदू —२१.८° से. आहे.
ट्रायएथिल बोरान B(CH5)3 हे द्रवरूप असून त्याचा उकळबिंदू ९५० से. आहे. बोरॉन अल्किले हवेमध्ये पेट घेणारी आहेत. ट्रायफिनिल बोरॉन B(C6H5)3 घनरूप असून त्याचा वितळबिंदू १४२० से. आहे. बोरॉन अरिले बोरॉन अल्किलांपेक्षा कमी विक्रियाशील आहेत. या संयुगांपासून अल्किल किंवा अरिल बोराहायड्राइडे बनवता येतात. उदा., लिथियम टेट्रामिथिल बोरोहाड्राइड LiB(CH3)4, सोडियम टेट्राफिनिल बोरोहायड्राइड NaB(C6H5)4 इत्यादी. सोडियम टेट्राफिनिल बोरोहायड्राइड रासायनिक विश्लेषणात विक्रियाकारक म्हणून वापरतात. त्याच्या साहाय्याने पोटॅशियम, रुबिडियम आणि सिझियम यांचे विगणन (प्रमाणाचा अंदाज) करता येते.
अभिज्ञान : (अस्तित्व ओळखणे). बोरॉनाच्या बाष्पनशील संयुगामुळे अल्कोहॉलाच्या ज्योतीला किंवा वायूच्या अदीप्तिमान ज्योतीला येणारा हिरवा रंग यावरून बोरॉनाचे अभिज्ञान होते. चिनी मातीच्या एका बशीमध्ये बोरॉनाचे कुठलेही एक संयुग घेऊन त्यात थोडे नायट्रिक अम्ल घालतात त्यामुळे संयुगाचे बोरिक अम्लात रूपांतर होते. नंतर त्यात सल्फ्यूरिक अम्ल व थोडे अल्कोहॉल घालतात. या विक्रियेत एथिल बोरेट तयार होते. ते पेटविल्यास हिरव्या किनारीची ज्योत मिळते. त्यावरून बोरॉनाचे अस्तित्व ओळखले जाते. दुसरी कसोटीची पद्धत म्हणजे बोरॉन संयुग आणि कॅल्शियम फ्ल्युओराइड यांच्या मिश्रणात संहत सल्फ्यूरिक अम्ल घालून त्याची पेस्ट तयार करतात. ही पेस्ट प्लॅटिनमाच्या तारेवर घेऊन तार ज्योतीजवळ धरल्यास बाष्पनशील BF3 मुळे ज्योतीस हिरवा रंग येतो. तांबे व बेरियम ही ज्योतीस हिरवा रंग देणारी आहेत परंतु ती प्रत्यक्ष ज्योतीत धरावी लागतात. नुसती ज्योतीजवळ धरून ज्योतीस हिरवा रंग देऊ शकत नाहीत. हळदीच्या पाण्यात रंगविलेला गालनपत्राचा तुकडा (टरमेरिक पेपर) अम्लीकृत बोरेटांच्या विद्रावात (वा मुक्त बोरिक अम्लात) बुडवून कोरडा केल्यावर तांबडा-तपकिरी होतो. तो अमोनियाने ओला केल्यावर तात्पुरता हिरवट काळा होतो.
पहा : टाकणखार बोरिक अम्ल.
संदर्भ : 1. Gaule, G. K., Ed., Boron, Vol. 2 : Preparation, Properties and Applications, New York, 1966.
2. Muetterties, E. L., Ed., The Chemistry of Boron and Its Compounds, New York, 1967.
3. Parkes, G. D., Ed., Mellor’s Modern Inorganic Chemistry, London, 1961.
4. Partington, J. R. General and Inorganic Chemistry, London, 1966.
“