प्रकाशरसायनशास्त्र : काही रासायनिक विक्रियांची सुरुवात प्रकाशामुळे होते. उदा., वनस्पतींमध्ये हवेतील कार्बन डाय-ऑक्साइड व पाणी यांपासून सूर्यप्रकाशात स्टार्च इ. विविध पदार्थ बनतात [→ प्रकाशसंश्लेषण]. छायाचित्र काढण्याच्या काचेला (वा फिल्मला) लावलेल्या रासायनिक पदार्थावर प्रकाशामुळे रासायनिक परिणाम होऊन छायाचित्र उमटते इत्यादी. प्रकाश आणि रासायनिक विक्रिया यांच्या परस्परसंबंधांचे विवेचन प्रकाशरसायनशास्त्र या रसायनशास्त्राच्या विभागात केले जाते. येथे प्रकाश या संज्ञेत केवळ दृश्य प्रकाशच नव्हे,तर जंबुपार व अवरक्त (अनुक्रमे दृश्य वर्णपटातील जांभळ्या रंगाच्या पलीकडील व तांबड्या रंगाच्या अलीकडील अदृश्य) प्रारणांचाही (तरंगलांबी ३,००० ते १२,००० Å)समावेश होतो (१ Å = १०-८ सेंमी.).
इतिहास : वनस्पतींच्या वाढीस म्हणजेच त्यांच्यात अंतर्गत होणाऱ्या रासायनिक प्रक्रियांसाठी प्रकाश आवश्यक आहे,हे प्रथम स्टीव्हेन हेल्स यांनी इ. स. १७०० च्या सुमारास निदर्शनास आणले. चांदीच्या लवणांवर प्रकाशाचा परिणाम घडतो हे जे. एच्. शुल्झ,जे. बी. बेक्कॅरियस आणि के. डब्ल्यू. शेले यांना त्यानंतर दिसून आले. हा परिणाम प्रकाशाच्या तरंगलांबीवर अवलंबून असतो व जसजसे दृश्य वर्णपटातील तांबड्या रंगाकडून जांभळ्या रंगाकडे जाऊ लागावे तसतसा तो वाढू लागतो,असे शेले यांनी १७७७ मध्ये दाखविले.
प्रकाशाच्या परिणामाची दुसरीही कित्येक उदाहरणे त्या काळी माहीत होती,तथापि प्रकाशरसायनशास्त्राचा पाया थिओडोर फोन ग्रोथस व जे. डब्ल्यू. ड्रेपर यांच्या प्राथमिक सिद्धांतामुळे घातला गेला. त्यांनी असे दाखविले की,प्रकाशरासायनिक विक्रियेला जी चालना मिळते,ती पदार्थाने शोषण केलेल्या प्रकाशामुळे होय.
एखाद्या पदार्थावर प्रकाश पडला,तर त्यातील काहीच ⇨ फोटॉन (प्रकाशपुंज) शोषले जातात,बाकीचे परावर्तित होतात वा आरपार जातात. शोषल्या जाणाऱ्या प्रकाशाचे प्रमाण किती असते हे जे. एच्. लँबर्ट व ए. बीअर यांनी प्रस्थापित केलेल्या नियमांनी ठरविता येते.
माक्स प्लांक यांच्या ⇨ पुंज सिद्धांतानंतर प्रकाश शोषणाऱ्या आविष्काराचे स्पष्टीकरण ॲल्बर्ट आइन्स्टाइन यांनी १९१० च्या सुमारास केले व तेव्हापासून प्रकाशरसायनशास्त्राची प्रगती होऊ लागली.
प्रकाश उत्सर्जनाचे स्वरूप : पुंज सिद्धांतानुसार प्रकाशाचे उत्सर्जन व शोषण यांचे स्वरूप पुंजात्मक किंवा फोटॉनात्मक असते. फोटॉनाची ऊर्जा E ही त्याचा वेग व तरंगलांबी यांवर अवलंबून असते आणि ती
E = h c/λ या समीकरणाने व्यक्त होतेया ठिकाणी h हा प्लांक स्थिरांक (६·६२ X १०-२७ अर्ग-सेकंद) असून, c हा प्रकाशाचा वेग व λत्याची तरंगलांबी आहे. ज्या प्रकाशाची तरंगलांबी कमी त्याच्या फोटॉनाची ऊर्जा तरंगलांबी जास्त असलेल्या प्रकाशापेक्षा जास्त असते,हे यावरून दिसून येईल. [→प्रकाश].
प्रकाश शोषणाचे परिणाम : वस्तूने प्रकाशाचे शोषण केल्यावर प्रकाश ऊर्जा पुरेशी प्रभावी असेल,तर वस्तूतील अणू किंवा रेणू यांमधील इलेक्ट्रॉन केवळ एक किंवा दोन पातळ्या इतकेच केंद्रापासून दूर जात नाहीत,तर ते पूर्णपणे बाहेर फेकले जातात आणि त्यामुळे अणू अथवा रेणू आयनरूप (विद्युत् भारित) होतात. हा प्रकाशविद्युत् परिणाम होय [→ प्रकाशविद्युत्]. अणू अथवा रेणूतील इलेक्ट्रॉन बाहेर फेकण्याइतकी प्रकाश ऊर्जा नसेल,तर इलेक्ट्रॉन वरच्या पातळीवर उचलला जातो व तो परत पूर्वपातळीवर टप्प्याटप्प्याने किंवा एकदम सरळ येतो. असे होताना त्याला मिळालेली ऊर्जा प्रकाशकिरणाच्या रूपाने बाहेर पडते. हे उत्सर्जन तत्काल झाले,तर त्याला अनुस्फुरण व टप्प्यांनी झाले,तर प्रस्फुरण म्हणतात. हे परिणाम प्रकाश भौतिकीय होत [→ संदीप्ति].
रासायनिक विक्रियेचा पुंजीय उतारा : एखाद्या अणूने अथवा रेणूने प्रकाश ऊर्जा शोषण केली म्हणजे तो प्रक्षुब्ध होतो व विक्रिया घडविण्यास प्रवृत्त होतो.
एका फोटॉनात असलेल्या आइन्स्टाइन एककात व्यक्त केलेल्या ऊर्जेचे शोषण झाले असता किती ग्रॅम-रेणू (ग्रॅममध्ये व्यक्त केलेला रेणुभार) संयुगांची विक्रिया घडेल हे दर्शविणाऱ्या संख्येला पुंजीय उतारा म्हणतात. तो कसा ठरवितात हे पुढील आकडेमोडीवरून स्पष्ट होईल. उदा.,हायड्रोजन आयोडाइडाचे २,५३७ Å या तरंगलांबीच्या प्रकाशाने अपघटन झाले (रेणूचे तुकडे झाले) तेव्हा २·३६ X १०९ अर्ग इतकी ऊर्जा शोषली गेली व त्यामुळे १०-३ हायड्रोजन आयोडाइडाच्या ग्रॅम-रेणूचे अपघटन झाले व ०·५ X १०-३ ग्रॅम-रेणू हायड्रोजन व तितकेच आयोडीन यांचे ग्रॅम-रेणू बनले.
यावरून पुंजीय उत्तारा काढण्यासाठी प्रथम या एका फोटॉनात किती ऊर्जा असते ते ठरविले पाहिजे. ती
|
E = h |
c |
= |
६·६२ X १०-२७ X ३ X १०१० |
= ७·८४ X १०-१२ |
|
λ |
२·५३७ X १०-५ |
अर्ग इतकी येते. ती आइन्स्टाइन एककात व्यक्त केली म्हणजे ७·८४ X १०-१२ X ६·०२ X १०२३ आइन्स्टाइन होईल. २·३६ X १०९ अर्ग इतकी जी ऊर्जा शोषली गेली ती आइन्स्टाइन एककात व्यक्त केली,तर
|
२·३६ X १०-९ |
= ५ X १०-४ आइन्स्टाइन येते. |
|
७·८४ X १०-१२ X ६·०२ X १०२३ |
इतक्या आइन्स्टाइन ऊर्जेने१०-३ इतक्या ग्रॅम-रेणू हायड्रोजन आयोडाइडाचे अपघटन झाले म्हणून एका आइन्स्टाइनाने होणाऱ्या अपघटनाचा
|
१०-३ |
= |
१० |
= २पुंजीय उतारा येतो. |
|
५ X१०-४ |
५ |
हायड्रोजन व आयोडीन बनण्याच्या विक्रियेचा पुंजीय उतारा याचप्रमाणे
|
०·५ X १०-३ |
= |
५ |
= १येतो. |
|
५ X१०-४ |
५ |
.
प्रकाशरासायनिक विक्रियांचे प्रकार : वरील प्राथमिक विक्रियेनंतर ज्या रासायनिक विक्रिया होतात त्यांचे पाच प्रकार होतात ते म्हणजे (१) विगमन,(२)अन्योन्य प्रतिष्ठापन,(३)समघटकी बदल, (४) समावेशन व (५) अप्रत्यक्ष प्रकाशग्रहण.
विगमन : (हे एक खास प्रकारचे रासायनिक अपघटनच असून त्यात तयार झालेल्या घटकद्रव्यांपासून योग्य परिस्थितीत पुन्हा मूळ संयुग बनू शकते). या प्रकाराची दोन उदाहरणे खाली दिली आहेत.
(अ) प्रकाशाच्या योगाने होणारे हायड्रोजन आयोडाइडाचे,हायड्रोजन व आयोडीन यांमध्ये होणारे विगमन ४,००० Å हून कमी (उदा.,२,५३७ Å)तरंगलांबी असलेल्या फोटॉनाच्या शोषणाने पुढीलप्रमाणे घडून येते.
HI + hcλ → H + I
त्यानंतर HI + H→ H2 + I
I + I → I2
या तिन्ही विक्रिया एकत्र केल्या म्हणजे
2 HI + hcλ → H2 + I2
असे अंतिम रूप येते. यावरून या विक्रियेचा पुंजीय उतारा २असल्याचे दिसून येते. पुंजीय उताऱ्याच्या प्रत्यक्ष मोजणीतही हे सिद्ध झाले आहे.
(आ) हायड्रोजन व क्लोरीन या वायूंचे मिश्रण अंधारात असताना रासायनिक विक्रिया होत नाहीपरंतु त्यावर दृश्य प्रकाश किंवा निकट जंबुपार किरण पडले,तर विक्रिया होऊन हायड्रोजन क्लोराइड बनते. या विक्रियेत एकापाठोपाठ होणारे पुढील ठप्पे आहेत.
Cl2 + hcλ → 2Cl
Cl + H2 → HCl + H
H + Cl2 → HCl + Cl
परिस्थिती अनुकूल असेल,तर या विक्रियेचा पुंजीय उतारा १०,००,००० पेक्षा जास्त येऊ शकतो.
अन्योन्य प्रतिष्ठापन : हेक्झॅहायड्रोबेंझीन व ब्रोमीन यांमध्ये ४,७६० Å तरंगलांबीच्या प्रकाशाचे शोषण होते आणि हेक्झॅहायड्रोब्रोमोबेंझीन व हायड्रोजन ब्रोमाइड ही संयुगे बनतात. या विक्रियेत हेक्झॅहायड्रोबेंझिनातील एका हायड्रोजनाच्या जागी एक ब्रोमीन अणू प्रतिष्ठापित होतोत्याचप्रमाणे ब्रोमिनाच्या रेणूतील एका ब्रोमीन अणूच्या जागी एक हायड्रोजन अणू प्रतिष्ठापित होतो. म्हणून हे अन्योन्य प्रतिष्ठापनाचे उदाहरण आहे.
|
C6H12 |
+Br2 |
→ |
C6H11Br |
+ HBr |
|
हेक्झॅहायड्रोबेंझीन |
ब्रोमीन |
हेक्झॅहायड्रो-ब्रोमोबेंझीन |
हायड्रोजन ब्रोमाइड |
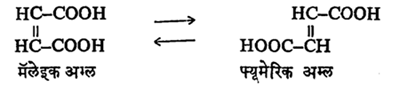
समघटकी बदल : प्रकाशाच्या योगाने घडणाऱ्या समघटकीकरणाचे [→ समघटकता] एक उदाहरण म्हणजे मॅलेइक अम्लाचा जलीय विद्राव २,०७० Å,२,५३० Å व २,८२० Å या तरंगलांबीचा प्रकाश शोषून घेतो व त्यामुळे त्याचे समघटकीकरण होऊन फ्यूमेरिक अम्ल बनते. या विक्रियेचा पुंजीय उतारा ०·०३ इतका असतो.
फ्यूमेरिक अम्लाचेही अशाच तऱ्हेने या प्रकाशाने मॅलेइक अम्लात रूपांतर होत असतेत्या विक्रियेचा पुंजीय उतारा ०·११ इतका असतो.
अशा तऱ्हेने उलटसुलट विक्रिया होत असल्यामुळे समतोल निर्माण होतो,तेव्हा ७५%मॅलेइक व २५%फ्यूमेरिक अम्ल असलेले मिश्रण मिळते.
बहुवारिकीकरण : (दोन वा अधिक साधे रेणू जोडले जाऊन जटिल रेणू असलेले व अधिक रेणुभाराचे संयुग तयार होणे). त्याचे एक उदाहरण म्हणजे अँथ्रॅसिनाचे प्रकाशाच्या योगाने डाय-अँथ्रॅसिनात होणारे रूपांतर. बेंझीन,टोल्यूइन किंवा झायलिन यात विरघळलेले अँथ्रॅसीन ३,६६० Å तरंगलांबीच्या प्रकाशाचे शोषण करते व त्यामुळे त्याच्या दोन रेणूंपासून डाय-अँथ्रॅसिनाचा रेणू बनतो. या विक्रियेचा पुंजीय उतारा ०·४८ असतो.

अंधारात याच्या उलट विक्रिया होऊन डाय-अँथ्रॅसिनाचे अँथ्रॅसीन बनते.
अप्रत्यक्ष प्रकाशग्रहण : प्रकाशरासायनिक विक्रियेसाठी विक्रियेत भाग घेणाऱ्या अणू अथवा रेणूंनीच प्रत्यक्ष प्रकाशग्रहण केले पाहिजे असे नाही. कित्येक अणू अथवा रेणू असे शोषण करू शकत नाहीतपरंतु विक्रिया मिश्रणात,स्वतः प्रकाश शोषण करून प्रक्षुब्ध होणारा व नंतर ऊर्जा दुसऱ्याला देणारा अणू अथवा रेणू उपस्थित असेल,तर प्रकाशरासायनिक विक्रिया घडून येते. अशा तऱ्हेने प्रकाश ऊर्जा प्रदान करण्याच्या कृतीला अप्रत्यक्ष प्रकाशग्रहण म्हणतात.
कार्बन डाय-ऑक्साइड व पाणी यांपासून वनस्पतींमध्ये कार्बोहायड्रेटांचे संश्लेषण या पद्धतीने होते. वनस्पतीतील हरितद्रव्य (क्लोरोफिल) प्रकाश शोषून घेते व मिळालेली ऊर्जा कार्बन डाय-ऑक्साइड आणि पाणी यांच्या रेणूंना देते व त्यामुळे त्यांमध्ये विक्रिया घडून कार्बोहायड्रेटे बनतात [→ प्रकाशसंश्लेषण].
प्रायोगिक योजना : प्रकाशरासायनिक विक्रियांच्या अभ्यासासाठी मुख्यतः चार गोष्टींची आवश्यकता असते. त्या म्हणजे (अ) इष्ट तरंगलांबीच्या प्रकाशाचा उद्गम,(आ) विक्रिया घडविण्यासाठी योग्य घट (पात्र),(इ) विक्रियेची प्रगती जाणण्याची योजना व (ई) ऊर्जामापन करण्याचे साधन,अशा उपकरण संचाचा एक नमुना आकृतीत दाखविला आहे.
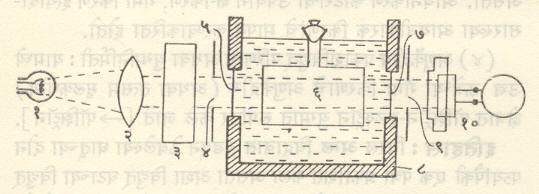
प्रकाश उद्गमासाठी (१)आवश्यकतेप्रमाणे धातूच्या तंतूंचे विद्युत् दिवे,कार्बनाच्या किंवा धातूंच्या विद्युत् प्रज्योती किंवा वायु-विसर्जन नलिका वापरतात [→ विद्युत् दिवे]. विशिष्ट पल्ल्यातील तरंगलांब्यांचा प्रकाश हवा असेल,तर योग्य त्या प्रकाश गाळणीचा (३)उपयोग करतात. दृश्य प्रकाश वापरावयाचा असेल,तर विक्रिया घट काचेचा केलेला असतोपण ३,५०० Å यापेक्षा कमी तरंगलांबीचा प्रकाश वापरावयाचा असेल,तर तो क्वॉर्ट्झचा असावा लागतो. अशा वेळी भिंगासाठी व इतरत्र सर्वत्र काचेऐवजी क्वॉर्ट्झचाच उपयोग करणे आवश्यक असते.
ऊर्जामापनसाठी तपचिती,प्रकाशविद्युत् घट [→ प्रकाशविद्युत्] किंवा रासायनिक ॲक्टिनोमापके वापरतात.
तपचितीमध्ये चांदी व बिस्मथ यांची अनेक तपयुग्मे (दोन निरनिराळ्या धातूंच्या विद्युत् संवाहकांची टोके एकत्र जोडून तयार होणारा व ज्यांच्या संधींमध्ये तापमान फरक असल्यास विद्युत् प्रवाह निर्माण होतो अशी साधने) असून ती काजळी वा प्लॅटिनम ब्लॅक लावलेल्या धातुपट्ट्यांनी एकसरी पद्धतीने (एकाचे चांदीचे टोक दुसऱ्याच्या बिस्मथ टोकास किंवा याच्या उलट) जोडलेली असतात. या पट्ट्यांवर पडणाऱ्या प्रारणाचे शोषण होऊन उष्णता निर्माण होते. त्यामुळे उष्ण संधीचे तापमान शीत संधीपेक्षा वाढते व विद्युत् प्रवाह उत्पन्न होतो अणि तो मोजतात. प्रमाणित प्रकाशाचा उपयोग करून तपचितीचे इयत्तीकरण (ऊर्जा दर्शविणाऱ्या अंशांचे परीक्षण) अगोदर केलेले असले म्हणजे त्यावरून ऊर्जा ठरविता येते.
रासायनिक ॲक्टिनोमापकात प्रकाशसंवेदी वायू किंवा विद्राव यांचा उपयोग केलेला असतो. त्यावर प्रकाश पडला म्हणजे रासायनिक विक्रिया सुरू होते. या विक्रियांचे प्रमाण ऊर्जाशोषणाच्या प्रमाणावर अवलंबून असल्यामुळे विक्रिया किती झाली याचे मापन करून शोषण झालेली ऊर्जा ठरविता येते. उदा., २,००० Å ते ५,००० Å या मर्यादेत उपयोगी पडणाऱ्या एका प्रकारात युरॅनिल ऑक्झॅलेटाचा ज्ञातमूल्य जलीय विद्राव असतो. प्रकाशाच्या योगाने त्याचे अपघटन होते. काही काल प्रकाशाचा परिणाम झाल्यावर किती ऑक्झॅलेट शिल्लक राहिले आहे ते विश्लेषणाने ठरविले म्हणजे त्यावरून ऊर्जाशोषण किती झाले,ते पुढे दिल्याप्रमाणे निश्चित करता येते.
रासायनिक विक्रियेमध्ये किती ऊर्जा शोषली गेली हे ठरविण्यासाठी प्रथम रिकामा विक्रिया घट (विक्रिया वायूंची असेल तर) किंवा विद्रावक भरलेला घट (विक्रिया विद्रावात होणार असल्यास) वापरून ऊर्जामापकाला प्रतिसेकंद किती ऊर्जा मिळते ते मोजतात. समजा ती क्ष आली. नंतर विक्रिया मिश्रण घटात भरून त्याला ऊर्जा दिली असता ऊर्जामापकाला त्यापैकी प्रतिसेकंद किती मिळते ते काढतात. ती य आहे असे समजले,तर क्ष—य इतकी ऊर्जा विक्रिया होताना प्रतिसेकंद शोषिली जाते.
रासायनिक विक्रियेचा वेग मोजण्यासाठी विक्रिया चालू असताना विक्रिया घटातून ठराविक कालखंडातील विक्रिया मिश्रण काढून घेऊन त्याच्या एखाद्या भौतिक गुणधर्माचे मापन करतात. आधुनिक कालात बाष्पवर्णलेखन [→ वर्णलेखन] व अवरक्त वर्णपट यांचा या कामी उपयोग होऊ लागला आहे.
प्रकाशरासायनिक विक्रियांचे महत्त्व व उपयोग : प्रकाश ऊर्जेमुळेच वनस्पतींमध्ये कार्बन डाय-ऑक्साइड व पाणी यांपासून कार्बोहायड्रेट निर्माण होतात. याच विक्रियेत जो ऑक्सिजन सुटा होतो तो हवेस पुरविला जातो. दृष्टीचे कार्यही प्रकाशरासायनिक आहे. वस्तूची प्रतिमा नेत्रातील जालपटलावर पडते तेव्हा त्यातील जांभळ्या द्रव्याचे विरंजन (रंग नाहीसा होणे) होते व त्यामुळेच आपणास वस्तू दिसते. कातडीवर सूर्यप्रकाश पडला म्हणजे आपल्या शरीरात ड जीवनसत्त्व निर्माण होते. अरगोस्टेरॉलापासून जंबुपार प्रारणाने ड२ जीवनसत्त्व (ड जीवनसत्त्वाचा एक घटक) बनवितात [→ जीवनसत्त्व ड].
वातावरणातील उच्च स्तरांत सूर्यप्रकाशमुळे ऑक्सिजनाच्या रेणूपासून त्याचे अणू बनतात. हे अणू व ऑक्सिजन रेणू यांपासून नंतर ओझोन निर्माण होतो. या ओझोनाचे जे आवरण बनले आहे त्यामुळे सूर्यप्रकाशातील ३,००० Å ते २,२०० Å या मर्यादेतील हानिकारक प्रारणापासून पृथ्वीवरील जीवसृष्टीचे संरक्षण होते. [→ ओझोन].
छायाचित्रणात चांदीच्या लवणांवर होणाऱ्या प्रकाशाच्या रासायनिक परिणामाचा उपयोग करण्यात येतो. [→ छायाचित्रण].
इमारतींचे नकाशे,दस्तऐवज इत्यादींच्या नकला करण्यासाठी जो ‘ब्ल्यू प्रिंट’कागद वापरतात त्याला एखादे फेरिक लवण व पोटॅशियम फेरिसायनाइड यांचे मिश्रण लावलेले असते. या कागदावर प्रकाश पडला म्हणजे फेरिक लवणाचे ⇨ क्षपण होऊन फेरस लवण बनतेत्याचा पोटॅशियम फेरिसायनाइडाशी संयोग होऊन निळा रंग बनतो. पातळ कागदावर काढलेली आकृती त्यावर ठेवून वरून प्रखर प्रकाश पाडला व नंतर कागद पाण्यात ठेवला म्हणजे निळ्या पृष्ठावर पांढरी आकृती उमटते. कारण आकृतीतील कोऱ्या जागेतून प्रकाश आत जातो व तेवढ्या भागावरील लवणाचेच फेरस लवणात रूपांतर होते. रेषांखालील भागावर तसा परिणाम होत नाही. त्यामुळे तो भाग पांढरा राहतो. ‘अमोनिया प्रिंटिंग’किंवा ‘डायाझो प्रिंटिंग’नावाचीही नकला करण्याची एक कृती आहे. तीमधील प्रकाश संवेदी मिश्रणात प्रकाशाने अपघटन होणारे एखादे डायाझो संयुग वापरलेले असते. [→ आरेखन,अभियांत्रिकीयडायाझो संयुगे].
संदर्भ : 1. Barrow, G. M. Physical Chemistry, Tokyo, 1961.
2. Maron, S. H. Prutton, C. F. Principles of Physical Chemistry, New York, 1961.
3. Mee, A. J. Physical Chemistry, London, 1962.
कढे, ग. न.शेजवलकर, बा. ग. केळकर,गो. रा.
“