अम्ले व क्षारक: अम्ल (ॲसिड) म्हणजे आंबट पदार्थातील आंबट रूची देणारे द्रव्य, असे अम्लाचे सामान्य वर्णन करता येईल. रुचीला आंबट असून ज्याच्यात काही धातू विरघळतात व जी क्षारकांशी (बेसशी) संयोग पावून ⇨ लवणे तयार होतात अशी द्रव्ये म्हणजे अम्ले, अशी अम्लाची ढोबळ व्याख्या करता येईल. विद्रावातील अम्लांच्या अस्तित्वामुळे लिटमसासारख्या दर्शकाचा रंग बदलतो (निळा लिटमस तांबडा होतो, ⟶ दर्शके लिटमस). अम्ल व क्षारक यांच्या रासायनिक विक्रियेमुळे दोघांचेही लाक्षणिक गुणधर्म नाहीसे होतात व नवीनच गुणधर्म असलेले लवण हे संयुग तयार होते. या प्रक्रियेला ⇨उदासिनीकरण. म्हणतात.
एके काळी प्रत्येक अम्लामध्ये ऑक्सिजन हा घटक अणू असलाच पाहिजे अशी चुकीची समजूत रूढ होती. परंतु १८४० मध्ये फोन लीबिक यांनी असे दाखविले की सर्व अम्लांत ऑक्सिजन असेलच असे नाही, मात्र त्यांमध्ये हायड्रोजन असणे आवश्यक आहे. धातूंवर जेव्हा अम्लांची विक्रिया होते तेव्हा हायड्रोजन वायू बाहेर पडतो. या गुणधर्माचा लीबिक यांनी अम्लाची व्याख्या करण्याकरिता उपयोग केला.
क्षारकाची स्वतंत्र व्याख्या न देता अम्लांशी विक्रिया होऊन लवण देणारी द्रव्ये असे त्यांचे वर्णन करण्यात येते. विद्रावातील क्षारकाच्या अस्तित्वामुळे तांबडा लिटमस निळा होतो. आरंभी सोडियम हायड्रॉक्साइड किंवा पोटॅशियम हायड्रॉक्साइड यांनाच क्षारक म्हणत असत, परंतु रसायनशास्त्राच्या प्रगतीबरोबर नवनवे क्षारक आढळून येऊ लागले. सोडियम व पोटॅशियम या क्षार-धातूंच्या (अल्कली मेटल्स) प्रबल व दाहक हायड्रॉक्साइडांना सामान्यतः क्षार (अल्कली) असे संबोधण्यात येते. क्षारक या संज्ञेत अर्थातच क्षारांचाही समावेश होतो व या दृष्टीने क्षारक ही संज्ञा अधिक व्यापक आहे [⟶ क्षार].
अम्लांचे अकार्बनी व कार्बनी असे दोन वर्ग करता येतील. अकार्बनी अम्लांपैकी हायड्रोक्लोरिक, सल्फ्यूरिक व नायट्रिक ही प्रमुख अम्ले होत. वरील अम्ले व फॉस्फोरिक इ. अम्ले खनिजांपासून काढली जात असल्यामुळे अकार्बनी अम्लांना खनिज अम्ले असेही म्हणतात. कार्बनी अम्लांत ॲसिटिक, टार्टारिक, ऑक्झॅलिक इ. अम्लांचा समावेश होतो.
आयनीभवन : काही रासायनिक द्रव्ये पाण्यात विरघळल्यावर त्यांचे आयनीभवन (विद्युत् भारित अणू, रेणू वा मूलके तयार होणे,⟶ आयन) होते, असा अऱ्हेनियस ह्यांनी १८८७ साली मांडलेला सिद्धांत ग्राह्य झाल्यावर अम्लांचे व क्षारकांचे स्वरूप जास्त स्पष्ट झाले. अम्ल पाण्यात विरघळल्यावर त्याचे आयनीभवन होऊन धन विद्युत् भार असलेला हायड्रोजनाचा आयन (H+) तयार होतो. त्याचप्रमाणे क्षारक विरघळल्यावर त्याचे आयनीभवन होऊन ऑक्सिजन व हायड्रोजन यांचा ऋण विद्युत् भार असलेला हायड्रॉक्सिल आयन (OH–) मुक्त होतो. अम्ले व क्षारक यांच्या या व्याख्या अऱ्हेनियसप्रमाणे ओस्टव्हाल्ट या शास्त्रज्ञांनी स्वतंत्रपणे मांडल्या, म्हणून त्या अऱ्हेनियस-ओस्टव्हाल्ट या जोडीच्या नावाने प्रसिद्ध आहेत.
पाण्यामध्ये अम्लांचे व क्षारकांचे आयनीभवन होऊन आयन सुटे होतात. पण सामान्यतः आयनीभवन कधीच पूर्ण होत नसते. आयनीभवन न झालेले रेणू व समप्रमाणात धन- आणि ऋण-विद्युत् भारित आयन एकाच वेळी पाण्यात असतात. उदा., HA हा अम्लाचा रेणू आहे असे मानले तर पाण्यात HA या रेणूबरोबर H+ व A– असे दोन आयन समप्रमाणात असतात.
![]()
ही विक्रिया पूर्णत्वाला जात नसल्यामुळे ती व्युत्क्रमी (उलटसुलट दिशांनी होणारी) संतुलित विक्रिया बनते. म्हणून बाणांची उलटसुलट टोके काढून संतुलित विक्रिया दर्शवितात.
कोणत्याही अम्लाच्या आयनीभवनाच्या प्रमाणावरून त्याची प्रबलता ठरवितात. आयनीभवन मोजण्याच्या विविध पद्धतींपैकी एक म्हणजे विद्रावाच्या विद्युत् संवाहकतेचे मापन करणे. त्या मापनावरून विद्रावात आयनीभवन किती झाले आहे हे समजते. विद्युत् संवाहकता नसेल तर आयनीभवन मुळीच झाले नाही असे ठरविता येते.
हायड्रोक्लोरिक व नायट्रिक अम्ले फार प्रबल आहेत असे मानतात. पाण्यातील विरल विद्रावात त्यांचे आयनीभवन जवळजवळ पूर्णत्वाला जाते. म्हणजे या अम्लांच्या शंभर रेणूंपासून हायड्रोजनाचे जवळजवळ शंभर H+आयन बनतात. उलट पक्षी कार्बनी अम्लांतील असेच प्रमाण तीन किंवा चार टक्क्यांपेक्षा जास्त नसते. अम्लांची प्रबलता ही त्यांच्या विद्रावातील H+ आयनांच्या प्रमाणावर अवलंबून असते. एक ग्रॅम-रेणुभार (ग्रॅम एककातील रेणुभार, ⟶ रेणुभार) हायड्रोक्लोरिक अम्ल व एक ग्रॅम-रेणुभार ॲसिटिक अम्ल यांचा एक लिटर पाण्यात विद्राव तयार केला तर हायड्रोक्लोरिक अम्लाचा विद्राव जास्त आंबट लागेल व त्याची जस्तासारख्या धातूवरील विक्रिया जास्त जोराने होईल. त्या मानाने ॲसिटिक अम्लाच्या विद्रावात अम्लाचे गुणधर्म फारच कमी प्रबल असतील.
अम्लांचे वरील विवेचन क्षारकांनाही लागू पडते. पाण्यात क्षारकांच्या रेणूंचे आयनीभवन होऊन ऋण विद्युत् भारवाही OH– आयन व रेणूचा उरलेला भाग धन विद्युत् भारवाही होतो. क्षारकाच्या रेणूचे सूत्र BOH मानले तर त्याचे आयनीभवन ![]() असे होते. ही विक्रिया पूर्णत्वाला जात नाही, हे या समीकरणावरून दिसून येईल. कोणत्याही क्षारकाची प्रबलता ही त्याच्या विद्रावातील OH–आयनांच्या प्रमाणावर अवलंबून असते.
असे होते. ही विक्रिया पूर्णत्वाला जात नाही, हे या समीकरणावरून दिसून येईल. कोणत्याही क्षारकाची प्रबलता ही त्याच्या विद्रावातील OH–आयनांच्या प्रमाणावर अवलंबून असते.
आयनीभवन-स्थिरांक : अम्ले व क्षारक यांचे वरील वर्णन केवळ गुणात्मक आहे. समतोल विक्रियांचे समीकरण वापरून अम्लांची किंवा क्षारकांची प्रबलता दर्शविणारे आयनीभवन-स्थिरांक म्हणजे अम्ल-स्थिरांक व क्षारक-स्थिरांक काढता येतात. ही पद्धती विशेषतः दुर्बल अम्ले व दुर्बल क्षारक यांच्या बाबतीत उपयुक्त असते. HA हे अम्लाचे सूत्र मानले तर त्याचा अम्ल-स्थिरांक Ka हा पुढील समीकरणांवरून काढता येतो :

वरील समीकरणांतील चौकोनी कंसातील चिन्ह हे त्या घटक-द्रव्याची सांद्रता दाखविते. सांद्रतेचे मापन दर लिटरात त्या द्रव्याचा ग्रॅम-आयनभार किंवा रेणुभार किती आहे यावरून करतात. समीकरणातील अंशाच्या जागी H+ व A— यांच्या सांद्रतांचा गुणाकार मांडून छेदाच्या जागी आयनीभवन न झालेल्या HA रेणूंची सांद्रता मांडतात. त्यावरून Kaया अम्ल-स्थिरांकाचे मूल्य कळते. क्षारकांचा प्रबलता-दर्शक स्थिरांक Kb पुढील रीतीने काढला जातो :
![]()
तापमान स्थिर असताना स्थिरांक बदलत नाही परंतु तापमान बदलले तर स्थिरांकाचे मूल्य बदलते.

विद्रावाची विद्युत् संवाहकता मापून दोन अम्लांच्या किंवा क्षारकांच्या प्रबलतांची तुलना करता येते.
अम्लांच्या व क्षारकांच्या आयनीभवनाचा विचार करीत असताना शुद्ध पाण्याचेही आयनीभवन होते हे ध्यानात घ्यावे लागते. शुद्ध पाण्याचे सूत्र H2O किंवा H-O-H असले तरी पाण्यात फक्त H-O-H रेणूच असतात, असे नाही.
H-O-H रेणूचे H-O-H ⇌ H+ +OH– असे आयनीभवन अत्यंत अल्प प्रमाणात होत असते. वारंवार ऊर्ध्वपातन करून (उकळून व वाफ थंड करून) अतिशय शुद्ध केलेले पाणीही किंचित विद्युत् संवाहक असते. त्या संवाहकतेवरून दर लिटरात १ X १०-७ ग्रॅम-आयनभार एवढे पाण्याचे आयनीभवन २५० से. ला होत असते, असे आढळून आले आहे.
![]()
पाण्याच्या या समतोल विक्रियेचे मात्रात्मक स्वरूप खालीलप्रमाणे दाखविता येते :
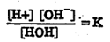
पाण्याचे आयनीभवन अतिसूक्ष्म असल्यामुळे पाण्याच्या सांद्रतेचे [HOH] हे पद पाण्याच्या मूळ सांद्रतेएवढेच असते म्हणून ते स्थिर आहे असे मानता येईल. वरील K ह्या स्थिरांकाला [HOH] ह्या स्थिर संख्येने गुणले
[H+] [OH–] = K [HOH] = Kwतर हा नवीन Kw गुणाकार येईल. त्याला ‘पाण्याचा आयनी-स्थिरांक’ म्हणतात. तो महत्त्वाचा असून त्याचे मूल्य २५० से. ला १ X १०-१४ एवढे असते.
हायड्रोजन आयन H+ची सांद्रता १ X १०-७ या किंवा अशाच अपूर्णांकाने दाखविण्याऐवजी १९०९ साली सरेन्सन यांनी सुचविलेली एक नवीन सोपी पद्धती आता वापरली जाते. तिला ‘pH मापन-श्रेणी’ म्हणतात. H+ सांद्रता pH मापन यांचे परस्पर-नाते पुढील समीकरणांवरून स्पष्ट होईल :
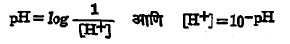
H+ची सांद्रता १० च्या ऋण pH च्या घाताएवढी असते. ह्यावरून, एखाद्या विद्रावाचे pH मूल्य जितके जास्त तितकी H+ची सांद्रता कमी, हे स्पष्ट होईल. ह्या पद्धतीप्रमाणे शुद्ध पाण्याचे pH मूल्य ७ आहे. एका लिटरात १/१० ग्रॅम-रेणुभार असलेल्या हायड्रोक्लोरिक अम्लाच्या विद्रावाचे pH मूल्य १ असते. १/१० ग्रॅम रेणूऐवजी एक ग्रॅम-रेणुभार हायड्रोक्लोरिक अम्ल असेल तर त्या विद्रावाचे pH मूल्य ० होईल. प्रबल अम्लांच्या विद्रावांचे pH मूल्य फार कमी असते. त्या मानाने कमी प्रबल अम्लांच्या विद्रावांचे pH मूल्य सापेक्षतः जास्त असते. परंतु कोणत्याही अम्लाच्या विद्रावाचे pH मूल्य सातापेक्षा जास्त असणार नाही [⟶ पीएच मूल्य].
पाणी केवळ शुद्ध असतानाच त्याचा Kw हा १ X १०-१४ एवढा असतो असे नसून अम्ले, क्षारक व लवणे यांच्या पाण्यातील विद्रावांचा आयनगुणाकारसुद्धा तेवढाच राहतो, ही महत्त्वाची गोष्ट आहे. पाण्यातील अम्लाच्या विद्रावातील H+ ची सांद्रता जास्त तर OH—ची कमी असते. तथापि दोहोंचा गुणाकार मात्र Kw एवढा म्हणजे १X१०-१४ असतो. विद्रावातील अम्लाच्या सांद्रतेनुसार H+ ती सांद्रता १ X १०-२असेल, तर OH– ची सांद्रता १X१०-१२ होईल.
क्षारकांच्या विद्रावातील OH– बरोबर H+ सुद्धा असतात. सांद्रतांचा गुणाकार आयनगुणाकाराएवढाच म्हणजे १ X १०-१४ असतो. प्रत्येक लिटरात १/१० रेणुभाराएवढे सोडियम हायड्रॉक्साइड असलेल्या विद्रावातील OH– ची सांद्रता १ X १०-१ एवढी असली तर H+ ची सांद्रता १ X१०-१३ एवढी होईल.
पाण्यातील प्रत्येक विद्रावात H+ ची कमीअधिक सांद्रता नेहमी असतेच. म्हणून क्षारकांच्या किंवा लवणांच्या विद्रावांसाठी PH मापन-पद्धती वापरता येते, हा pH मापन-पद्धतीचा आणखी एक फायदा आहे. सोडियम हायड्रॉक्साइडाच्या किंवा अमोनियाच्या विद्रावातील OH– ची सांद्रता शुद्ध पाण्यातील OH– च्या सांद्रतेपेक्षा नेहमीच जास्त असते पण त्यांच्या विद्रावातील H+ ची सांद्रता १X१०-७ पेक्षा त्याच प्रमाणात कमी असते. तथापि क्षारकाच्या H+ ची सांद्रता कळली तर OH– ची सांद्रता आपोआपच कळते. क्षारकांच्या विद्रावांचे pH मूल्य पाण्याच्या pHमूल्यापेक्षा म्हणजे सातापेक्षा नेहमीच जास्त असते. एका लिटरात एक रेणुभार सोडियम हायड्रॉक्साइड असलेल्या विद्रावातील OH– ची सांद्रता एक असेल तर H+ ची सांद्रता १ X १०-१४ इतकी कमी असेल व विद्रावकाचे pH मूल्य १४ होईल. लवणाच्या पाण्यातील विद्रावाच्या H+आणि OH– यांच्या सांद्रतेवरून त्याचे pH मूल्यही वरील रीतीने ठरविता येते.
सरेन्सन यांच्या pH पद्धतीची मांडणी सोयीची असल्यामुळे इतरत्रही ती वापरण्यात येते. उदा., pOH, pKw, pKv इ. संज्ञा वापरल्या जातात. त्यांचा अर्थ पुढील समीकरणांवरून स्पष्ट होईल :
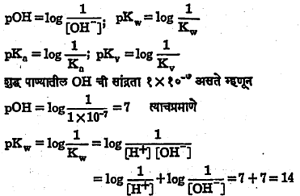
पाण्यात प्रबल अम्लांचे व क्षारकांचे पूर्ण आयनीभवन होते.
सोडियम हायड्रॉक्साइडाच्या विद्रावात Na+ व OH– आणि हायड्रोक्लोरिक अम्लाच्या विद्रावात H+ व Cl–आयन असतात. हे दोन विद्राव योग्य प्रमाणात मिसळल्यावर पुढील विक्रिया होते :
Na+ + OH– + H+ + Cl– = Na+ + Cl– + HOH
या विक्रियेत Na+ व Cl– हे आयन बदल न होता मिश्रण होण्यापूर्वी होते तसेच राहतात. ते एकत्र येतात तेव्हा त्यांना लवणाचे गुणधर्म येतात. परंतु H+व OH– आयन एकत्र येतात तेव्हा त्यांचा संयोग होऊन पाणी तयार होते व H+आणि OH– हे आयन नाहीसे होतात, म्हणजे अम्लातील अम्ल-गुणधर्म देणारे आयन व क्षारकांतील क्षारीय गुणधर्म देणारे आयन स्वतंत्र न राहता पाण्यात समाविष्ट होतात. त्यांचे उदासिनीकरण होते व नवीन गुणधर्म असलेले लवण अस्तित्वात येते.
अम्लातील H+ हा महत्त्वाचा अम्लधर्मी घटक असतो. काही अम्लांच्या रेणूत एकाऐवजी दोन किंवा तीन H+आयन असतात. त्यांना ‘बहुक्षारकीय अम्ले’ म्हणतात. सल्फ्यूरिक अम्ल व फॉस्फोरिक अम्ल ही अशा अम्लांची उदाहरणे होत. अशा अम्लांचे आयनीभवन टप्प्याटप्प्याने होते व प्रत्येक टप्प्याचा स्वतंत्र अम्ल-स्थिरांक असतो.
त्याचप्रमाणे बहुअम्लीय क्षारकही असतात व त्यांचे उदासिनीकरण टप्प्याटप्प्याने होते. एक लिटरात एक ग्रॅम-रेणुभार फॉस्फोरिक अम्ल असणाऱ्या विद्रावात एक रेणुभार सोडियम हायड्रॉक्साइड असणारा विद्राव घातला तर फॉस्फोरिक अम्लाच्या तीन H+आयनांपैकी एकाचेच उदासिनीकरण होऊन NaH2PO4 हे लवण तयार होते. त्याच्या पुढील टप्प्यात Na2HPO4 आणि शेवटच्या टप्प्यात Na3PO4 तयार होते. H+आयन असलेल्या लवणांना ‘अम्लीय लवणे’ म्हणतात. ज्यांच्यापासून दोन किंवा अधिक OH– आयन मिळतात असे बहुअम्लीय क्षारकही असतात उदा., Ca (OH)2 आणि Al (OH)3.
बहुक्षारकीय अम्लांच्या विद्रावांच्या सांद्रतेची नोंद प्रत्येक लिटराला एक ग्रॅम-रेणुभार अशी न करता H+च्या संख्येनुरूप त्यांचा ग्रॅम-सममूल्यभार ठरविला जातो. एक ग्रॅम-रेणुभाराला त्याच्यातून निघणाऱ्या H+आयनांच्या संख्येने भागून अम्लांचा ग्रॅम-सममूल्यभार मिळतो. एक ग्रॅम-रेणुभार फॉस्फोरिक अम्ल हे त्याच्या तीन ग्रॅम-सममूल्यभाराएवढे असते, तसेच एक ग्रॅम-रेणुभार सल्फ्यूरिक अम्ल हे त्याच्या दोन ग्रॅम-सममूल्यभाराएवढे असते. सल्फ्यूरिक अम्लाचा ग्रॅम-रेणुभार ९८ ग्रॅ. आहे, तर ग्रॅम-सममूल्यभार ४९ ग्रॅ. आहे. क्षारकांच्या बाबतीतही हीच पद्धती वापरली जाते. सोडियम हायड्रॉक्साइडाचा ग्रॅम-रेणु-भार व ग्रॅम-सममूल्यभार तोच म्हणजे ४० ग्रॅम आहे. परंतु कॅल्शियम हायड्रॉक्साइडाचा ग्रॅम-रेणुभार ७४ ग्रॅ. आहे व ग्रॅम-सममूल्यभार निम्मा म्हणजे ३७ ग्रॅ. आहे. यावरून ग्रॅम-रेणुभार व ग्रॅम-सममूल्यभार यांच्यामधील संबंध स्पष्ट होईल.
एखाद्या अम्लाच्या विद्रावात अम्ल किती आहे, हे एखाद्या ज्ञात सांद्रतेच्या क्षारकाबरोबर ⇨ अनुमापन करून ठरवितात.
लवणांचे प्रकार: विवेचनाच्या सोयीसाठी लवणांचे पुढील चार प्रकार केले जातात : (१) प्रबल अम्ल व प्रबल क्षारक यांच्या उदासिनीकरणाने झालेली, (२) प्रबल अम्ले व दुर्बल क्षारक यांच्या संयोगाने तयार झालेली, ( ३ ) दुर्बल अम्ले व प्रबल क्षारक यांच्या संयोगाने झालेली व (४) दुर्बल अम्ले व दुर्बल क्षारक यांच्या संयोगाने झालेली [⟶ लवणे].
जलेतर विद्रावक: आतापर्यंत केलेल्या विवेचनातील अम्ले व क्षारक यांचे विद्राव पाण्यातील होते. पाणी हा बहुगुणी व शुद्ध स्वरूपात सहज उपलब्ध होणारा असा विद्रावक (विरघळविणारा पदार्थ) आहे. पण पाण्याशिवाय इतर अनेक विद्रावक आहेत व कित्येक उद्योगधंद्यांत आणि प्रयोगशाळांत त्यांचा उपयोग मोठ्या प्रमाणात केला जातो. काही रासायनिक द्रव्ये पाण्यात विरघळत नाहीत. त्यांचा विद्राव करण्यासाठी इतर विद्रावकांचा उपयोग केला जातो. जलेतर विद्रावकांपैकी काही कार्बनी व काही अकार्बनी असतात. अकार्बनी विद्रावकांत द्रवरूप अमोनिया, सल्फर डाय-ऑक्साइड, हायड्रोजन सल्फाइड, हायड्रोक्लोरिक अम्ल इत्यादींचा समावेश होतो. कार्बनी विद्रावकांत निर्जल ॲसिटिक अम्ल, क्लोरोफॉर्म व कार्बन टेट्राक्लोराइड यांचा समावेश होतो. कार्बनी विद्रावकांमध्ये काही अम्लांची व क्षारकांची परस्पर-विक्रिया होऊ शकते व अनुमापन करून अशा विद्रावकांमधील काही अम्ले व कार्बनी क्षारक यांचे प्रमाणीकरण करणे शक्य असते.
फक्त पाण्यामध्येच आयनीभवन होते व प्रत्येक उदासिनीभवन-विक्रियेत H+आणि OH– आयनांच्या संयोगाने पाणी तयार होते, असे आतापर्यंतच्या वर्णनावरून वाटेल पण तसे मानणे बरोबर नाही. उदा., अमोनिया विद्राव वापरून केलेली पुढील विक्रिया पहा :
![]()
उदासिनीकरणाच्या इतर विक्रियांप्रमाणे या विक्रियेचासुद्धा अभ्यास करता येतो.
अम्ल-क्षारक सिद्धांत: अऱ्हेनियस यांच्या सिद्धांताप्रमाणे हायड्रोजन असलेल्या ज्या संयुगांपासून पाण्यात H+आयन तयार होतात ते अम्ल व ज्यां हायड्रॉक्साइडांचे पाण्यात विगमन होऊन OH – आयन तयार होतात ते क्षारक. परंतु या सिद्धांताचा व्याप अम्ले व क्षारक यांच्या पाण्यातील विद्रावापुरताच मर्यादित आहे, म्हणून अधिक व्यापक असा सिद्धांत शोधून काढण्याचे प्रयत्न झाले आहेत. १९२३ साली ब्रॉन्स्टेड व लौरी यांनी स्वतंत्रपणे प्रयोग करून अम्ल व क्षारक यांविषयी सिद्धांत सुचविले होते. त्यांचा मथितार्थ सारखाच असून तो ‘ब्रॉन्स्टेड-लौरी यांचा अम्ल-क्षारकांचा सिद्धांत’ या नावाने ओळखला जातो. त्याचा सारांश असा :
हायड्रोजनाच्या ⇨ समस्थानिकांपैकी सर्वांत सामान्य म्हणजे H1 हा होय. व त्या समस्थानिकापासून तयार होणारा हायड्रोजन आयन प्रोटॉन असतो. ब्रॉन्स्टेड-लौरी-सिद्धांताप्रमाणे अम्ल-क्षारक-विक्रियेत प्रोटॉनाचे स्थलांतर होत असते. अम्ल प्रोटॉन गमावीत असते, त्याला’प्रोटॉनदाता’ असे म्हणता येईल. क्षारक हा प्रोटॉन मिळवीत असतो, त्याला ‘प्रोटॉन-ग्रहण’ म्हणता येईल. म्हणून प्रोटॉन देतात ती अम्ले, व प्रोटॉन ग्रहण करतात ते ‘क्षारक’, अशा त्यांच्या व्याख्या होतात. उदा., वायुरूप हायड्रोक्लोरिक अम्ल व वायुरूप अमोनिया यांच्यामधील विक्रिया ही ब्रॉन्स्टेड-लौरी यांच्या अम्ल-क्षारक-विक्रिया-सिद्धांताचे उदाहरण म्हणून देता येईल.
![]()
येथे हायड्रोक्लोरिक अम्लाने एक प्रोटॉन H+ गमावला आणि अमोनियाने एक प्रोटॉन मिळविला. यातील हायड्रोजन क्लोराइडाचे कार्य अम्लाप्रमाणे व अमोनियाचे कार्य क्षारकाप्रमाणे झालेले आहे.
अऱ्हेनियस यांच्या सिद्धांताशी तुलना करता या सिद्धांतातील क्षारकाची व्याख्या अधिक व्यापक असून ज्याच्यात OH– आयन आहे अशा संयुगांपुरतीच ती मर्यादित नाही, परंतु अम्लाविषयीच्या कल्पनेत फारसा बदल होत नाही.
ल्यूइस सिद्धांत: वरील सिद्धांत मांडला गेला त्या सुमारास ल्यूइस यांनीही एक अधिक व्यापक सिद्धांत सुचविला होता व १९३८ साली तो पुनः सुचविल्यावर त्याच्याकडे बरेच लक्ष गेले. ल्यूइस यांच्या मते अम्ल-क्षारक-विक्रिया ही संबंधित द्रव्यांच्या रासायनिक गुणधर्मांवर अवलंबून नसून कोणत्या प्रकारचा बंध तयार होतो यावर अवलंबून असते. ल्यूइस यांच्या व्याख्या अशा आहेत : जो क्षारकापासून इलेक्ट्रॉनांची जोडी घेऊ शकतो असा पदार्थ म्हणजे अम्ल होय व जो इलेक्ट्रॉनांची जोडी देऊ शकतो असा कोणताही पदार्थ म्हणजे क्षारक होय. ल्यूइस यांची क्षारकाची व्याख्या ब्रॉन्स्टेड-लौरी यांच्या व्याख्येसारंखीच जवळजवळ आहे. पण अम्लाची व्याख्या अधिक व्यापक आहे. उदा., या व्याख्येप्रमाणे जवळजवळ कोणताही ऋणायन (धन विद्युत् भारित गट) आणि BF3, SO3 सारखी द्रव्ये अम्ले ठरतील. ब्रॉन्स्टेड-लौरी यांच्या मानाने ल्यूइस यांच्या व्याख्या अधिक व्यापक आहेत. परंतु अम्लांचे परिचित गुणधर्म दाखविण्याच्या दृष्टीने त्या अधिक संदिग्ध ठरतात. तथापि या सिद्धांताचा गुण म्हणजे तो जलेतर विद्रावांतील विक्रिया व घनस्थितीतील विक्रिया यांच्या बाबतीतही लागू पडतो.
उसानोविच सिद्धांत: उसानोविच यांनी १९३९ साली अम्ल-क्षारकांविषयी एक अतिशय व्यापक सिद्धांत सुचविला होता व त्याला कधीकधी ‘धन-ऋण सिद्धांत’ म्हणतात. त्यांची अम्लाची व्याख्या अशी आहे : अम्लांची क्षारकांशी विक्रिया होऊन लवणे तयार होतात. अम्ले ऋणायन (कॅटायन) गमावितात व धनायन (ॲनायन) आणि मुक्त इलेक्टॉन यांच्याशी ती जोडली जातात. त्यांची क्षारकाची व्याख्या अशी आहे : क्षारक धनायन अथवा इलेक्ट्रॉन गमावितात व ऋणायनाशी जोडले जातात. पुढील उदाहरणावरून अम्ल-क्षारक विक्रियांच्या या सिद्धांताप्रमाणे होणाऱ्या स्पष्टीकरणाची कल्पना येईल :

पहिल्या उदाहरणात तयार SO3 हे धनायन O— — घेऊन SO4– – तयार होते, म्हणून ते अम्ल आहे. दुसऱ्या उदाहरणातील C12 हे इलेक्ट्रॉन घेऊन Cl— तयार होत असल्यामुळे ते अम्ल आहे. दुसऱ्या समीकरणातील उदाहरण हे सामान्यतः ज्यांना ‘ऑक्सिडीभवन-क्षपणविक्रिया’ म्हणतात अशांचे उदाहरण आहे व अशा विक्रियांचा विचार या सिद्धांताप्रमाणे करता येतो. परंतु या सिद्धांतातील व्याख्या अतिव्याप्त आहेत, म्हणून त्यांचा स्वीकार विशेष प्रमाणात झालेला नाही.
पहा : लवणे विद्युत् रसायनशास्त्र.
संदर्भ : Snyder, M. K. Chemistry of Structure and Reactions, New York & London, 1966.
बर्वे, प. म.