अनुमापन: (रसायनशास्त्र) एखाद्या विद्रावात एखाद्या द्रव्याची किती मात्रा आहे हे, त्या द्रव्याशी विक्रिया करील अशा दुसऱ्या एखाद्या द्रव्याचा विद्राव त्यात हळूहळू घालून ठरविण्याच्या पद्धतीला अनुमापन म्हणतात. ज्या द्रव्याची मात्रा ठरवावयाची असेल त्याच्या विद्रावाला ‘विश्लेष’म्हणतात व ज्या विक्रियाकारक विद्रावाने अनुमापन करावयाचे (याची संहती म्हणजे त्यातील द्रवाची मात्रा ज्ञात असते) त्याला अनुमापक म्हणतात.
विश्लेषण करावयाच्या पदार्थाची ज्ञात वजनाची मात्रा घेऊन त्याचा सोईस्कर असा ज्ञात घनफळाचा विद्राव केलेला असतो. त्याच्यापैकी ज्ञात घनफळाचा अंश अनुमापनासाठी वापरतात.
अनुमापकाची संहती म्हणजे त्याच्या एक लिटर विद्रावातील विक्रियाकारकाची मात्रा ही अचूक माहीत असावी लागते.
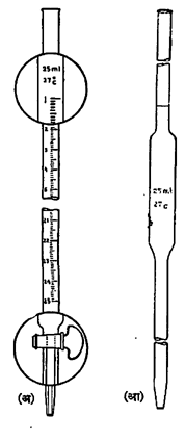
आ. १ मध्ये दाखविल्यासारख्या मोजनळीत अनुमापक विद्राव घेऊन त्याची थोडी थोडी भर चंचुपात्रात ठेविलेल्या विश्लेष्य विद्रावात विक्रिया पूर्ण होईपर्यंत घातली जाते. विक्रिया पूर्ण होण्याच्या अवस्थेला ‘अंतिम बिंदू’ म्हणतात. तो कसा ओळखावा ते पुढे सांगितले आहे. समजा, हायड्रोक्लोरिक अम्लाच्या एखाद्या विद्रावात त्याची मात्रा किती आहे हे ठरवावयाचे आहे व त्यासाठी एका लिटरात ०·१ ग्रॅमरेणू (ग्रॅममध्ये व्यक्त केलेल्या रेणूभाराचा एक दशांश इतके वजन) इतक्या संहतीचा सोडियम हायड्रॉक्साइडचा विद्राव अनुमापक म्हणून घेतला आहे. या उदाहरणातील अम्ल व क्षारक (अम्लाशी विक्रिया होऊन लवण देणारे द्रव्य) यांची विक्रिया पुढे दिल्याप्रमाणे होऊन उदासीनीकरण (ना क्षारकधर्मी ना अम्लधर्मी असे होणे) होते.
HCl+NaOH → NaCl +H2O
म्हणजे सोडियम हायड्रॉक्साइडचा एक ग्रॅमरेणू हायड्रोक्लोरिक अम्लाच्या एका ग्रॅमरेणूचे उदासीनीकरण करतो, हे उघड आहे. आपण घेतलेल्या नमुन्यातील हायड्रोक्लोरिक अम्लाचे पूर्ण उदासीनीकरण होईल, त्या क्षणापर्यंत अनुमापकाची भर पडल्यावर,त्याच्यातील सोडियम हायड्रॉक्साइडच्या रेणूंची संख्या ही अनुमापनाच्या प्रारंभी विद्रावातील हायड्रोक्लोरिक अम्लाच्या रेणूसंख्येइतकी भरेल. समजा, वरील संहतीच्या सोडियम हायड्रॉक्साइड विद्रावाची १०मिली. इतकी भर घातल्यावर उदासीनीकरण पूर्ण झालेले आहे. यावरून अनुमापक घातल्यावर पडलेली सोडियम हायड्रॉक्साइडाच्या ग्रॅमरेणूची भर पुढे दिल्याप्रमाणे होईल.
|
१० मिलि.X |
०·१००० ग्रॅरे. |
= ०··००१ ग्रॅमरेणू |
|
१०००मिलि. |
म्हणून अनुमापन केलेल्या विश्लेष्यातील हायड्रोक्लोरिक अम्लाची मात्रा तेवढीच म्हणजे ०·००१ ग्रॅमरेणू (ग्रॅरे.) होईल.
हायड्रोक्लोरिक अम्लाचा एक ग्रॅमरेणू म्हणजे ३६·४७ ग्रॅ. म्हणून ०·००१ ग्रॅमरेणू म्हणजे ०·००१ ×३६·४७ = ०·०३६४७ ग्रॅ. इतकी ती मात्रा भरेल.
दर्शक व उपकरणे :अनुमापकाची भर घालीत असताना त्याची व विश्लेष्याची विक्रिया केव्हा पूर्ण झाली हे अचूक माहीत असणे आवश्यक असते. विश्लेष्य व अनुमापक ही दोन्ही वर्णहीन असली व त्यांच्या विक्रियेमुळे होणारा पदार्थ रंगीत असला किंवा विश्लेष्य व अनुमापक यांपैकी एक किवा दोन्ही रंगीत असून विक्रियेनंतर विद्राव वर्णहीन होत असला, म्हणजे अंतीम बिंदू ओळखणे शक्य असते. परंतु ती दोन्ही व विक्रिया पूर्ण झाल्यानंतरचा विद्राव ही सर्व वर्णहीन असली म्हणजे अंतिम बिंदू ओळखण्यासाठी एखाद्या दर्शकाची जरूरी असते. [→दर्शके]. अम्ल व क्षारक यांच्या अनुमापनात फिनॉलप्थॅलीन किंवा मिथिल ऑरेंज या दर्शकांचा उपयोग सामान्यतः करतात. उदा., वर उल्लेख केलेल्या उदाहरणातील हायड्रोक्लोरिक अम्लाचे अनुमापन करण्यापूर्वी चंचुपात्रातील विद्रावात फिनॉलप्थॅलीनाच्या विद्रावाचे काही थेंब टाकले, तर त्या मिश्रणात यत्किंचित अम्ल असेपर्यंत तो वर्णहीन राहतो. उदासिनीकरणास आवश्यक तेवढ्याच अनुमापकाची भर पडली म्हणजे जी अवस्था येते, तिला सममूल्य बिंदू म्हणतात. त्यानंतर क्षारकाची यत्किंचित भर पडताच मिश्रणाचा रंग लालसर होतो. या रंग बदलण्याच्या अवस्थेला ‘अंतिम बिंदू’ म्हणतात. अंतिम बिंदूशी सममूल्य बिंदू शक्य तितका जुळता राहील अशी काळजी घ्यावी लागते. म्हणून शेवटी शेवटी अनुमापकाची भर थेंबा थेंबाने घालतात.विश्लेष्य व अनुमापक यांच्या रासायनिक गुणधर्मास अनुसरुन निरनिराळे दर्शक वापरावे लागतात.
योग्य उपकरणे तयार केली तर वायुरूप, घनरूप किंवा वितळलेले पदार्थ घेऊनही अनुमापन करणे अशक्य नाही, तथापि अनुमापन हे जवळ जवळ विद्राव वापरून केले जाते. अनुमापनासाठी सामान्यतः वापरली जाणारी उपकरणे म्हणजे (१)विक्रिया करण्याचे चंचुपात्र किंवा चंबू : ज्या पदार्थातील द्रव्याची मात्रा ठरवावयाची असते त्याचा विद्राव सामान्यतः या पात्रात घेतला जाते. (२) शोषनळी : अनुमापनाच्या सुरुवातीस लागणाऱ्या नमुन्याचा विद्राव विक्रिया-पात्रात ज्ञात घनफळ असलेल्या शोषनळीने काढून घेतात. (३) मोजनळी : हिच्यात अनुमापक विद्राव भरलेला असतो व हिच्यातील अनुमापकाची मोजकी भर विक्रिया पात्रातील विद्रावात घालता येते.
विक्रियाकारक नीट मिसळला जावा म्हणून विद्राव ढवळण्यासाठी एखादी काचेची सळई वापरावी लागते किंवा विक्रिया-पात्र हालवावे लागते.
या पद्धतीत जे विद्राव वापरले जातात त्यांची घनफळे मोजून त्यांच्यातील पदार्थांची मात्रा ठरविली जाते, त्यामुळे ही पद्धती मापी आहे. मापी विश्लेषण हे भारात्मक म्हणजे वजनी विश्लेषणापेक्षा सुलभ असते व पुष्कळ जलदही करता येते. या पद्धतीची अचूकता घनफळ मोजण्याच्या अचूकतेवर अवलंबून असते. विद्रावाचे घनफळ तापमानास अनुसरून कमीजास्त होत असते ही गोष्ट लक्षात घेतली नाही तर, घनफळाच्या मापनात थोडीशी चूक होण्याचा संभव असतो. म्हणून मापी पद्धतीने मिळणारी फले भारात्मक पद्धतीने मिळणाऱ्या फलांइतकी अचूक नसतात.
अनुमापन पद्धती वापरता येण्यासाठी पुढील गोष्टी आवश्यक असतात. (१) विश्लेष्य व अनुमापक यांच्यामधील विक्रिया एकाच रासायनिक समीकरणास अनुसरून सरळसरळ पुरी होणारी असली पाहिजे. (२) ज्याची मात्रा शोधून काढायची आहे तो पदार्थ अनुमापन चालू असता कोणत्या क्षणी संपला, हे दाखविणारा एखादा दर्शक उपलब्ध असला पाहिजे. योग्य दर्शक हा सममूल्य बिंदू आल्यावर अत्यल्प कालात ज्याचा रंग बदलतो असा किंवा सममूल्य बिंदूची अवस्था येता क्षणी ज्याचा एकाएकी अवक्षेप (साका) तयार होईल असा पदार्थ असावा लागतो. (३) विश्लेष्य व अनुमापक यांच्यामधील विक्रिया वेगवान असावी लागते व (४) अनुमापनात वापरले जाणारे मानक विद्राव (ज्या विद्रावात विरघळलेल्या पदार्थाचे वजन किती आहे हे माहीत आहे असा विद्राव) सहज तयार करता येतील सुलभपणे वापरता येतील असे असावे लागतात.
अनुमापन पद्धतीचे अनेक प्रकार आहेत व त्यांचे वर्गीकरणही अनेक रीतींनी केले जाते. त्यांपैकी एक सामान्य पद्धती येथे अनुसरली आहे.
दृश्यमान रंगास अनुसरून केलेली अनुमापने : कित्येक विक्रिया अशा आहेत की, योग्य दर्शक वापरून अनुमापन केले तर मिळणारे अंतिम बिंदू हे त्यांच्या सममूल्य बिंदूशी मिळते किंवा जवळ जवळ मिळते असतात. अशा रासायनिक विक्रियांचे वर्गीकरण पुढे दिल्याप्रमाणे केले जाते : (१) अम्ल-क्षारक, (२) ऑक्सिडी-क्षपणी, (३) अवक्षेपण व (४) जटिल आयन निर्माण करणाऱ्या.
(१) अम्ल-क्षारक विक्रिया किंवा उदासीनीकरणाची विक्रिया: ज्याची संहती माहीत आहे, असा अम्लविद्राव अनुमापक म्हणून वापरून एखाद्या क्षारकाचे किंवा त्याच्या उलट म्हणजे एखाद्या ज्ञात संहतीच्या क्षारकाचा विद्राव अनुमापक म्हणून वापरून अज्ञात संहतीच्या अम्लाचे अनुमापन केले जाते. पूर्वी वर्णन केलेले हायड्रोक्लोरिक अम्ल विद्रावाचे सोडियम हायड्रॉक्साइडाने केलेले अनुमापन याच प्रकाराचे आहे. अनुमापनातील अम्ल किंवा क्षारक यांपैकी एक दुर्बल (ज्यात आयनीभवन अल्प असते) व दुसरे प्रबल (ज्यात अम्ल किंवा क्षारकाचे बव्हंशी आयनीभवन होते) असेल तर योग्य प्रकाराचा दर्शक निवडावा लागतो. उदा., सोडियम कार्बोनेटासारख्या दुर्बल क्षारकाचे प्रबल हायड्रोक्लोरिक अम्ल विद्रावाने अनुमापन करताना मिथिल ऑरेंज हा दर्शक सोईस्कर ठरतो.
(२) ऑक्सिडी-क्षपणी विक्रिया : ज्यांचे ऑक्सिडीकरण(संयुगाचा ऑक्सिजनाशी संयोग किंवा त्यातील हायड्रोजनाचा निरास किंवा अणूतील एका इलेक्ट्रॉनाचे विसर्जन होणे. क्षपणक्रिया याच्या उलट असते.) किंवा क्षपण सहज होऊ शकते असे कित्येक पदार्थ आहेत व त्यापैकी पुष्कळांची मात्रा अनुमापनाने ठरविता येते. या अनुमापनातील दर्शकांची क्रिया इतर रंग बदलणाऱ्या दर्शकांसारखीच असते. त्यांच्या ऑक्सिडीकृत अवस्थेतील रंग क्षपणित अवस्थेतील रंगाहून भिन्न असतो व अंतिम बिंदूच्या अगदी लगत येताच त्यांच्या रंगात ठळक असा बदल होतो. या प्रकारच्या अनुमापनात ऑक्सिडीकारक पदार्थ अनुमापक म्हणून वापरून क्षपणकारक पदार्थांची मात्रा, किंवा क्षपणकारक पदार्थ अनुमापक म्हणून वापरून ऑक्सिडीकारक पदार्थांची मात्रा ठरविली जाते. परंतु ऑक्सिडीकारक अनुमापकांचा उपयोग अधिक केला जातो. क्षपणकारक विद्राव हवेत राहिल्यामुळे कमीअधिक प्रमाणात ऑक्सिडीकृत होतात व त्यांची संहती बराच काल टिकून राहात नाही म्हणून ते एकंदरीत कमी वापरले जातात.
या पद्धतीत वापरल्या जाणाऱ्या ऑक्सिडीकारक पदार्थांपैकी एक महत्त्वाचा पदार्थ म्हणजे पोटॅशियम परमॅंगनेट होय. त्याच्या मानक विद्रावाचा उपयोग Fe++(फेरस), Sn++(स्टॅनस), ऑक्झालिक अम्ल व इतर कित्येक पदार्थाची मात्रा ठरविण्यासाठी केला जातो. त्याचप्रमाणे सोडियम थायोसल्फेट, स्टॅनस क्लोराइड, फेरस सल्फेट इ. क्षपणकारक विद्रावांचा उपयोग ऑक्सिडीकारक पदार्थांची मात्रा ठरविण्यासाठी होतो.
(३) अवक्षेपण विक्रिया : ह्या प्रकाराच्या अनुमापनांपैकी महत्त्वाची म्हणजे सिल्व्हर नायट्रेटाचा मानक विद्राव वापरून एखाद्या विद्रावातील क्लोराइडाची मात्रा ठरविण्याची पद्धती होय. या अनुमापनांत Ag++Cl–→AgCl अशी विक्रिया होऊन सिल्व्हर क्लोराइड (AgCl) अवक्षेपित (अविद्राव्य म्हणून तळाशी साका बसणे) होते. परंतु या विक्रियेतील अंतिम बिंदू कळणे कठीण असते. सममूल्य बिंदू जवळ आल्यावर सिल्व्हर क्लोराइडाचा तयार झालेला अवक्षेप तळाशी साचतो. त्यानंतर विश्लेष्यात अवक्षेप निर्माण होणे थांबेपर्यंत अनुमापकाच्या एकेक थेंबाची भर टाकली जाते व हा अवक्षेपण थांबण्याचा बिंदू अंतिम बिंदू समजतात. अंतिम बिंदू निश्चित करण्यासाठी सममूल्य बिंदू येण्याच्या सुमारास पोटॅशियम डायक्रोमेटाचा विद्राव दर्शक म्हणून वापरतात. शुभ्र सिल्व्हर क्लोराइडाचे अवक्षेपण पूर्ण झाल्यावर, ज्या वेळी सिल्व्हर क्रोमेटाचा नारंगी-लाल रंगाचा अवक्षेप तयार होतो, तोच अंतिम बिंदू होय. अवक्षेपणाच्या कित्येक विक्रिया वेगाने व तत्काल हेत नाहीत व विक्रियांचा अंतिम बिंदू ओळखणे कठीण असते. म्हणून अवक्षेपण विक्रियांवर आधारलेली अनुमापने विशेष प्रचारात नाहीत.
(४) जटिल आयन निर्मितीवर आधारलेली पद्धती : ‘एथिलीन डायअमाइन टेट्रा ॲसिटिक अम्ल’(EDTA) याचा शोध लागल्यावर त्याचा उपयोग करून कित्येक धातूंच्या आयनांचे अनुमापन करणे शक्य झालेले आहे. धातूंच्या आयनांबरोबर रंगीत जटिल (गुंतागुंतीचे, अनेक भिन्न अणूंपासून बनलेले) गट निर्माण करण्याचा गुणधर्म असलेले रंजक पदार्थ येथे दर्शक म्हणून वापरले जातात. ‘ईडीटीए’ ने अनुमापन करीत असताना प्रथम त्याची विक्रिया धातूच्या जटिल गट न झालेल्या आयनाशी होते व अंतिम बिंदू आल्यावर धातू व रंजक मिळून झालेल्या जटिल गटाशी होते. मुक्त रंजकाचा रंग व धातू आणि रंजक मिळून झालेल्या जटिल गटाचे रंग भिन्न असल्यामुळे रंग पालटण्यावरून अंतिम बिंदू निश्चित कळतो. या प्रकाराची अनुमापने नियंत्रित परिस्थितीत व काळजीपूर्वक करावी लागतात. त्यांचे एक वेगळे तंत्रच झालेले आहे. तिसाहून अधिक धातूंची मात्रा या पद्धतीने काढता येते व उद्योगधंद्यांत ही पद्धती वापरली जाते.
जलेतर विद्रावक : आतापर्यंतच्या वर्णनातील विश्लेष्य व अनुमापक यांचे विद्राव पाण्यात केलेले असतात, पण पाण्याशिवाय इतर माध्यमांचासुद्धा उपयोग अनुमापनासाठी होणे शक्य आहे. कार्बॉक्सिलिक अम्ले व कार्बनी क्षारक ही पाण्यात सामान्यतः अल्प किंवा अत्यल्प प्रमाणातच विरघळतात. म्हणून पाणी हे माध्यम वापरून त्यांचे अनुमापन समाधानकारक रीतीने करता येत नाही. त्यांच्यापैकी कित्येक इतकी दुर्बल असतात की, त्यांच्या विक्रियेचा अंतिम बिंदू मिळणे अशक्य असते. जलेतर विद्रावक वापरून अशा अम्ला-क्षारकांचे अनुमापन करण्याच्या पद्धतीचा प्रारंभ साधारणतः १९३० च्या पूर्वी झाला व १९५० सालानंतर अनेक नव्या पद्धतींचा शोध लागून त्यांचा बराच वापर होऊ लागला आहे. कित्येक अम्लीय किंवा क्षारकीय पदार्थ पाण्यात विरघळलेले असताना त्यांचे बल अगदी कमी असते परंतु ग्लेशियल (शुद्ध संहत स्वरूपातील)ॲसिटिक अम्ल, ॲसिटोनायट्राइल, क्लोरोफॉर्म, एथिल ॲसिटेट इत्यादींत ते विरघळलेले असताना त्यांची विक्रिया प्रबल होते.
क्षारकांचे अनुमापन करण्यासाठी ग्लेशियल ॲसिटिक अम्ल, डायोक्झेन, ॲसिटोनायट्राइल इत्यादींचा वापर मोठ्या प्रमाणात होतो. ग्लेशियल ॲसिटिक अम्लात परक्लोरिक अम्ल विरघळवून त्या विद्रावाचा उपयोग अतिदुर्बल अशा क्षारकीय पदार्थांची मात्रा काढण्यासाठी होतो. अमाइने व ॲमिनो अम्ले यांच्या अनुमापनासाठी ही जलेतर विद्रावक वापरले जातात. परंतु पाण्यातील विक्रियांविषयी व त्यांत वापरल्या जाणाऱ्या दर्शकांविषयी जितकी माहिती उपलब्ध झालेली आहे, तितकी जलेतरांविषयी उपलब्ध झालेली नाही.
विद्युत् मापनावर आधारलेल्या अनुमापन पद्धती : या पद्धतीत सामान्यतः विद्युत् मापनाने अंतिम बिंदू ठरविला जातो. विद्युत् मापनात विजेच्या पुढील मात्रांपैकी (परिमाणांपैकी) एखाद्या मात्रेचे मापन केले जाते : (१) एखाद्या विद्युत् घटाच्या दोन अग्रांमधील वर्चोभेद (विद्युत् स्थितींमधील फरक), (२) विद्युत् संवाहकता किंवा रोधकता, (३) अनुमापन घडून येत असताना वाहणार्या विसरण (एकमेकांत मिसळण्याची क्रिया) निर्मित प्रवाहाचे मापन, (४) अनुमापनाचा अंतिम बिंदू येईपर्यंत जी वीज खर्ची पडली तिच्या मात्रेचे मापन.
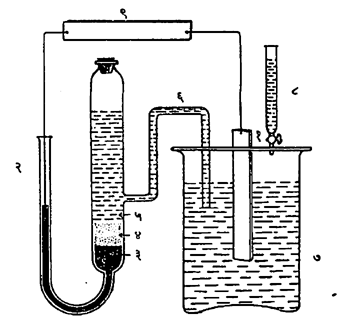
(१) वर्चोभेद-मापी अनुमापने : दोन अग्रांमधील वर्चोभेद मोजून अनुमापन करण्याच्या पद्धतीला वर्चोभेद-मापी अनुमापन म्हणतात. या प्रकारात ज्याचे अनुमापन करावयाचे तो विद्राव एका पात्रात ठेवलेला असतो व त्याच्यात एक विद्युत् अग्र बुडविलेले असते. त्याच्या शेजारी दुसऱ्या पात्रात संदर्भ म्हणून वापरावयाचे अग्र असते. ज्याचा वर्चस् सतत स्थिर राहील असे एखादे संदर्भ अग्र (उदा., कॅलोमेलाचे अग्र) वापरले जाते. दर्शकपात्र (ज्या पात्रात अनुमापन करावयाचा पदार्थ ठेवलेला असतो)व संदर्भपात्र (ज्या पात्रात संदर्भ अग्र ठेवलेले असते) यांच्यामध्ये विद्युत् संपर्क साधला जावा म्हणून ती एखाद्या लवणाच्या संतृप्त (ठराविक तपमानास जास्तीत जास्त विद्रुत असलेल्या) विद्रावाने, म्हणजे लवणसेतूने (आ. २ मध्ये दाखविल्याप्रमाणे) जोडली जातील अशी व्यवस्था असते.
ज्या पदार्थांचे अनुमापन करावयाचे त्याच्या संहतीत होणाऱ्या फेरफारांचा ज्याच्यावर परिणाम होईल, अशा पदार्थांचे दर्शक अग्र बनविलेले असते. उदा., पोटॅशियम क्लोराइडाच्या विद्रावाने सिल्व्हर नायट्रेटाचे अनुमापन करावयाचे असेल, तेव्हा दर्शक अग्र चांदीच्या तारेचे असते. या अनुमापनातील संदर्भ अग्र कॅलोमेलाचे असते व लवणसेतू इंग्रजी U या अक्षराच्या आकाराच्या नळीत आगर या पदार्थाची जेली व थोडे पोटॅशियम नायट्रेट घालून तयार केलेला असतो. या अनुमापनातील विद्युत् घट पुढे दिल्याप्रमाणे असतो :
(-)Hg, Hg2Cl2, KCl (संतृप्त) ॥KNO3॥ Ag+ (xM), Ag(+)
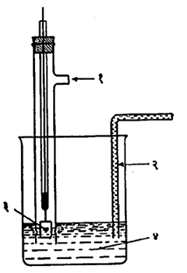
संदर्भ अग्र हे पारा व कॅलोमेल यांच्या मिश्रणाचे असून ज्ञात संहती असलेल्या पोटॅशियम क्लोराइडाच्या विद्रावाशी त्याचा संपर्क असते व त्याची घटना Hg, Hg2Cl2, KCl॥ अशी असते. आ.२ वरून त्याची रचना कळून येईल. अनुमापन चालू असताना चांदीच्या अग्राच्या विद्युत् चालक प्रेरणेचे (वि.चा. प्रे.चे विद्युत् प्रवाह वाहण्यास कारणीभूत असणाऱ्या प्रेरणेचे) मापन केले जाते. चांदीच्या अवक्षेपणाची क्रिया जवळजवळ पुरी होण्याच्या अवस्थेत चांदीच्या अग्राचे वर्चस् एकाएकी वाढते व त्या अवस्थेत अंतिम बिंदू आलेला असतो. अनुमापन चालू असताना भर पडत असलेल्या अनुमापकाचे व वि.चा. प्रे. यांचे अन्योन्य संबंध नोंदून तयार केलेल्या आलेखावरून अंतिम बिंदू कळतो.
जर एखाद्या अम्लाचे एखाद्या क्षारकांने अनुमापन करावयाचे असेल तर H+ आयनांच्या संहतीत होणाऱ्या फेरफारांचा ज्याच्यावर परिणाम होईल असे दर्शक अग्र वापरले जाते. दर्शक अग्रे अनेक प्रकारांची असतात. त्यांपैकी प्लॅटिनम (पहा : आ.३) वापरून केलेल्या एका विद्युत् घटाचे स्वरूप पुढे दिल्याप्रमाणे असते.
(-)Pt,H2(एक वातावरण), H+(xM)॥ KCl(संतृप्त), Hg2Cl2, Hg (+)
वर्चस् मापी पद्धती बरीच उपयुक्त आहे. योग्य असे विद्युत् अग्र उपलब्ध झाले, तर उदासिनीकरण, अवक्षेपण, ऑक्सिडीभवन-क्षपण किंवा जटिल गट निर्मिती इ. कोणत्याही प्रकारच्या विक्रिया असणाऱ्या अनुमापनात या पद्धतीचा उपयोग करता येतो.
०·१० सममूल्य Fe+2 च्या ०·१० सममूल्य Ce-4 शी अनुमापन केलेल्या अनुमापनातील फले नोंदून केलेल्या आ.४ मधील आलेखावरून अंतिम बिंदू कसा काढतात ते कळेल.

(२) विद्युत् संवाहकतेच्यामापनावर आधारलेली अनुमापने : अनुमापनाच्याविक्रियेत विश्लेष्य-विद्रावातील काही आयन काढून टाकले जात असतात व काहींची भर विद्रावात पडत असते. त्यामुळे विश्लेष्य-विद्रावाची संवाहकता बदलत असते. ज्या पात्रात अनुमापन करावयाचे असते त्याच्यातील विद्रावात विद्युत् अग्रांची एक जोडी म्हणजे सामान्यतः प्लॅटिनमाचे दोन पत्रे बुडविलेले असतात. अनुमापकाची भर घालीत असता वेळोवेळी त्या विद्रावाचा विद्युत् रोध मोजला जातो. रोधाच्या व्यस्त प्रमाणात संवाहकता असते. रोध मोजण्यासाठी व्हीट्स्टन-सेतू व प्रत्यावर्ती (उलटसुलट दिशेने वाहणारा) प्रवाह वापरले जातात (पहा : आ. ५). एकदिश प्रवाह वापरला, तर विद्युत् विच्छेदनामुळे (विजेच्या साहाय्याने रेणूचे विभाजन होणे), आयनांच्या क्षयामुळे व ध्रुवणामुळे (रेणूवरील धन व ऋण विद्युत् भार अलग होणे) अनिष्ट परिणाम होतात. त्यामुळे ओहम नियमाचा उपयोग करता येत नाही म्हणून प्रत्यावर्ती प्रवाह वापरतात.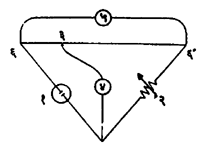
सिल्व्हर नायट्रेटाच्या विद्रावात पोटॅशियम क्लोराइडाचा विद्राव घालून व सिल्व्हर क्लोराइडाचे अवक्षेपण करून अनुमापन केले जात आहे, अशी या अनुमापनातील विक्रिया पुढील समीकरणाने दाखविता येईल :
Ag+ + NO3– + K + Cl– ® AgCl + K+ + NO3–
सिल्व्हर नायट्रेटाच्या विद्रावा पोटॅशियम क्लोराइडची भर घालित असताना सिल्व्हर क्लोराइडाचे अवक्षेपण होत राहून Ag+ आयन कमी होत असतात. पण त्याच्यापेक्षा अधिक वेगवान असे K+ आयन येत असतात, म्हणून प्रारंभी संवाहकता अल्प प्रमाणातच वाढत असते. सममूल्य बिंदू येईपर्यंत पोटॅशियम क्लोराइडाची भर पडत असताना संवाहकता तशाच रीतीने थोड्या प्रमाणातच वाढत असते. सममूल्य बिंदूनंतर पोटॅशियम क्लोराइडाची भर घातली असता, त्याच्यावरील कोणत्याही आयनांचे प्रतिष्ठापन होत नसल्यामुळे संवाहकता पूर्वीपेक्षा अधिक वेगाने वाढत जाते.
त्याचप्रमाणे हायड्रोक्लोरिक अम्लाच्या विरल विद्रावाचे पोटॅशियम हायड्रोक्साइडाच्या विद्रावाने अनुमापन करीत असताना त्याच्यातील विक्रिया पुढे दिल्याप्रमाणे असते :
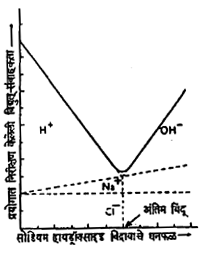
H+ + Cl– + K+ + OH‑→ H2O + K+ +Cl–
(विश्लेष्य) (अनुमापक)
या विक्रियेत अंतिम बिंदू येईपर्यंत H+ आयनाचे K+ आयनाने प्रतिष्ठापन होत असते. त्यामुळे अंतिम बिंदू येईपर्यंत संवाहकता विशेष प्रमाणात वाढत नाही, पण अंतिम बिंदू आल्यावर अनुमापकाची भर टाकीत असताना त्याच्यातील आयनांचे प्रतिष्ठापन होत नाही. K+ आयनांची व OH‑ आयनांची भर पडल्यामुळे विद्रावाची संवाहकता पुष्कळ प्रमाणात वाढते. अशा अनुमापनात अनुमापकातील पाण्याची भर पडल्यामुळे विश्लेष्य-विद्रावात पाण्याची भर पडून त्याची विरलता वाढत असते. पण विश्लेष्य- विद्रावाच्या मानाने ज्याची संहती बरीच आहे असा अनुमापक घेऊन विरलतेची वाढ विशेष होणार नाही असे करता येते.
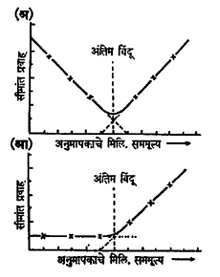
विद्युत् संवाहकतामापी अनुमापने ही विश्लेष्य- विद्रावाच्या संवाहकतेत होणाऱ्या बदलावर आधारलेली असतात. त्यांचा सममूल्य बिंदू सरळसरळ मिळत नाही. परंतु संवाहकता व भर घातलेल्या अनुमापकाचे घनफळ यांचे अन्योन्य संबंध दाखविणारे बिंदू आलेखात मांडून त्या आलेखावरून अंतिम बिंदू ठरविला जातो. (पहा : आ. ६ .) अशा आलेखात सामान्यतः एकमेकीस छेदणाऱ्या दोन रेषा मिळतात. त्या एकमेकीस छेदतात तो बिंदू अंतिम बिंदू असतो. परंतु कित्येकदा अंतिम बिंदूच्या लगतच्या भागातल्या फलांवरून मिळणाऱ्या रेषा किंचित वक्र असतात. अशा वेळी अंतिम बिंदूपासून काही अंतर सोडून उरलेल्या रेषा सरळ वाढवून जेथे एकमेकींस मिळतात तो अंतिम बिंदू म्हणून घेतला जातो.
(३) अँपिअरमापी अनुमापने : या प्रकाराच्या अनुमापनातील विद्रावाची आणि विजेची परिस्थिती संवाहकतामापी पद्धतीतील परिस्थितीहून अगदी भिन्न असते. संवाहकतामापनात प्रत्यावर्ती प्रवाह व प्लॅटिनमाची अग्रे वापरून ध्रुवण होणे टाळले जाते, उलट अँपिअरमापी अनुमापनात एकदिश विद्युत् प्रवाह व ज्याचे सहज ध्रुवण होईल असे, सामान्यतः ठिबकणाऱ्या पाऱ्याचे अग्र वापरले जाते.
ज्यात ऑक्सिडीभवनक्षम किंवा क्षपणक्षम विद्राव आहे अशा विद्युत् घटातील अग्रांमधून, स्थिर विद्युत् वर्चोभेद ठेवून, वीज जाईल असे केले म्हणजे त्या विद्युत् वर्चसाच्या प्रेरणेमुळे विद्युत् अग्राशी विक्रिया घडून येते व त्या विक्रियेमुळे दोन विद्युत् अग्रांमधून जाणारा विसरण-प्रवाह निर्माण होतो. तो प्रवाह विद्रावात जे विद्युत् क्रियाशील आयन असतात, त्यांच्या संहतीच्या सम प्रमाणात असतो. त्या विसरण-प्रवाहाचे मापन करून सममूल्य बिंदू ठरविले जातात.

मापनपद्धती : प्रवाहमापन करण्यासाठी लागणारे उपकरण स्थूलरूपाने आ. ७ मध्ये दाखविल्याप्रमाणे असते. आकृतीतील केशनलिकेला जोडलेल्या चंबूत पारा ठेवलेले असतो. केशनलिकेचे खालचे टोक विश्लेष्यात किंचित बुडवून ठेवलेले असते. चंबूतील पाऱ्याचा एकेक थेंब तीन ते सहा सेकंद अंतराने गळून अनुमापकात पडेल अशी व्यवस्था असते. पारा असलेला चंबू हा एक विद्युत् अग्र असतो. विश्लेष्य ठेवलेल्या चंबूच्या तळाशी पार्याचा जो थर असतो तो दुसरे विद्युत् अग्र होय. ही दोन्ही अग्रे विजेचा एकदिश प्रवाह पुरविणाऱ्या एखाद्या साधनाशी (सामान्यतः सुमारे तीन व्होल्ट विद्युत् दाबाच्या कोरड्या विद्युत् घटमालेशी ) आकृतीत दाखविल्याप्रमाणे परिवर्तनशील रोधकाच्या व विद्युत्मापकाच्या द्वारा जो़डलेली असतात. ठिबकणाऱ्या पाऱ्याला कोणतेही अग्र (धन किंवा ऋण) करता येते, पण सामान्यतः ते क्षपणकारक म्हणजे ऋणाग्र केले जाते.
वेळोवेळी अनुमापनात भर घातल्यावर प्रवाहाचे मापन केले जाते आणि प्रवाहाची मूल्ये व भर पडलेल्या अनुमापकाची घनफळे यांचा अन्योन्य संबंध दाखविणारे बिंदू नोंदून आलेख तयार केला जातो. या आलेखात दोन रेषा असतात आणि त्या ज्या ठिकाणी एकमेकीस मिळतात तो सामान्यतः सममूल्य बिंदू असतो.
विद्युत् वर्चोभेदाची निवड : ऑक्सिडीकरण व क्षपण यांपैकी जी विक्रिया घडवून आणावयाची असेल ती घडून येण्यास पुरेसा होईल इतकाच वर्चोभद ठेवावा लागतो. त्यापेक्षा अधिक ठेवला तर विद्युत् अग्राशी अनिष्ट विक्रिया घडून येण्याचा संभव असतो. आयनांच्या निरनिराळ्या जातींसाठी विशिष्ट परिमाणाचा वर्चोभेद वापरावा लागतो. तो प्रत्यक्ष प्रयोग करून किंवा प्रमाणभूत ग्रंथांतील माहितीवरून मिळविला जातो. या पद्धतीने अनुमापन करण्यासाठी १०-२ ते १०-६ ‘मोल’ (मूलद्रव्य किंवा संयुग यांच्या वजनाचे एक एकक, हे ग्रॅममधील रेणुभारा इतके असते) इतक्या संहतीचे विद्राव वापरावे लागतात. तसेच अनुमापकाची भर पडल्यामुळे विश्लेष्याचे जे विरलीभवन होते, ते लक्षात घेऊन मापनात दुरूस्ती करावी लागते.
समजा, CrO4-2 क्रोमेट असलेला अनुमापक वापरून विश्लेष्यातील शिशाचे Pb+2 अनुमापन केले जात आहे. ठिबकणाऱ्या पाऱ्याच्या अग्राशी शिशाच्या व क्रोमेटाच्या अशा दोन्ही आयनांचे क्षपण
होईल इतकाच, दोन अग्रांमधील वर्चोभेद ठेवलेला आहे. अनुमापकाची भर पडत असताना सममूल्य बिंदू येण्यापूर्वी लेड क्रोमेट अवक्षेपित होत राहून शिशाच्या आयनाची Pb+2 संहती कमी होत जाईल त्यामुळे विसरण-नियंत्रित प्रवाह कमी होत जाईल. सममूल्य बिंदूच्या नंतर भर पडत असलेल्या अतिरिक्त अनुमापकामुळे क्रोमेट आयनांची संहती वाढत जाऊन, प्रवाह त्या प्रमाणात वाढत जाईल व अनुमापनाचा आलेख आ. ८ मध्ये दाखविल्याप्रमाणे असेल.
परंतु केवळ क्रोमेटाच्या आयनांचे क्षपण होईल व शिशाच्या आयनांचे होणार नाही इतकाच विद्युत् वर्चोभेद पुरवला असला, तर सममूल्य बिंदू येई पर्यंत विद्युत् अग्राशी कोणतीच विक्रिया होत नसल्याने प्रवाह जवळ जवळ शून्य असेल. सममूल्य बिंदू आल्यानंतर म्हणजे सर्व शिशाचे आयन अवक्षेपित झाल्यानंतर, अनुमापकातील अतिरिक्त क्रोमेटआयनांमुळे प्रवाह निर्माण होऊ लागतो व तो आयनांच्या संहतीच्या प्रमाणात वाढत जातो. या अनुमापनाचा आलेख आ. ८ प्रमाणे असतो. सारांश, या प्रकारच्या अनुमापनांच्या आलेखातील रेखांचा आकार, वापरलेल्या विद्रावातील आयनांच्या जातींवर, म्हणजे त्यांच्या विद्युत् अग्रक्रियाशीलतेवर अवलंबून असतो. अनुमापनांच्या परिस्थितीचे कित्येक प्रकार असणे शक्य आहेत व अनुमापनाचे आलेखही त्या परिस्थितीस अनुसरून निरनिराळे असतात.
(४) कुलंबमापी अनुमापने : ज्याचा अनुमापक म्हणून उपयोग होतो, असा एखादा विक्रियाकारक पदार्थ विद्युत् विच्छेदनाने होण्याला जी वीज लागते, तिचे मापन करून या प्रकाराची अनुमापने केली जातात. किती अँपिअर किंवा किती मिलि-अँपिअर प्रवाह व किती सेकंद वेळ लागला हे अचूक मोजून, म्हणजे किती वीज लागली यावरून कुलंबांची संख्या (अँपिअर ×सेकंद) ठरविली जाते आणि फॅराडे नियमाचा उपयोग करून विद्युत् विच्छेदनाने निर्माण झालेल्या पदार्थाची मात्रा काढली जाते. फॅराडे यांचा नियम असा आहे : जर एखाद्या विद्रावातून ९६,५०० कुलंब वीज गेली म्हणजे प्रत्येक विद्युत् अग्राशी एक ग्रॅम सममूल्य रासायनिक विक्रिया होते.’
एखाद्या विद्रावात बुडविलेल्या विद्युत् अग्रामधून प्रवाह वाहात असेल, तर धनाग्रापाशी एका किंवा अधिक आयन जातींचे ऑक्सिडीभवन व ऋणाग्रापाशी इतर एखाद्या किंवा अधिक आयन जातींचे क्षपण होते. त्या दोन अग्रांपैकी एकाशी तयार झालेल्या पदार्थांचा उपयोग अनुमापक म्हणून करता येतो. उदा., विद्युत् विच्छेदनाने विद्रावातील आयोडाइड आयनांचे ऑक्सिडीकरण करून, प्लॅटिनमाच्या धनाग्रापाशी आयोडीन निर्माण करता येते व त्या आयोडीनाने थायोसल्फेटासारख्या पदार्थांचे अनुमापन करता येते. थायोसल्फेटाचा विद्राव असलेल्या पात्रातच पोटॅशियम आयोडाइडाचा विद्राव असल्यामुळे आयोडीन निर्माण करता येणे शक्य असते किंवा एखाद्या लहानशा नळीत ते निर्माण करून नंतर अनुमापन करावयाच्या पात्रात ओतले जाईल, अशी व्यवस्था केली जाते. अशा विद्युत् विच्छेदनातील ऋणाग्रापाशी तयार झालेला पदार्थ अनुमापनास महत्त्वाचा नसतो व त्यामुळे व्यत्यय येण्याचाही संभव असतो, म्हणून त्याच्यासाठी एखादी वेगळी कोठडी करून तिचा विद्युत् संपर्क राहील, पण रासायनिक संपर्क राहणार नाही, अशी व्यवस्था केलेली असते.
अशा अनुमापनांचा अंतिम बिंदू ठरविण्यासाठी रंग बदलणारा किंवा इतर एखादा दर्शक वापरला जातो व अंतिम बिंदू पोचेपर्यंत खर्ची पडलेल्या विजेच्या मात्रेवरून अनुमापकाची मात्रा हिशोबाने काढली जाते. सूक्ष्म प्रमाणात असलेल्या कित्येक धन आयनांचे अनुमापना करण्यासाठी ही पद्धती वापरण्यात येते.
कार्ल-फिशर पद्धती : निर्जल द्रव्यात अल्प प्रमाणात असलेल्या पाण्याची मात्रा शोधून काढण्यास ‘कार्ल-फिशरपद्धती’ उपयुक्त ठरलेली आहे. या पद्धतीत थोडे आयोडीन, सल्फर डाय ऑक्साइड व पिरिडीन यांचा निर्जल मिथेनॉलमध्ये विरघळवून केलेला विद्राव ‘कार्ल-फिशर विक्रियाकारक’ म्हणून वापरतात. पाणी असल्यास पुढे दिल्याप्रमाणे विक्रिया होते :
I2+SO2+H2O+3C5H5N →2C5H5N·HI+C5H5N·SO3
विक्रियेने तयार होणारे पदार्थ वर्णहीन असतात. ज्याच्यातील पाणी काढावयाचे, त्याच्या नमुन्याशी वर उल्लेख केलेला ‘कार्ल-फिशर विक्रियाकारक’ वापरून, आयोडीनाचा रंग दिसू लागेपर्यंत अनुमापकाची भर घातली जाते किंवा ⇨वर्चसमापकावरून अंतिम बिंदू ठरविला जातो.
वर वर्णन केलेल्या अनुमापनपद्धतींशिवाय इतर पद्धतीही क्वचित वापरल्या जातात. उदा., प्रकाशमापी, वर्णप्रकाशमापी. तसेच विद्रावांनी शोषून घेतलेल्या प्रारणांमध्ये होणाऱ्या फरकांवरून किंवा एखाद्या भौतिक गुणधर्मावरून, विद्रावांचे तपमान किंवा विद्युत् रोधांक (विद्युत् प्रवाह वाहण्यास होणारा विरोध दाखविणारा अंक) किंवा प्रणमनांक (प्रकाशकिरण एका माध्यमातून दुसऱ्या माध्यमात जाताना होणाऱ्या दिशाबदलाचे विशिष्ट गुणोत्तर) किंवा श्यानता (द्रव व वायू पदार्यांतील अंतर्गत घर्षण, चिकटपणा) किंवा ध्वनीचा वेग वा किरणोत्सर्ग (अणू फुटण्यामुळे कण किंवा किरण बाहेर पडण्याची क्रिया) इ. भौतिक गुणधर्मांत होणाऱ्या बदलांवरून अनुमापनाचा अंतिम बिंदू ठरविला जातो.
अनुमापनाची रेषा आपोआप नोंदली जाईल किंवा अंतिम बिंदू येताच अनुमापकाची भर पडणे आपोआप थांबविले जाईल, अशी उपकरणेही शोधून काढण्यात आलेली आहे.
पहा : अम्ले व क्षारक अवक्षेपण आयन दर्शके.
संदर्भ : 1. Ayres, G. H. Quantitative Chemical Analysis, New York & Tokyo, 1964.
2. Blaedel, W. J. Meloche, V. W. Elementary Quantitative Analysis-Theory and Practice, New York &Tokyo, 1964.
3. Hampel, C. A. The Encyclopaedia of Electrochemistry, London, 1964,
4. Walton, H. F. Principles and Methods of Chemical Analysis, New Delhi, 1966.
कारेकर, न. वि.
“