ग्राभण : (किलेशन). ज्या रासायनिक संयुगामध्ये धातूचा आयन (विद्युत् भारित अणू) दोन अथवा अधिक अधातवीय (धातू नसलेल्या) अणूंशी जोडला जाऊन विषमवलयी (कार्बन व इतरही अणू जिच्यामध्ये आहेत अशा साखळीची टोके एकमेकांस जोडून झालेली) संरचना (अणूंची रेणूतील मांडणी) बनलेली असते अशा संयुगाला ग्राभ संयुग किंवा ग्राभ असे म्हणतात. अशी संयुगे बनविण्याच्या क्रियेला ग्राभण म्हणतात. उदा., सूत्र १ मध्ये दाखविलेले संयुग. यामध्ये कॅडमियन (Cd) धातूचा आयन, एथिलीन डाय अमाइन (H2N–CH2·CH2–NH2) या संयुगातील दोन नायट्रोजन अणूंशी सहसंबद्ध बंधांनी (एका अणूने दुसऱ्या अणूस किंवा आयनास इलेक्ट्रॉनयुग्म दिल्यामुळे बनलेल्या रासायनिक बंधांनी) जोडला जाऊन एक पंचपदी (पाचांचे बनलेले) वलय झाले आहे. ग्राभ संयुगे हा जटिल संयुगांचा एक प्रकार आहे [→ रासायनिक संयुगे].
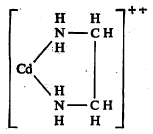
ग्राभ संयुगे सामान्य संयुगांपेक्षा जास्त स्थिर असतात. ग्राभातील धातूचा आयन ग्राभकारक संयुगाने (याला इंग्रजीत लिगँड म्हणतात मराठी शब्द बंधक) चिमट्यात एखादी वस्तू पकडावी त्याप्रमाणे जणू काय पकडला आहे आणि त्यामुळे स्थैर्य येते, या कल्पनेने ग्राभण ही संज्ञा दिली आहे. इंग्रजीत अशा संयुगाला किलेट म्हणतात. ही संज्ञा १९२o साली मॉर्गन व ड्रू या संशोधकांनी सुचविली. पक्षी आपल्या नख्यांनी भक्ष्य जसे पकडून ठेवतात तसाच धातु-आयन बंधक रेणूने धरून ठेवला आहे अशी कल्पना यात ध्वनित आहे.
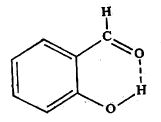
काही कार्बनी संयुगांच्या रेणूंतील दोन भाग (एकाच किंवा भिन्न रेणूंतील) हायड्रोजन बंधांनी एकमेकांस जोडले जाऊनही अशीच वलयी संरचना होते व त्यामुळे त्या रेणूच्या गुणधर्मांत फरक आढळतो. उदा., सॅलिसिल आल्डिहाइड.
फॉर्मिक अम्लाच्या दोन रेणूंमध्ये अशीच वलयी रचना होते व त्यामुळे त्याचे द्विवारिक (दोन सारखे रेणू एकमेकांस जोडले जाऊन बनलेले संयुग) बनते.
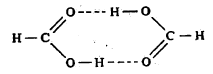
या कारणामुळे अशा संयुगाचा समावेशही विस्तृत अर्थाने ग्राभ संयुगांत केला जातो.
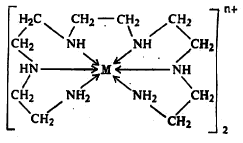
धातुग्राभ बनण्यासाठी धातूच्या आयनाला, इलेक्ट्रॉनयुग्म देऊन सहसंबद्ध बंधाने जोडले जातील असे किमान दोन अणू बंधकात असावे लागतात. अशा तऱ्हेने झालेला बंध बाणाच्या योगाने दाखविण्याचा प्रघात आहे. जो अणू इलेक्ट्रॉनयुग्म देतो त्यापासून बाण निघतो व ज्या आयनाला हे युग्म मिळते तेथे बाणाचे टोक असते. ज्या बंधकांत इलेक्ट्रॉनयुग्म दाते दोन अणू असतात त्यांना द्विदंती, ज्यांमध्ये चार असतात त्यांना चतुर्दंती आणि ज्यांमध्ये सहा असतात त्यांना षट्दंती बंधके म्हणतात. सूत्र ४ मध्ये दाखविलेले पेंटाएथिलीन हेक्झामीन हे बंधक षट्दंती असून ते M या धातू आयनाला सहा सहसंबद्ध बंधांनी जोडलेले आहे.
काही बंधकांमध्ये मुलतःच इलेक्ट्रॉनयुग्मे उपलब्ध असतात, उदा., एथिलीन डाय अमाइन हे बंधक, यातील नायट्रोजन अणूंजवळ इलेक्ट्रॉनयुग्मे आहेत किंवा रेणूंमध्ये असणाऱ्या हायड्रॉक्सी (OH) किंवा 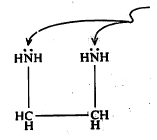
कार्बॉक्सी (COOH) गटातील H निघून गेल्यामुळे इलेक्ट्रानयुग्मे उपलब्ध होतात. सायट्रिक अम्लापासून असा बंधक मिळतो (सूत्र ६).
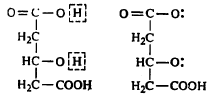
रक्तामध्ये असणारे हीमीन हे लोहाचे ग्राभ आहे (सूत्र ७). फुप्फुसातील ऑक्सिजनाची देवघेव करण्याचे महत्त्वाचे कार्य ते बजावते.

वनस्पतीमधील हरितद्रव्यात (क्लोरोफिलात) मॅग्नेशियमाचा आयन ग्राभ संयुगरूपात आहे.
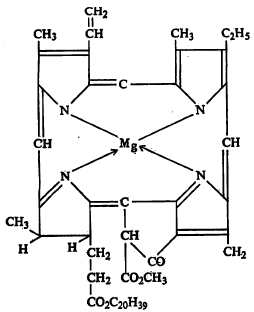
प्रकाश, उष्णता, अम्ले इत्यादींचा ज्यांवर अनिष्ट परिणाम होत नाही अशी थॅलोसायनीन नामक पिंजके (सूत्र ९) व ऑक्सिजनाशी देवघेव करू शकतील अशी ग्राभ संयुगे संश्लेषणाने (रासायनिक क्रियांनी) बनविण्यात आली आहेत.
नायट्रोजन, ऑक्सिजन व गंधक यांचे अणूच सामान्यतः सर्व धातुग्राभांत इलेक्ट्रॉनयुग्म दाते असतात. काही धातूंच्या आयनांची ऑक्सिजनाशी बंध निर्माण करण्याची प्रवृत्ती प्रबळ असते, तर काही धातूंचे आयन परिस्थितीनुरूप ऑक्सिजन, नायट्रोजन किंवा गंधक यांच्या अणूंशी सहसंबद्ध होतात.
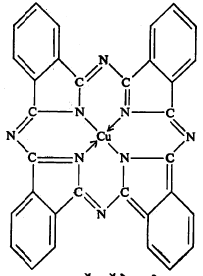
ग्राभांचे स्थैर्य धातू आयन व बंधके या दोन्हींवर अवलंबून असते. संक्रमणी धातू [आवर्त सारणीतील दोन आवर्तनांच्या सांध्यावर असणारे उदा., लोह, कोबाल्ट व निकेल → आवर्त सारणी संक्रमणी मूलद्रव्ये] व त्यानंतर लगेच येणाऱ्या धातू यांचे ग्राभ अत्यंत स्थिर असतात.
बंधकाच्या संरचनेत इलेक्ट्रॉनांना आपणाकडे ओढतील असे अणू अथवा गट असतील, तर ग्राभांची स्थिरता कमी होते. याच्या उलट इलेक्ट्रॉनांना दूर लोटतील असे अणू अथवा गट त्यात असतील, तर स्थैर्य वाढते.
ग्राभाच्या वलयी संरचनांमधील भेदांचाही त्यांच्या स्थैर्यावर परिणाम होतो. पंचपदी व षट्पदी वलये असलेले ग्राभ अत्यंत स्थिर आढळतात. उदा., कॉपर थॅलोसायनीन (सूत्र ९). चतुष्पदी, सप्तपदी आणि अष्टपदी वलये असलेले ग्राभ त्यामानाने कमी स्थिर असतात.
सामान्य जटिल संयुगांपेक्षा ग्राभ संयुगे जास्त स्थिर असण्याचे कारण ग्राभामध्ये धातूचा आयन बंधकाने निदान दोन ठिकाणी तरी धरलेला असतो. त्यामुळे एक बंध तुटला तरी दुसरा कायम राहतो. बहुदंती बंधकापासून झालेल्या ग्राभांची स्थिरता द्विदंती बंधकापासून बनलेल्या ग्राभापेक्षा जास्त असते, कारण बहुदंती बंधकाने धातूचा आयन अनेक ठिकाणी धरलेला असतो. सर्व बंध एकाच वेळी तुटू शकत नाहीत आणि एकदा तुटलेला बंध पुन्हा प्रस्थापित होण्याचीही शक्यता असते. एथिलीन डाय अमाइन टेट्रा ॲसिटिक अम्लाच्या योगाने बनलेला ग्राभ सुस्थिर का हे यावरून लक्षात येईल (सूत्र १o).
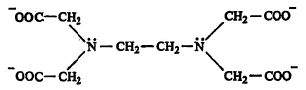
ग्राभांमध्ये सर्व तऱ्हेची ⇨समघटकता (तेच व तितकेच अणू रेणूमध्ये असूनही भिन्न गुणधर्मांचे पदार्थ बनणे) आढळते. ज्या ग्राभांची संरचना अशी असते की, जिची प्रतिबिंबरूप रचना मूळ रूपावर अध्यारोपित (समान अणू अथवा अणुगट एकमेकांवर बसतील अशा तऱ्हेने ठेवणे) करता येत नाही त्या ग्राभात प्रकाशीच (एकाच पातळीत कंपने होणाऱ्या म्हणजे ध्रुवित प्रकाशावर भिन्न परिणाम करणारी) समघटकता दिसून येते (सूत्र ११).
ग्राभणाचा उपयोग : रसायनशास्त्रात गुणात्मक (घटक कोणते आहेत ते ठरविण्याचे) आणि परिमाणात्मक (घटकांचे वजनी प्रमाण ठरविण्याचे) विश्लेषण करण्याकरिता ग्राभकारकांचा उपयोग अनेक ठिकाणी केला जातो. काही ग्राभकारक दर्शक (ज्यांच्या रंगामध्ये किंवा इतर एखाद्या गुणात दृश्य फरक पडल्यामुळे विक्रियेची परिस्थिती कळते असा पदार्थ) म्हणूनही उपयोगी पडतात. ८–हायड्रॉक्सि क्विनोलीन, डायमिथिल ग्लाय-ऑक्झाइम, क्यूप्फेरॉन, O–फिनांथ्रोलीन ही अशा ग्राभकारकांपैकी काही होत.
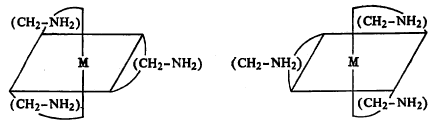
औद्योगिक क्षेत्रात अफेनद (ज्यामध्ये साबणाचा फेस नीटसा होत नाही असे) पाणी फेनद करण्यासाठी, बाष्पित्राच्या (बॉयलराच्या) आतील बाजूवर बसलेला खनिजांचा थर काढण्यासाठी तसेच विजेच्या साहाय्याने धातुविलेपन करताना लेप द्यावयाच्या धातूचे प्रमाण विद्रावात ठराविक रहावे यासाठी, रंग देण्याच्या प्रक्रियेत अनिष्ट धातू आयनांमुळे रंग बिघडू नये म्हणून व रबरी वस्तू बनविण्याच्या धंद्यात धातू आयनांमुळे उत्प्रेरण (एखाद्या पदार्थाच्या उपस्थितीने रासायनिक विक्रिया त्वरेने किंवा कमी तापमानास घडून येणे) होऊन अनिष्ट परिणाम होऊ नये याकरिता ग्राभकारक वापरणे श्रेयस्कर ठरते.
ज्या धातूंचे गुणधर्म बरेचसे समान आहेत त्यांचे विलगीकरण (एकमेकांपासून वेगळे काढणे) ही एक अवघड समस्या असते. उदा., झिर्कोनियम व हाफनियम. या ठिकाणी थिनॉइल ट्रायफ्ल्युओरो ॲसिटोन हे ग्राभकारक फार उपयोगी पडते.
विषारी धातूंचे शरीरात शिरलेले आयन (उदा., शिसे आणि प्लुटोनियम) काढून टाकण्यासाठी ग्राभकारकांचा उपयोग करता येतो.
संदर्भ : 1. Fergusson, L. N. Modern Structural Theory of Organic Chemistry, New Delhi, 1966.
2. Gilman, H. Organic Chemistry : An Advanced Treatise, Vol.II., New York, 1961
3. Walton, H. F. Principal Methods of Chemical Analysis, New Delhi, 1966.
ठकार, क. अ.
“