कार्बोहायड्रेटे : (सॅकॅराइडे). निसर्गात आढळणाऱ्या कार्बनी संयुगांचा एक वर्ग. या संयुगांच्या घटनेतील हायड्रोजन व ऑक्सिजन यांच्या अणूंचे परस्पर प्रमाण पाण्याच्या रेणूतील प्रमाणाइतके म्हणजे २ : १ हे असते. उदा., ग्लुकोज C6H12O6, सुक्रोज C12H22O11 इत्यादी. (D– ऑक्सिरिबोज, L– फ्यूकोज, L– ऱ्हॅन्मोज व युरॉनिक अम्ले हे अपवाद आहेत). यावरून ही संयुगे कार्बन अणूंचा पाण्याच्या रेणूंबरोबर संयोग होऊन बनली असावीत. [उदा., ग्लुकोज C6H12O6 म्हणजे C6(H2O) 6], अशी कल्पना रसायनशास्त्राच्या प्रारंभीच्या काळी होती व त्यावरूनच कार्बोहायड्रेट ही संज्ञा या वर्गाला देण्यात आली. ॲसिटिक व लॅक्टिक अम्लांत जरी ऑक्सिजन व हायड्रोजन यांचे प्रमाण २ : १ असले, तरी त्यांचा समावेश कार्बोहायड्रेटांत होत नाही. कार्बोहायड्रेटे ही पॉलिहायड्रॉक्सी (दोन वा अधिक हायड्रॉक्सिल म्हणजे OH गट असणारी) आल्डिहाइडे किंवा पॉलिहायड्रॉक्सी कीटोने असतात अथवा त्यांच्या जलीय विच्छेदनाने (पाण्याच्या विक्रियेने घटक द्रव्ये अलग करून) ही दोन्हीही मिळतात. निसर्गातील कार्बनी संयुगांत कार्बोहायड्रेटांचे प्रमाण सर्वांत जास्त आढळते. वनस्पती व प्राणी यांमध्ये ती विपुल प्रमाणात व विविध स्वरूपांत असतात. वनस्पतींच्या तंतूंत भरपूर असणारे सेल्युलोज, धान्य, मुळे व कंदमुळे यांतील स्टार्च आणि फुलांतील मध, फळे व पुष्कळशा वनस्पतींच्या रसात असणारी सुक्रोज ही कार्बोहायड्रेटांची उदाहरणे होत. बियांच्या टरफलात, मक्याच्या कणसात, तसेच डिंकात पेंटोज सॅकॅराइडे असतात. ग्लुकोसाइडे आणि ग्लुकोज व फ्रुक्टोज ही संयुगे कमीअधिक प्रमाणात सर्व वनस्पतींत आढळतात. प्राण्यांच्या कोशिकांत (पेशींत), कोशिका द्रवात, रक्तात व दुधात शर्करा आणि इतर कार्बोहायड्रेटे असतात. अन्नातील स्टार्चाचे व शर्करांचे रूपांतर शेवटी ग्लुकोजामध्ये होते. शरीरातील कोशिका मुख्यत: ग्लुकोजाचाच वापर करतात.
प्रकाशीय ऊर्जेचा उपयोग करून वनस्पती कार्बोहायड्रेटांची निर्मिती करतात. कार्बोहायड्रेटे हा मानवाच्या आहारातील महत्त्वाचा भाग आहे. मानवाला सर्वांत अधिक उष्णतेचा पुरवठा अन्नातील कार्बोहायड्रेटांपासून होतो. कोशिकांमध्ये होणाऱ्या रासायनिक विक्रियांसाठी लागणारी शक्ती कार्बोहायड्रेटांपासून उपलब्ध होते. कोशिकाभित्ती व आवरणे त्याचप्रमाणे जटिल ग्लायकोलिपिडे व ग्लायकोप्रथिने यांत कार्बोहायड्रेट हा घटक असतो. स्ट्रेप्टोमायसीन हे प्रतिजैव (अँटिबायॉटिक) द्रव्यदेखील कार्बोहायड्रेटांतील ट्रायसॅकॅराइड वर्गातील आहे.
वर्गीकरण : कार्बोहायड्रेटांचे वर्गीकरण मोनोसॅकॅराइडे, ऑलिगोसॅकॅराइडे व पॉलिसॅकॅराइडे या तीन वर्गांत करतात.
मोनोसॅकॅराइडामध्ये तीन ते आठपर्यंत कार्बन अणू असतात आणि त्यामध्ये एक आल्डिहाइड वा कीटोन गट असतो. ऑलिगोसॅकॅराइडे ही दोन ते आठ मोनोसॅकॅराइडांची बनलेली असून ती ग्लायकोसिडिक बंधांनी जोडलेली असतात. ज्यांमध्ये आठांहून जास्त मोनोसॅकॅराइडेच असतात त्यांना पॉलिसॅकॅराइडे म्हणतात. पॉलिसॅकॅराइडांचे दोन वर्ग करतात. (१) ज्यांच्या जलीय विच्छेदनाने एकच प्रकारचे मोनॉसॅकॅराइड मिळते यांचा वर्ग त्यांना सम-पॉलिसॅकॅराइडे (होमोपॉलिसॅकॅराइडे) म्हणतात व (२) ज्यांच्यापासून भिन्न प्रकारची मोनोसॅकॅराइडे प्राप्त होतात त्यांचा वर्ग त्यांना विषम-पॉलिसॅकॅराइडे (हेटेरोपॉलिसॅकॅराइडे) म्हणतात. यांशिवाय अनुजात कार्बोहायड्रेटे (कार्बोहायड्रेटांपासून तयार झालेली इतर संयुगे) असाही आणखी एक वर्ग आहे. त्यात कार्बोहायड्रेटांच्या (अ) ऑक्सिडीकरणामुळे [→ ऑक्सिडीभवन] प्राप्त झालेले पदार्थ : उदा., ॲस्कॉर्बिक अम्ल, युरोनिक अम्ले, अल्डोनिक व सॅकरिक अम्ले (आ) क्षपणक्रियेमुळे [→ क्षपण] तयार झालेले : उदा., ग्लिसरॉल, रिबिटॉल, इनॉसिटॉल (इ) ॲमिनोशर्करा : ह्यात ग्लुकोसामीन, गॅलॅक्टोसामीन व मॅनोसामीन आणि (ई) डी-ऑक्सिशर्करा : 2 डी- ऑक्सिरिबोज व मिथिलपेंटोजे यांचा समावेश होतो.
पॉलिसॅकॅराइडांचे रेणू फार मोठे असून काहींचा रेणुभार दहा लाखांपेक्षाही जास्त असतो. स्टार्च, सेल्युलोज आणि ग्लायकोजेन ही पॉलिसॅकॅराइडे होत.
मोनोसॅकॅराइडे : ज्या शर्करांच्या जलीय विच्छेदनामुळे दुसरी साधी शर्करा मिळत नाही, त्यांना मोनोसॅकॅराइडे म्हणतात. यांच्या रेणूत असणाऱ्या कार्बन अणूंच्या संख्येवरून व संरचनेत असलेल्या आल्डिहाइड किंवा कीटोन गटावरून त्यांना नावे दिली जातात. आल्डिहाइड गट असणाऱ्यांना आल्डोजे, तर कीटोन गट असणाऱ्यांना कीटोजे म्हणतात. उदा., ग्लुकोजामध्ये सहा कार्बन अणू आहेत व एक आल्डिहाइड गट आहे, म्हणून ग्लुकोजाला आल्डोहेक्झोज असे म्हणतात. ग्लिसराल्डिहाइड व डायहायड्रॉक्सिॲसिटोन ही अनुक्रमे आल्डोज व कीटोज यांची अत्यंत साधी उदाहरणे होत. कोष्टक क्र. १ वरून यांच्यातील फरक लक्षात येईल. मोनॉसॅकॅराइडे घन असून त्यांचे स्फटिक रेखीव असतात. ती वर्णहीन, चवीस गोड व पाण्यात विद्राव्य (विरघळणारी) आहेत. ती कॉपर सल्फेटाच्या क्षारीय (अम्लाशी विक्रिया होऊन लवणे देणाऱ्या पदार्थातील म्हणजे अल्कलीतील) विद्रावाचे क्षपण करतात. फिनिल हायड्राझीन, हायड्रोजन सायनाइड व हायड्रॉक्सिल अमाइन यांच्याबरोबर यांच्या विशिष्ट क्रिया होतात.
कोष्टक क्र. 1 आल्डोजे व कीटोजे यांची उदाहरणे
| आल्डोजे | कीटोजे | |
| ट्रायोजे (C3H6O3)
टेट्रोजे (C4H8O4) पेंटोजे (C5H10O5)
हेक्झोजे (C6H12O6) हेप्टोजे (C7H14O7) |
ग्लिसराल्डिहाइड
एरिथ्रोज, थ्रिओज झायलोज, रिबोज, अरॅबिनोज, लिक्सोज ग्लुकोज, मॅनोज, गॅलॅक्टोज – |
डायहायड्रॉक्सिॲसिटोन
एरिथ्रुलोज झायलुलोज, रिबुलोज
फ्रुक्टोज, सिकोज, सॉर्बोज सिडोहेप्टुलोज |
D आणि L वर्ग : कार्बोहायड्रेटांच्या संरचना ज्या संयुगाच्या संरचनेवरून बनविता येतील असे सर्वांत सरल संयुग म्हणजे ग्लिसराल्डिहाइड होय. ह्याच्या रेणूत एक असममित (ज्याला चार भिन्न अणू अथवा अणुगट जोडलेले आहेत असा) कार्बन अणू असतो. कार्बनाचे चार संयुजा बंध (इतर अणूंशी वा अणुगटांशी संयोग होणारे बंध) सुसम चतुष्फलकाच्या कोनांच्या दिशेने कार्यान्वित असतात. त्यामुळे ग्लिसराल्डिहाइडाचे बिंब आणि प्रतिबिंब असे दोन विन्यास (मांडण्या) होतात. ते D व L ह्या इंग्रजी अक्षरांनी दाखविले जातात. यांपैकी कोणत्या विन्यासास D व कोणत्यास L म्हणावे हे ठरविण्याचा संकेत शेजारच्या आकृतीत दाखविला आहे.
ग्लिसराल्डिहाइडाचा रेणू अशा तऱ्हेने आपल्यासमोर धरावा की, त्यातील असममित कार्बन अणूला जोडलेला CHO हा गट वर व CH2OH हा गट खाली आणि त्यांना जोडणारे संयुजा बंध आपणापासून दूर जाणारे होतील, अशा स्थितीत H व OH यांना जोडणारे बंध आपणाकडे येणारे असे होतील. ज्या विन्यासात OH गट आपल्या उजव्या हाताच्या बाजूला येईल तो विन्यास D होय व ज्यात डाव्या हाताच्या बाजूस येईल तो विन्यास L समजावा. शर्करेत असममित कार्बन अणूंची संख्या जसजशी वाढत जाते तसतशी त्या शर्करेच्या समघटकांची (रेणूतील घटक अणू सारखेच असलेल्या पण त्यांची मांडणी भिन्न असल्यामुळे वेगळे गुणधर्म असलेल्या प्रकारांची) संख्याही वाढते. शर्करेच्या ज्या समघटकांत आल्डिहाइड वा कीटोन गटापासून सर्वांत दूर असलेल्या असममित कार्बन अणूचा विन्यास D – ग्लिसराल्डिहाइडाप्रमाणे आहे, त्यांनी D – विन्यासी असे म्हणतात L – ग्लिसराल्डिहाइडाप्रमाणे असेल, तर L – विन्यासी होय. शरीरपोषणाच्या दृष्टीने महत्त्वाच्या असलेल्या सर्व शर्करा D वर्गाच्या आहेत. मानवी शरीरास L प्रकारच्या शर्करा उपयोगी नसतात. मानवी शरीर D – ग्लुकोजाचे सात्मीकरण (शरीरात शोषले जाईल असे रूपांतरण) करते, परंतु L – ग्लुकोजाचा चयापचयात (शरीरात सतत होणाऱ्या रासायनिक-भौतिक बदलांत) उपयोग होत नाही.
प्रकाशीय समघटकता : ज्या कार्बोहायड्रेटांत एक वा अधिक असममित कार्बन अणू असतात, ते प्रकाशीय सक्रियता (विशिष्ट प्रतलात कंप पावणारा प्रकाश
 म्हणजे ध्रुवित प्रकाश पदार्थातून गेल्यास त्या प्रकाशाचे कंपन प्रतल डावीकडे किंवा उजवीकडे वळविण्याचा त्या पदार्थाचा गुणधर्म) दाखवितात काही D व L प्रकारची कार्बोहायड्रेटे सामान्यत: अनुक्रमे दक्षिणवलनी (+) म्हणजे ध्रुवित प्रकाशाचे कंपन प्रतल उजवीकडे वळविणारी आणि वामवलनी (–) म्हणजे कंपन प्रतल डावीकडे वळविणारी असतात. तथापि काही D प्रकारच्या कार्बोहायड्रेटांचे प्रकाशीय वलन वाम (–) व L प्रकारच्या कार्बोहायड्रेटांचे दक्षिण (+) असते. म्हणून D व L या उपपदांना प्रकाशीय वलनाच्या दृष्टीने काहीच अर्थ नाही. उदा., D – व L – ग्लुकोजांचे प्रकाशीय वलन अनुक्रमे (+) व (–) असे असते, पण D – व L – फ्रुक्टोज शर्करांचे प्रकाशीय वलन अनुक्रमे (–) व (+) असे असते. म्हणून D – फ्रुक्टोजला लेव्ह्युलोज (वामवर्तनी) म्हणतात. वलनाची दिशा दाखविण्यासाठी + अथवा – हे चिन्ह विन्यासदर्शक D व अथवा L या अक्षरानंतर कंसात देण्याचा प्रघात आहे. उदा., D(–) फ्रुक्टोज या संज्ञेचा अर्थ D विन्यास असलेला व वामवलनी फ्रुक्टोज प्रकार.
म्हणजे ध्रुवित प्रकाश पदार्थातून गेल्यास त्या प्रकाशाचे कंपन प्रतल डावीकडे किंवा उजवीकडे वळविण्याचा त्या पदार्थाचा गुणधर्म) दाखवितात काही D व L प्रकारची कार्बोहायड्रेटे सामान्यत: अनुक्रमे दक्षिणवलनी (+) म्हणजे ध्रुवित प्रकाशाचे कंपन प्रतल उजवीकडे वळविणारी आणि वामवलनी (–) म्हणजे कंपन प्रतल डावीकडे वळविणारी असतात. तथापि काही D प्रकारच्या कार्बोहायड्रेटांचे प्रकाशीय वलन वाम (–) व L प्रकारच्या कार्बोहायड्रेटांचे दक्षिण (+) असते. म्हणून D व L या उपपदांना प्रकाशीय वलनाच्या दृष्टीने काहीच अर्थ नाही. उदा., D – व L – ग्लुकोजांचे प्रकाशीय वलन अनुक्रमे (+) व (–) असे असते, पण D – व L – फ्रुक्टोज शर्करांचे प्रकाशीय वलन अनुक्रमे (–) व (+) असे असते. म्हणून D – फ्रुक्टोजला लेव्ह्युलोज (वामवर्तनी) म्हणतात. वलनाची दिशा दाखविण्यासाठी + अथवा – हे चिन्ह विन्यासदर्शक D व अथवा L या अक्षरानंतर कंसात देण्याचा प्रघात आहे. उदा., D(–) फ्रुक्टोज या संज्ञेचा अर्थ D विन्यास असलेला व वामवलनी फ्रुक्टोज प्रकार.
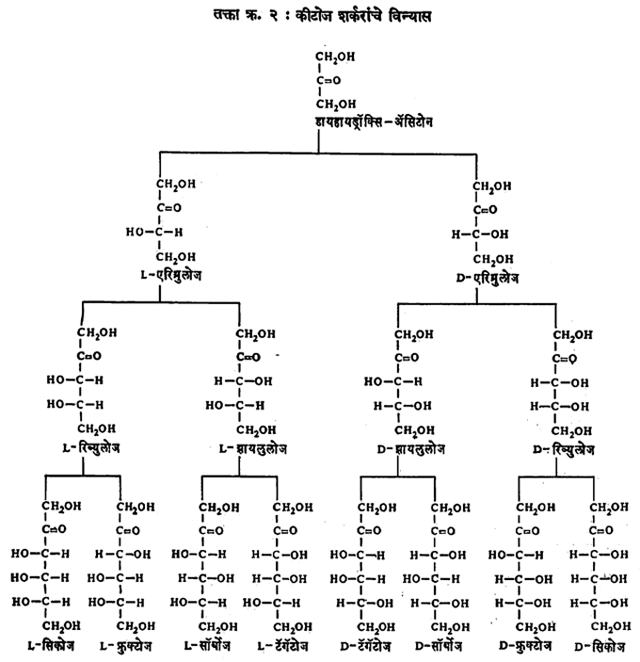
D – ग्लिसराल्डिहाइडामध्ये जर एक CHOH गट व CHO व CHOH यांच्यामध्ये समाविष्ट केला, तर त्यापासून चार कार्बन असलेल्या दोन शर्करा मिळतात. त्यांमध्ये दोन असममित कार्बन अणू असतात. आल्डोज शर्करांचे विन्यास तक्ता क्र. १ मध्ये दिले आहेत. त्यात हे असममित कार्बन अणू * या चिन्हाने दाखविले आहेत. ह्यामध्ये जर आणखी एक CHOH वरीलप्रमाणे मिळविला तर तक्त्यात दर्शविल्याप्रमाणे आल्डोज शर्करा (D – लिक्सोज, D – झायलोज, D – अरॅबिनोज व D – रिबोज या) मिळतात. याचप्रमाणे L – ग्लिसराल्डिहाइडामध्ये एकामागून एक CHOH मिळविल्यास L प्रकारच्या आल्डोज शर्करा मिळतात. तसेच डायहायड्रॉक्सिॲसिटोनापासून सुरुवात केल्यास व CO व CH2OH यांच्यामध्ये एकामागून एक CHOH गट क्रमाक्रमाने समाविष्ट केल्यास D व L प्रकारच्या कीटोज शर्करा मिळतात (येथे D व L विन्यास ठरविण्यासाठी CH2OH – CHOH – CO – CH2OH हे संयुग घेऊन ते CO – CH2OH गट वर होईल अशा तऱ्हेने ग्लिसराल्डिहाइडाच्या रेणुप्रमाणेच समोर धरावे. ज्या संरचनेत CHOH गटाचा OH उजव्या बाजूस येईल ती D संरचना होय).

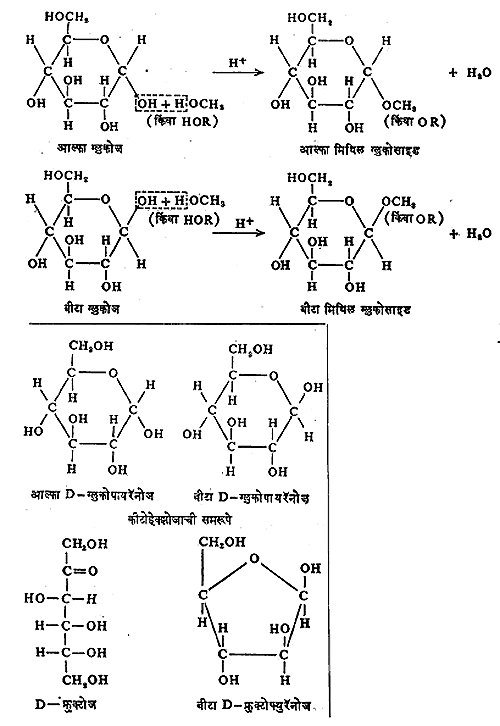
वलयी संरचना व चलसमघटकता : तक्ता क्र. १ व २ मध्ये दाखविल्याप्रमाणे शर्करांची संरचना विवृत (टोके मोकळी असलेल्या) शृंखलारूपाने लिहिण्यास एमिल फिशर या शास्त्रज्ञांनी सुरुवात केली. परंतु त्यांत दाखविल्याप्रमाणे या संयुगांत आल्डिहाइड गट असून देखील त्या संपूर्णपणे आल्डिहाइडासारख्या वागत नाहीत असे दिसून आले. आल्डिहाइडाचे अभिज्ञान देणाऱ्या (अस्तित्व ओळखणाऱ्या) शिफ परीक्षेस त्या उतरत नाहीत. ॲसिटल बनविण्याच्या विक्रिया केल्यावर एकच संयुग मिळण्याऐवजी दोन समघटक प्राप्त होतात आणि शर्करा पाण्यात विरघळवून विद्रावाचे प्रकाशीय वलन ताबडतोब व कालांतराने मोजले, तर वलनाच्या मूल्यात फरक होतो असे दिसून आले. घटनांचे विवरण कसे करावे हा त्या काली एक मोठा प्रश्न होता. रेण्वाभ्यांतरीय (रेणूमध्येच) हेमिॲसिटल तयार झाल्यामुळे विवृत शृंखलेऐवजी शर्करांची संरचना वलयी स्वरूपाची असते, या स्पष्टीकरणाने वरील विसंगती दूर झाली. वर दाखविल्याप्रमाणे, अल्कोहॉलाच्या OH गटाचा आल्डिहाइडातील द्विबंधी कार्बोनिल गटाशी संयोग झाल्याने हेमिॲसिटल तयार होते. जर एकाच रेणूत OH आणि C = O हे दोन्ही गट असतील, तर आंतररेणवीय प्रक्रिया होऊन पृष्ठ ७५६ वरील तक्ता क्र. ३ मध्ये दाखविल्याप्रमाणे हेमिॲसिटल वलयी होते.
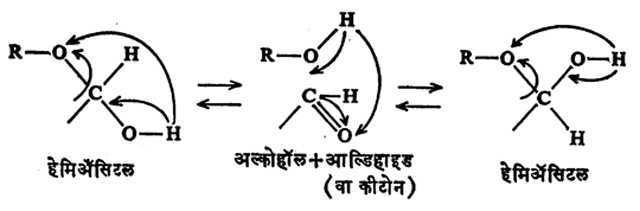
एकदा वलयाच्या एका बाजूला, तर दुसऱ्या वेळेस दुसऱ्या बाजूला हेमिॲसिटलास OH गट असल्यास प्रकाशीय वलनात फरक दाखविणारी ग्लुकोजाची दोन रूपे संभवतात.
ग्लुकोजाच्या विद्रावाच्या प्रकाशीय वलनात कालांतराने होणाऱ्या फरकामुळे वलयी संरचनेस दुजोरा मिळाला. जर ग्लुकोजाच्या स्फटिकांच्या पाण्यात विद्राव केला व ताबडतोब त्याचे प्रकाशीय वलन मोजले, तर ते [α]D२०० + ११३⋅४० असते (ह्या ठिकाणी D हे अक्षर सोडियमाच्या बाष्पापासून निघणाऱ्या प्रकाशातील D रेषेला उद्देशून आहे आणि वलन २०० से. तापमानाला मोजलेले आहे). पण ते हळूहळू कमी होत जाऊन + ५२⋅५० ला स्थिरावते. परंतु अशा रीतीने पुष्कळ वेळ राहिलेल्या ह्या विद्रावाचे स्फटिकीकरण केले असता पूर्ववत D- ग्लुकोज मिळतो.
जर ग्लुकोजच्या विद्रावाचे ९८० से. तापमानापेक्षा जास्त तापमानास बाष्पीभवन केले, तर ग्लुकोजाचा आणखी एक प्रकार मिळतो.
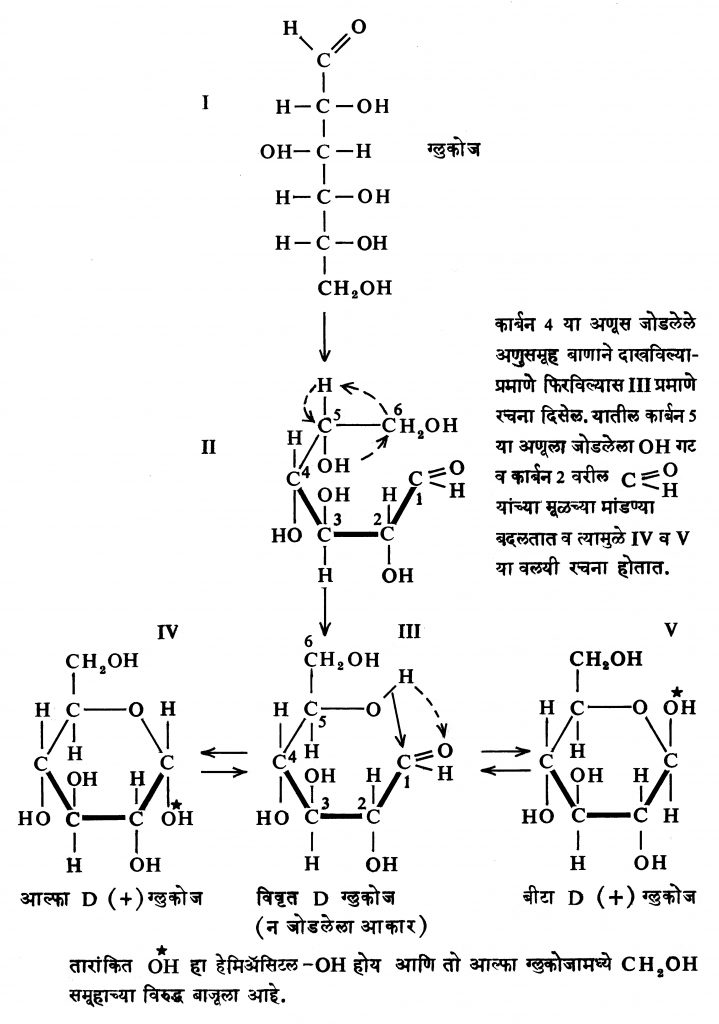
ह्याच्या ताज्या विद्रावाचे प्रकाशीय वलन +१९० इतके असते. परंतु हाही विद्राव बराच वेळ ठेवल्यास प्रकाशीय वलनात बदल होत जाऊन अखेर ते +५२⋅५० ला स्थिरावते. ह्या दीर्घकालीन विद्रावातून सुद्धा स्फटिकीकरणानंतर +११३⋅४० प्रकाशीय वलन असलेला ग्लुकोज मिळतो. ग्लुकोजच्या ह्या फरकाचे स्पष्टीकरण करण्याकरिता पृष्ठ ७५७ वरील तक्ता क्र. ४ मधील समीकरणे अपुरी पडतात.
ग्लुकोज हे हेमिॲसिटल आहे म्हणून ते अप्रकट आल्डिहाइड आहे. समतोल अवस्थेत ग्लुकोजाच्या विद्रावात विवृत शृंखला असलेले आल्डिहाइडरूप फक्त ०⋅०२ टक्के इतके असते. तरीसुद्धा हे आल्डिहाइड बेनिडिक्टासारख्या ऑक्सिडीकारकाबरोबर [ऑक्सिडीकरण करण्यास मदत करणाऱ्या पदार्थाबरोबर, → ऑक्सिडीभवन] विक्रिया करते. हा आल्डिहाइडाचा भाग कामी आल्याबरोबर हेमिॲसिटल बंध सुटा होऊन पुन्हा आल्डिहाइडाच्या रूपाचे ग्लुकोज पुरविले जाते.
मोनोसॅकॅराइडे ज्या वेळेस द्रव स्थितीत असतात, त्या वेळेस त्या विवृत शृंखलेचे कार्बोनिल प्रकार व निरनिराळ्या हेमिॲसिटलाचे प्रकार यांचे मिश्रण असते. ह्यामुळे कार्बोनिल गटाला साजेशा सर्व प्रक्रिया ही संयुगे दाखवितात. उदा., अमोनियायुक्त सिल्व्हर नायट्रेटाचे क्षपण (फेलिंग विद्राव, टॉलेनकारक). ग्लुकोजाचे आणखी एक वैशिष्ट्य आहे. ग्लुकोजाच्या आल्डिहाइड गटाचे ॲसिटल समूहात रूपांतर होण्याकरिता फक्त एकच अल्कोहॉलाचा रेणू लागतो, दोन लागत नाहीत (तक्ता क्र.४).
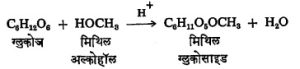
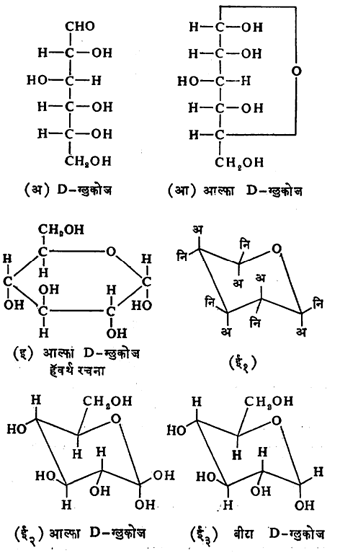
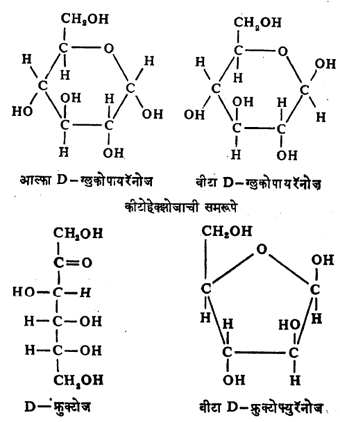
हे मिथिल ग्लुकोसाइड मात्र आता हेमिॲसिटलासारखे गुणधर्म न दाखविता ॲसिटलासारखे गुणधर्म दाखविते. ज्याप्रमाणे ग्लुकोज आल्फा व बीटा ह्या दोन स्वरूपांत तयार करता येते तद्वत मिथिल ग्लुकोसाइडाची आल्फा व बीटा ही दोन रूपे मिळतात. ह्या आल्फा व बीटा प्रकारच्या शर्करा त्रिमितीय समघटक (रेणूतील घटक तेच पण त्यातील अणूंची वा अणुगटांची अवकाशातील सापेक्ष स्थिती भिन्न असणारे प्रकार) आहेत, परंतु बिंब –प्रतिबिंब अशा नाहीत. त्यांना ॲनॉमर असे म्हणतात. यामध्ये शेवटच्या असममित कार्बन अणूला जोडलेल्या अणूंच्या वा गटांच्या स्थानात फक्त फरक असतो. शर्करांत आंतरहेमिॲसिटल बनविण्याची प्रवृत्ती असल्यामुळे त्या फ्युरॅनोज व पायरॅनोज हे दोन प्रकार तयार करतात. ह्या वलयीभवनामुळे आणखी एक असममित केंद्र तयार होऊन दोन समघटक तयार होतात. त्यांना शर्करेचे आल्फा व बीटा ॲनॉमर म्हणतात.
जे असममित केंद्र D वा L संज्ञा ठरविते, अशा शेवटच्या असममित केंद्राप्रमाणे शर्करेची संरचना असेल तर त्याला आल्फा ॲनॉमर म्हणतात व तशी नसेल तर बीटा ॲनॉमर म्हणतात. फ्युरॅनोज व पायरॅनोज हे शर्करांचे प्रकार पंचकोन व षट्कोनाने दाखवितात. कार्बन अणू क्र. ४ बरोबर संयोग होऊन झालेल्या वलयाकृती रचनेस फ्युरॅनोज व कार्बन अणू क्र. ५ बरोबर झालेल्या वलयाकृतीस पायरॅनोज म्हणतात. ह्यामुळे कार्बन अणू क्र. १ हा असममित होतो आणि आल्फा व बीटा प्रकारची समरूपे तयार होतात. (तक्ता क्र. ४ खालील ग्लुकोपायरॅनोजांची सूत्रे पहावीत). कीटोहेक्झोजाचीही समरूपे होतात (उदाहरणे पुढील पृष्ठावर दिली आहेत). परंतु ग्लुकोजाच्या रेणूंचा विन्यास अशा प्रकारच्या हॅवर्थ यांच्या पद्धतीने (इ) यथायोग्य दाखविला जात नाही. कारण वलयाचे कार्बन अणू एकाच प्रतलात नसतात. तसेच त्यातील हायड्रॉक्सिल गटही
प्रतलाच्या बरोबर वर वा खाली नसतात. (ई) या रचनेत ग्लुकोजाच्या रेणूचे जास्तीत जास्त बरोबर दर्शन होते. रचनेतील अणूंची व अणुसमुच्चयांची त्रिमितीय स्थाने यांची कल्पना आकृती (ई) वरून येईल.
कार्बन व ऑक्सिजन अणूंचे संयुजा बंध विवक्षित दिशेने कार्यान्वित असल्यामुळे ५ कार्बन व १ ऑक्सिजन अणू बंधावर ताण पडणार नाही अशा तऱ्हेने जोडून वलय बनविले, तर त्याचा आकार स्थूलमानाने एखाद्या खुर्चीसारखा होतो म्हणून या तऱ्हेला रूपाला खुर्चीरूप असेही म्हणतात. वलयाचे हे रूपच जास्त स्थिर आहे. या रूपामध्ये वलय बनविण्यासाठी वापरलेल्या बंधाखेरीज जे बंध आहेत त्यांचे दोन प्रकार होतात. एका प्रकारचे बंध उभे असून ते वलयापासून वर अथवा खाली जाणारे आहेत (आकृतीतील अ बंध) यांना अक्षीय बंध म्हणतात. दुसऱ्या प्रकारचे बंध (आकृतीतील नि बंध) सरळ खाली किंवा वर जाणारे नसून तिरपे आहेत. आल्फा D– ग्लुकोज व बीटा D– ग्लुकोज यांच्या रचनातील भेद अशा आकृतींनी चांगला स्पष्ट होतो.
पेंटोज : पुष्कळशा आल्डो-वा कीटो-पेंटोज शर्करांना जीवरसायनशास्त्रात महत्त्वाचे स्थान आहे. रिबोज व D– ऑक्सिरिबोज ह्या शर्करा न्यूक्लिइक अम्ल, न्यूक्लिओटाइडे आणि न्यूक्लिओसाइडे यांचे महत्त्वाचे घटक आहेत [→ न्यूक्लिइक अम्ले]. इतर पेंटोजांचा अंतर्भाव पॉलिसॅकॅराइडे व ग्लायकोप्रथिनांत होतो. झायलुलोज आणि रिब्युलोज ही कीटोपेंटोजे ग्लुकोजाच्या चयापचय मार्गातील महत्त्वाची मध्यस्त संयुगे होत.
कोष्टक क्र. २. काही कार्बोहायड्रेटांचे प्रकाशीय वलन [α]D मूल्ये
[ पाणी हे विद्रावक आणि २०० से. तापमान असताना]| कार्बोहायड्रेटाचे नाव | आल्फा प्रकार | बीटा प्रकार | समतोल |
| L – अरॅबिनोज | + ७५⋅५० | + १९०⋅५० | + १०५० |
| D – फ्रुक्टोज | – २१० | – १३३⋅५० | – ९२० |
| D – गॅलॅक्टोज | + १५०⋅७० | + ४३० | + ८०० |
| D – ग्लुकोज | + ११२⋅२० | + १८⋅७० | + ५२⋅७० |
| लॅक्टोज | + ८५० | + ३५० | + ५२⋅५० |
| माल्टोज | + १३३० | + ११२⋅५० | + १३०० |
| D–मॅनोज | + २९⋅३० | – १७० | + १४⋅२० |
| L–ऱ्हॅम्नोज | – ८⋅५० | + ३४० | + ८⋅२० |
| सेलमेबायोज | — | — | + ३५० |
| डेक्स्ट्रिन | — | — | + १९५० |
| D-ग्लिसराल्डिहाइड | — | — | + १४० |
| ग्लायकोजेन | — | — | + १९६० |
| D-रिबोज | — | — | – १९⋅५० |
| L-सॉर्बोज | — | — | – ४३⋅४० |
| स्टार्च | — | — | + १९६० |
| सुक्रोज | — | — | + ६६⋅५० |
गुणधर्म : रासायनिक संरचना व विक्रिया यांनुसार मोनोसॅकॅराइडे आल्डिहाइडी किंवा कीटोनी अल्कोहॉले आहेत. त्यांच्यापासून एस्टरे व ईथरे मिळतात. त्यांचे क्षपण केल्यास दोन हायड्रोजन अणू समाविष्ट होऊन त्या त्या मोनोसॅकॅराइडानुसार पॉलिहायड्रिक अल्होहॉले मिळतात. आल्डोजावर सौम्य ऑक्सिडीकारकांची विक्रिया होऊन कार्बॉक्सिलिक अम्ले मिळतात. यामध्ये फक्त आल्डिहाइड गटाचे ऑक्सिडीकरण झालेले असते. या प्रकारे D–ग्लुकोजापासून D–ग्लुकॉनिक अम्ल मिळते. ही अम्ले क्षारीय विद्रावात लवणरूपाने अस्तित्वात असतात. मुक्तरूपात त्याचे गॅमा लॅक्टोन (पंचपदी वलय) किंवा डेल्टा लॅक्टोनात (षट्पदी वलयात) त्वरेने रूपांतर होते.
तीव्र ऑक्सिडीकारकांच्या योगे सॅकॅरिक अम्ले मिळतात. यात दोन कार्बॉक्सिल गट असून ते आल्डिहाइडो गटाचे आणि रेणूच्या दुसऱ्या टोकाला असलेल्या प्राथमिक OH गटाचे ऑक्सिडीकरण होऊन झालेले असतात. त्यापासूनही लॅक्टोने मिळतात.
कीटोजांचे ऑक्सिडीकरण झाल्याने रेणूची कार्बन शृंखला तुटते व मूळ रेणूतील कार्बन संख्येपेक्षा कमी कार्बन संख्या असलेली अम्ले मिळतात.
आल्डोज व कीटोजे यांवर फिनिल हायड्राझोनाच्या एका रेणूची प्रथम विक्रिया होऊन प्रथम फिनिल हायड्राझोन वर्गाची संयुगे मिळतात. परंतु विक्रियाकारक (विक्रिया घडवून आणणारा पदार्थ) अतिरिक्त प्रमाणात व सौम्य अम्लीय माध्यमात असेल, तर त्याची आणखी विक्रिया होऊन पिवळ्या रंगाची ओसाझोन वर्गाची संयुगे अवक्षेपित होतात (अविद्राव्य घन स्वरूपात साचतात). ही चांगली स्फटिकरूप असून त्यांचा उपयोग मोनोसॅकॅराइडांचे विलगीकरण आणि अभिज्ञान यांसाठी होतो. फेलिंग विद्राव तापविल्यास त्यातील क्युप्रस ऑक्साइड मोनोसॅकॅराइडांच्यामुळे तांबड्या अवक्षेप रूपाने विलग होते. इतर क्षपणकारके उपस्थित नसतील, तर मोनोसॅकॅराइडांच्या गुणात्मक व परिणामात्मक निश्चितीसाठी ही विक्रिया वापरली जाते. गुणात्मक रीत्या शर्करांचे अस्तित्व दर्शविण्यासाठी फुरफुराल, मॉलीश इ. परीक्षाही वापरतात.
एखाद्या आल्डोजापासून पुढीलप्रमाणे कीटोज तयार करता येते.
|
|
फिनिल |
|
जलीय |
|
क्षपण |
|
|
आल्डोज |
→ |
ओसाझेन |
→ |
आसोन |
→ |
कीटोज. |
|
|
हायड्राझोन |
|
विच्छेदन |
|
|
|
तसेच कीटोजापासून पुढीलप्रमाणे आल्डोज तयार करता येते.
|
|
क्षपण |
|
ऑक्सिडीकरण |
|
पाणी |
|
|
कीटोज |
→ |
अल्कोहॉल |
→ |
एकक्षारकीय अम्ल |
→ |
|
|
|
|
|
|
|
|
|
क्षपण |
|
|
लॅक्टोन |
→ |
आल्डोज |
|
|
|
|
शर्करांच्या ऑक्सिडीकरणाने व क्षपणाने निर्माण होणारे पदार्थ : आल्डोजांच्या कार्बन अणू क्र.१ च्या ऑक्सिडीकरणाने आल्डोनिक अम्ले तयार होतात. ही विक्रिया अम्ल विद्रावात ब्रोमिनामुळे सहज होते. जर कार्बन अणू क्र. ६ ठिकाणी ऑक्सिडीकरण केले, तर आल्डुरॉनिक अम्ले तयार होतात. त्या त्या आल्डोजाच्या नावावरून आल्डोनिक अम्ल किंवा आल्डुरॉनिक अम्ल यांचे नामाभिधान करतात.

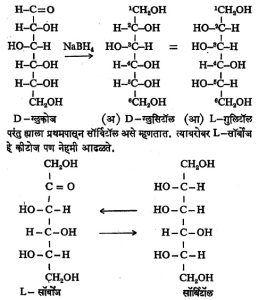
सोडियम बोरोहायड्राइडासारख्या विक्रियाकारकामुळे शर्करांच्या कार्बोनिल गटाचे (आल्डिहाइडी अथवा कीटोनी) क्षपण होऊन अल्कोहॉल गट तयार होतो. परंतु ह्या प्रक्रियेमुळे जे अल्कोहॉल तयार होते
त्याचे नामाभिधान करणे जरा अवघड असते. उदा., D–ग्लुकोजापासून होणाऱ्या अल्कोहॉलाचे नाव वास्तविक D–ग्लुसिटॉल असे होईल. पण अल्कोहॉलाचा हा रेणू असा आहे की, त्यातील कार्बन अणू क्र. १ व क्र. ६ हे समान आहेत. त्यामुळे कार्बन क्र. ६ हाही कार्बन क्र. १ होऊ शकतो. तसे केले तर खालील सूत्रांमध्ये ‘आ’ ने दाखविलेली संरचना होते. ती ग्लुकोजापासून मिळणाऱ्या अल्कोहॉलासारखी आहे. त्यामुळे याच संयुगास L – गुलिटॉल असेही म्हणता येईल.
काही महत्त्वाची मोनोसॅकॅराइडे : (१) ग्लुकोज : (डेक्स्ट्रोज, द्राक्षशर्करा). ही शर्करा पिकलेल्या द्राक्षात, मधात व बहुतेक सर्व गोड फळांत आढळते. ती रक्ताचा एक घटक असून मधुमेहाने पीडीत रोग्याच्या मूत्रात आढळते. स्टार्च व विरल हायड्रोक्लोरिक अम्ल दाबाखाली तापवून D – ग्लुकोजाचे व्यापारी उत्पादन करीत. सांप्रत ॲस्परजिलस नायजर वा फंगल अमायलेज एंझाइमाने (सजीव पेशींमध्ये तयार होणाऱ्या व रासायनिक विक्रिया घडविण्यास मदत करणाऱ्या संयुगाने) जलीय विच्छेदन करून ती मिळवितात. D – ग्लुकोज हे पांढरे स्फटिकीय घन आहे. याचे आल्फा आणि बीटा असे दोन समघटक आहेत. आल्फा समघटकाचा वितळबिंदू १४६० से. असून ते पाण्यात जलद विद्राव्य, पण एथेनॉलामध्ये साधारण विद्राव्य तर ईथरामध्ये अविद्राव्य आहे. याची चव गोड आहे पण ते सुक्रोजाइतके गोड नाही. नैसर्गिक रीत्या आढळणारे D – ग्लुकोज दक्षिणवलनी असून ते तीव्र क्षपणकारक आहे. ह्या शर्करेचा उपयोग शरीरात तिचा अभाव असल्यास औषध म्हणून करतात [→ ग्लुकोज व फ्रुक्टोज]. (२) D (+) मॅनोज : आयव्हरी नट या फळापासून सल्फ्यूरिक अम्लाने जलीय विच्छेदन करून व्यापारी प्रमाणावर हिचे उत्पादन करतात. हिचा वितळबिंदू १३२० से. असूनही ती ग्लुकोजाचा त्रिमितीय समघटक आहे. (३) D (+) गॅलॅक्टोज : बऱ्याच पॉलिसॅकॅराइडांमध्ये आढळते. लॅक्टोज या डायसॅकॅराइडामध्ये ती ग्लुकोजाबरोबर संयोगावस्थेत असते. लॅक्टोजाचे जलीय विच्छेदन करून मिळणाऱ्या दोन मोनोसॅकॅराइडांच्या मिश्रणातून भागश: स्फटिकीकरणाने पाण्यात ग्लुकोज विद्रुतावस्थेत ठेवून गॅलॅक्टोज वेगळे करतात. हिचा वितळबिंदू ११८० से. असून रासायनिक विक्रियांमध्ये हिचे कार्य ग्लुकोजासारखेच होते. (४) D (-) फ्रुक्टोज : ही कीटोहेक्झोज असून ती फळात व मधात आढळते. तसेच साखरेमध्ये (सुक्रोजामध्ये) ती ग्लुकोजाबरोबर संयोगावस्थेत असते व साखरेच्या जलीय विच्छेदनाने व नंतर भागश: स्फटिकीकरणाने वेगळी करतात. इन्युलीन या पॉलिसॅकॅराइडाच्या जलीय विच्छेदनाने तिचे व्यापारी उत्पादन करतात. ती साखरेपक्षा गोड असून चटकन स्फटिकरूप होत नाही. तिचा वितळबिंदू १०२० से. असून या तापमानाला तिचे अपघटन होते. ती वामवलनी आहे. ती पाण्यात जलद विद्राव्य, एथेनॉलामध्ये साधारण विद्राव्य, तर ईथरामध्ये अविद्राव्य आहे. ती तीव्र क्षपणकारक आहे [→ ग्लुकोज व फ्रुक्टोज]. (५) L – सॉर्बोज : (सॉर्बिनोज). ही कीटोहेक्झोज असून ती माऊंटन ॲशबेरी या फळाच्या रसातील सॉर्बिटॉलापासून बॅक्टेरियम झायलीनम या सूक्ष्मजंतूच्या साहाय्याने तयार करतात. तिचे यीस्टाचे किण्वन (आंबविण्याची क्रिया) होत नाही. तिचा वितळबिंदू १५४० से. आहे. (६) ग्लायकोसाइडे : मोनोसॅकॅराइडाची इतर कार्बनी संयुगांशी ईथरासारख्या बंधाने संयोग होऊन झालेल्या अनुजातास ग्लायकोसाइडे ही संज्ञा आहे. ही वनस्पतींमध्ये मोठ्या प्रमाणावर आढळतात. ग्लुकोज ह्या मोनोसॅकॅराइडापासून बनलेल्यांना ग्लुकोसाइडे, मॅनोजापासून बनलेल्यांना मॅनोसाइडे इ. नावे आहेत. एंझाइमांची विक्रिया केल्यास किंवा विरल खनिज अम्ले यांच्याबरोबर तापविल्यास जलीय विच्छेदन होऊन शर्करा आणि शर्करेतर भाग यांचे मिश्रण मिळते. या शर्करेतर भागास अग्निकोन असे म्हणतात. फुलांना व फळांना ज्यामुळे रंग येतात ती रंगद्रव्ये, कडू बदामातील ॲमिग्डॅलीन, विलो या वनस्पतीच्या पानातील सॅलिसीन इ. संयुगे याची उदाहरणे होत [→ग्लायकोसाइडे].
ऑलिगोसॅकॅराइडे : डायसॅकॅराइडे, ट्रायसॅकॅराइडे, टेट्रासॅकॅराइडे व पेंटॅसॅकॅराइडे यांचा यात समावेश होतो. ही नावे त्यांमध्ये असणाऱ्या अनुक्रमे दोन, तीन, चार आणि पाच मोनोसॅकॅराइड एककांची निर्देशक आहेत. मुक्त शर्करा गट असणारी ऑलिगोसॅकॅराइडे आल्फा व बीटा प्रकारांत आढळतात.
डायसॅकॅराइडे : (C12H22OH11). ज्ञात असलेली काही डायसॅकॅराइडे व त्यांतील मोनोसॅकॅराइड घटक ही कोष्टक क्र. ३ मध्ये दिली आहेत.
कोष्टक क्र. ३. डायसॅकॅराइडे व त्यांतील मोनोसॅकॅराइड घटक.
| डायसॅकॅराइडाचे नाव | मोनोसॅकॅराइड घटकांची नावे |
| क्षपणकारी शर्करा
माल्टोज लॅक्टोज सेलोबायोज जेन्शिओबायोज मेलिबायोज ट्यूरानोज अक्षपणकारी शर्करा सुक्रोज ट्रेहालोज |
ग्लुकोज, ग्लुकोज ग्लुकोज, गॅलॅक्टोज ग्लुकोज, ग्लुकोज ग्लुकोज, ग्लुकोज ग्लुकोज, गॅलॅक्टोज ग्लुकोज, फ्रुक्टोज
ग्लुकोज, फ्रुक्टोज ग्लुकोज, ग्लुकोज |
यांपैकी माल्टोज, लॅक्टोज आणि सुक्रोज ह्या शर्करा पोषणाच्या दृष्टीने महत्त्वाच्या आहेत.
(१) माल्टोज : (माल्ट शर्करा, माल्टोबायोज). अमायलेज किंवा डायास्टेज या एंझाइमांनी स्टार्चाचे जलीय विच्छेदन केल्यास माल्टोज तयार होते. हा कॉर्न सायरपाचाही (मक्यापासून केलेल्या गोड द्रवाचाही) एक महत्त्वाचा घटक आहे. लाळेतील टायलीन व अग्निपिंडातील ॲमिलॉप्सीन या एंझाइमांच्या विक्रियेने पचनक्रियेत माल्टोज मध्यस्थ पदार्थ म्हणून तयार होते. ही क्षपणकारी शर्करा असून तिचा वितळबिंदू १००० से. आहे. ही शर्करा दक्षिणवलनी आहे. जलीय विच्छेदनाने तिच्या एका रेणूपासून ग्लुकोजाचे दोन रेणू मिळतात. माल्टोजाचे आल्फा व बीटा असे दोन प्रकार आहेत. बीटा प्रकारच्या माल्टोजाचे स्फटिक तयार होतात. माल्टेज या एंझाइमाची विक्रिया आल्फा प्रकारावर होते, बीटा प्रकारावर होत नाही. यीस्टाने माल्टोजाचे लवकर किण्वन होते. (२) लॅक्टोज : प्राण्यांच्या दुधात ही शर्करा सापडते. गायीच्या दुधात ती सु. ५ टक्के असते. दुधापासून चीज हे खाद्य तयार करताना, लॅक्टोज उपपदार्थ म्हणून मिळते. तिचे स्फटिक समचतुर्भुजी असून त्यांत पाण्याचा एक रेणू समाविष्ट असतो. १४०० से. ला ती निर्जल होते व २०५० से. ला अपघटन होऊन (घटक द्रव्ये अलग होऊन) वितळते. ती दक्षिणवलनी असून तीत प्रकाशीय वलनांतर आढळून येते. ती क्षपणकारी शर्करा असून तिच्यापासून ओसाझोन मिळते. तिचे आल्फा व बीटा प्रकार आढळतात. अम्लामुळे किंवा लॅक्टेज या एंझाइमामुळे तिचे जलीय विच्छेदन होऊन ग्लुकोज व गॅलॅक्टोज ही मोनोसॅकॅराइडे मिळतात. यीस्टाने तिचे लवकर किण्वन होत नाही, पण तिचे लॅक्टिक अम्लाने जलद किण्वन होते. ती सुक्रोजाइतकी गोड नाही. औषधात व लहान मुलांच्या अन्नात तिचा वापर केला जातो. (३) सुक्रोज : ऊस व साखरेचे बीट यांच्या रसात मुख्यत: सुक्रोज आढळते. सुक्रोज म्हणजेच नेहमीची साखर होय. पिकलेल्या फळात सुक्रोजाचे प्रमाण जास्त असते. शर्करांपैकी सुक्रोज ही सर्वांत जास्त प्रमाणात निसर्गात आढळते. सौम्य अम्लाचे जलीय विच्छेदन करून व इन्व्हर्टेज किंवा सुक्रेज या एंझाइमांची विक्रिया होऊन सुक्रोजाच्या एका रेणूपासून ग्लुकोज व फ्रुक्टोज यांचा प्रत्येकी एक रेणू मिळतो या ग्लुकोज व फ्रुक्टोज यांच्या मिश्रणास पर्यस्त (इन्व्हर्ट) शर्करा म्हणतात. सुक्रोजाचे प्रकाशीय वलन + ६६⋅५० आहे. तर स्थिर पर्यस्त शर्करेचे -१९⋅९० आहे. वितळबिंदू १६०० से. आहे. जास्त तापविल्यास लकडी (कॅरमेल) नावाचा एक गोड पदार्थ मिळतो. सुक्रोज ही क्षपणकारी शर्करा नाही [→ साखर]. (४) सेलोबायोज : सेल्युलोजाच्या अपूर्ण जलीय विच्छेदनाने सेलोबायोज तयार होते. ही एक क्षपणकारी शर्करा आहे.
ट्रायसॅकॅराइडे व इतर शर्करा : मॅनिनोट्रायेज, रॅफिनोज, ऱ्हॅम्निनोज, रॉबिनोज, जेन्शिआनोज, मेलेझायटोज ही ट्रायसॅकॅराइडे स्टॅकिओज व स्कोरोडोज ही टेट्रासॅकॅराइडे आणि व्हिर्बास्कोज हे पेंटासॅकॅराइड ज्ञात आहेत. त्यांपैकी रॅफिनोज ही तेवढी महत्त्वाची आहे. ती साखरेच्या बिटामध्ये व बिटापासून तयार केलेल्या साखरेच्या संहत (जास्त प्रमाण असलेला) विद्रावात, सरकीत, काही वनस्पतींत व कवकांत (बुरशीसारख्या हरितद्रव्यरहित सूक्ष्म वनस्पतींत) आढळते. ती अक्षपणकारी शर्करा आहे. पूर्ण जलीय विच्छेदन झाल्यावर हिच्या एका रेणूपासून फ्रुक्टोज, ग्लुकोज व गॅलॅक्टोज यांचा प्रत्येकी एक रेणू मिळतो. यीस्टाने तिचे किण्वन होत नाही. ही औषधात व सूक्ष्मजीवशास्त्रात उपयोगी पडते.
पॉलिसॅकॅराइडे : (C6H10O5) n. मोनोसॅकॅराइडांचे अनेक रेणू एकत्र येऊन त्यांच्या संयोगाने पॉलिसॅकॅराइडाचे रेणू तयार होतात. त्यांच्या उपयोगावरून त्यांचे दोन प्रकार करतात : (१) वनस्पती व काही प्राणी यांचे सांगाडे ज्यांचे बनतात अशी व (२) आवश्यकतेनुसार एंझाइमांच्या विक्रियेने शर्करा निर्माण करता याव्यात म्हणून प्राण्यांच्या शरीरात साठविली जाणारी. दोन्ही प्रकारांच्या रेणूंचे भार मोठे असतात. हेक्झोज किंवा पेंटोज शर्करांच्या अनेक रेणूंपासून त्यांचे रेणू बनलेले असतात.
सेल्युलोज : सर्व वनस्पतींच्या कोशिकांच्या आवरणात हे असते. ग्लुकोजाच्या बीटा प्रकारापासून बनलेले हे बहुवारिक (अनेक रेणूंच्या संयोगाने तयार झालेल्या जटिल रेणूंचे संयुग) आहे. ते अमायलोजासारखे दिसते. त्याच्या रेणूत सु. २,००० ते ९,००० ग्लुकोज एकके असतात. मानव व इतर मांसाहारी प्राणी सेल्युलोज पचवू शकत नाहीत. परंतु अनेक सूक्ष्मजंतू, गोगलगायी, तसेच रवंथ करणारे प्राणी हे पचवितात [→ सेल्युलोज].
कायटिन : कवचधारी वर्गातील प्राण्यांची आणि कीटकांची कठीण कवचे या पॉलिसॅकॅराइडाची असतात. याच्या रेणूची रचना पुष्कळशी सेल्युलोजाच्या रेणुरचनेसारखी आहे. जो फरक आहे तो एवढाच की, सेल्युलोजातील २ -स्थानी असणाऱ्या हायड्रॉक्सिल गटाऐवजी येथे ॲसिटिल ॲमिनो गट NH-CO-CH3 असतो. अम्लाने कायटिनाचे जलीय विच्छेदन केल्यास ग्लुकोसामीन व ॲसिटिक अम्ल मिळते [→ कायटिन].
स्टार्च : बहुसंख्य वनस्पतींमध्ये साठ्यांच्या रूपाने हे पॉलिसॅकॅराइड असते. ६०-८०० से. तापमानास पाण्याच्या योगाने स्टार्चापासून जलविद्राव्य अमायलोज व अविद्राव्य अमायलोपेक्टीन असे दोन भाग वेगळे करता येतात. मक्यापासून मिळणाऱ्या स्टार्चात यांचे प्रमाण अनुक्रमे १०—२० टक्के व ८०—९० टक्के असे असते. अमायलोजाचे अमायलेज या एंझाइमाने जलीय विच्छेदन होऊन माल्टोज मिळते. अमायलोजाचा रेणुभार १०,००० ते ६०,००० एवढा आहे. १० लाख रेणुभार असलेल्या अमायलोजाच्या रेणूत ६,००० ग्लुकोजाचे घटक असतात. अमायलोपेक्टिनाचे पूर्ण जलीय विच्छेदन केल्यास ६० टक्के माल्टोज व उरलेले डेक्स्ट्रीन-ए मिळते. आयोडिनाबरोबर अमायलोजाला निळा रंग येतो पण अमायलोपेक्टिनाला तांबूस निळा येतो.
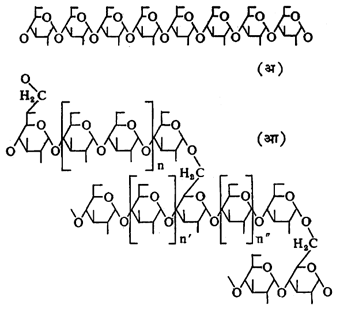
अमायलोज हे लांब शाखा नसलेल्या आल्फा ग्लुकोजाचे बहुवारिक आहे. अमायलोपेक्टीन हे आल्फा ग्लुकोज एककांचेच बनलेले आहे, पण त्यास अनेक शाखा आहेत. अनेक हायड्रॉक्सिल गटांनी युक्त असलेले अनेक रेणू स्टार्चामध्ये एकमेकांस घट्ट चिकटलेले असतात, परंतु त्यांची संलग्नता अनियमित असते. पाण्याच्या रेणूंमुळे त्यातील हायड्रोजन बंधांचे जाळे पूर्णपणे सुटत नाही, त्यामुळे स्टार्च पाण्यात पूर्णपणे विद्राव्य होत नाही. बारीक पूड केलेला स्टार्च प्रथम थोड्या पाण्यात चांगला मिश्र करून ते मिश्रण बऱ्याच उकळत्या पाण्यात टाकल्यास स्टार्चाचा कलिल (अतिसूक्ष्म कण लोंबकळत असलेले विशिष्ट प्रकारचे द्रव मिश्रण) विद्राव मिळतो. स्टार्चामधील ग्लुकोज एककांना जोडणाऱ्या ॲसिटली ऑक्सिजनयुक्त बंधाचे विच्छेदन अम्ले आणि एंझाइम यांच्यायोगे सहज होते. स्टार्चाचे पचन होते त्यावेळी पाचक रसामुळे त्यांचे जलीय विच्छेदन होते. अमायलोज व अमायलोपेक्टीन यांच्या संरचना आकृतीत (अ) व (आ) यामध्ये दाखविल्याप्रमाणे असतात. त्यांचे रेणू आकृतीत अनुक्रमे (इ) व (उ) मध्ये दाखविल्याप्रमाणे असून त्यांचे अपघटन अनुक्रमे (ई) व (ऊ) मध्ये दाखविल्याप्रमाणे होते [→ स्टार्च].
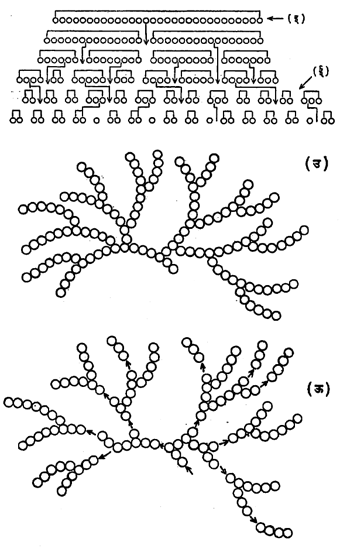
ग्लायकोजेन : आहारातील कार्बोहायड्रेटांपैकी काही अंशाचे ग्लायकोजेनात रूपांतर होऊन त्याचा यकृत आणि स्नायु-कोशिकाजाल (स्नायूतील पेशींचे जाळे) यांमध्ये संचय होतो. या संचयातून आवश्यकतेनुसार शरीराला रासायनिक शक्ती पुरविण्यासाठी ग्लुकोजाच्या रेणूंचा पुरवठा होतो. ग्लायकोजेन व स्टार्च यांच्या संरचनेत फरक आहे. ग्लायकोजेन अमायलोपेक्टिनापेक्षाही जास्त शाखामय आहे. जलीय विच्छेदनाने त्याचे ग्लुकोजामध्ये रूपांतर होते व एंझाइमाने माल्टोज होते. आयोडिनामुळे त्याला जांभळट तांबडा रंग येतो. त्याचा रेणुभार ३ लक्ष ते १ कोटी असतो [→ ग्लायकोजेन].
ॲमिनो शर्करा : पुष्कळशा आल्डोज शर्करांमध्ये हायड्रॉक्सिल गटाऐवजी ॲमिनो किंवा ॲसिटल-ॲमिनो गट असतात. अशा शर्करांना ॲमिनो शर्करा म्हणतात. ग्लुकोसामीन, गॅलॅक्टोसामीन व मॅनोसामीन ह्या ॲमिनो शर्करा प्रथिनांबरोबर निसर्गात आढळतात. सर्व नैसर्गिक ॲमिनो शर्करा २-हेक्झोसामीन प्रकारच्या असतात. यांपैकी ग्लुकोसामीन ही ह्या पॉलिसॅकॅराइडांसारख्या पदार्थांत आढळते.
डिंक : वनस्पति डिंकज ही हेक्झोज किंवा पेंटोज किंवा दोन्ही व एक कार्बोहायड्रेट अम्ल गट असलेली संयुगे होत. डिंकाचे जलीय विच्छेदन केल्यास गॅलॅक्टोज आणि अरॅबिनोज किंवा झायलोज या एकएकट्या किंवा मिश्रणरूपाने मिळतात [→डिंक].
पेक्टीन : हे लिंबू (सिट्रस) वंशातील फळे, सफरचंद, बीट, गाजर इत्यादींच्या गरात आढळते. साखर व पुरेशी अम्लता असली म्हणजे त्यापासून जेली मिळते. सेल्युलोजाबरोबर पेक्टीन संयोगित अवस्थेत कोशिकाभित्तींमध्ये आढळते. त्यापासून ते जलीय विच्छेदनाने अलग करतात [→ पेक्टीन].
म्युकोपॉलिसॅकॅराइडे : ॲमिनो शर्करा व युरोनिक अम्ल ही एकके असलेल्या पदार्थांना म्युकोपॉलिसॅकॅराइडे म्हणतात. काही म्युकोपॉलिसॅकॅराइडांमध्ये युरोनिक अम्ल नसते, ती ॲमिनो शर्करा व मोनोसॅकॅराइड ह्या एककांपासून बनलेली असतात. ही ऊतकांचे (सजीवांच्या शरीरातील समान रचना व कार्य करणाऱ्या पेशीसमूहांचे) आवश्यक घटक आहेत. त्यांमध्ये ती प्रथिनांबरोबर संयुक्तावस्थेत आढळतात. हायलुरॉनिक अम्ल, हेपारीन, काँड्राइटीन सल्फेटे, रक्त-गट पॉलिसॅकॅराइडे यांचा ह्या वर्गात समावेश होतो. हायलुरॉनिक अम्ल हे D-ग्लुकोसामीन, D-ग्लुकोरॉनिक अम्ल आणि ॲसिटिक अम्ल ह्यांचे बनलेले असते. ते प्राण्यांच्या संयोजी व इतर ऊतकांत आढळते [→ऊतके, प्राण्यांतील]. सांध्यात ते वंगणाचे व आघात- शोषणाचे काम करते. काँड्राइटीन सल्फेटांचे ए, बी व सी असे तीन प्रकार असून त्यांची संरचना हायलुरॉनिक अम्लाप्रमाणेच असते. त्यात D-ग्लुकोसामीन याऐवजी D-गॅलॅक्टोसामीन असते. ही संयोजी ऊतकांत आढळतात. हेपारीन हे संयुग रक्तक्लथनरोधी (रक्ताची गुठळी होण्यास विरोध करणारे) आहे. ते यकृत, प्लीहा, फुप्फुसे इत्यादींत आढळते. ते D-ग्लुकोसामीन व D-ग्लुकोरॉनिक अम्ल यांचे बहुवारिक (एकाच द्रव्याचे अनेक रेणू एकमेकांशी संयोग पावून बनलेले) आहे. रक्त-गट पॉलिसॅकॅराइडे ही लाळ, रक्त-कोशिका, जठर श्लेष्मरस (बुळबुळीत स्त्राव) व इतर स्त्राव इत्यादींमध्ये आढळतात. प्रथिनांबरोबर विक्रिया झाल्यामुळे ए, बी, ओ (एच), आरएच इ. रक्त-गटांचे लाक्षणिक गुणधर्म सिद्ध होतात [→ रक्त-गट]. बरीच रक्त-गट पॉलिसॅकॅराइडे D-ग्लुकोसामीन किंवा D-गॅलॅक्टोसामीन व साधी शर्करा यांपासून तयार होतात. सिॲलिक अम्ले ही ऊतकांत मोठ्या प्रमाणात, विशेषत: श्लेष्मरस व रक्त-गट पदार्थात, आढळतात. ती शरीरातील जटिल लिपिडे व कार्बोहायड्रेटे यांचे घटक आहेत. एन्फ्लूएंझा व्हायरसामधील न्युरमिडेज या एंझाइमामुळे रूग्णाच्या कोशिकेतील आपल्या स्थानापासून सिॲलिक अम्ले निराळी होतात. ही अम्ले निरनिराळ्या शर्करांमधील शेवटच्या अक्षपणीय जागी असतात व ती ॲसिटल D-गॅलॅक्टोसामीन किंवा D-गॅलॅक्टोजाला कीटोस्वरूपात जोडलेली असतात.
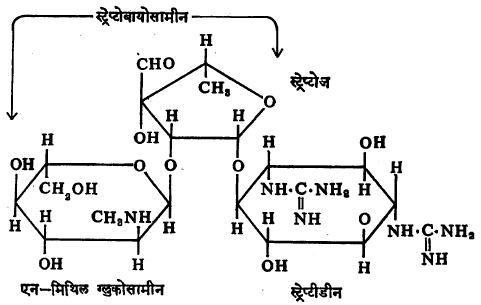
सूक्ष्मजीव पॉलिसॅकॅराइडे : निरनिराळ्या वंशांतील सूक्ष्मजंतूंपासून जटिल कार्बोहायड्रेटे वेगळी करण्यात आली आहेत. त्यांना सामान्यपणे विशिष्ट (स्पेसिफिक) पॉलिसॅकॅराइडे म्हटले जाते. ह्या कार्बोहायड्रेटांचे जलीय विच्छेदन केल्यास युरोनिक अम्ले, ग्लुकोज, गॅलॅक्टोज, ऱ्हॅम्नोज, अरॅबिनोज इ. मोनोसॅकॅराइडे व ॲमिनो शर्करा आणि ॲसिटिक अम्ल ही मिळतात. स्ट्रेप्टोमायसीन इ. प्रतिजैव पदार्थांत शर्करा असतात. स्ट्रेप्टोमायसिनाच्या संरचनेचे दोन भाग पडतात (पृ. ७६२ वरील सूत्र पहा). नायट्रोजन असलेले डायसॅकॅराइड (स्ट्रेप्टोबायोसामीन) हा एक व स्ट्रेप्टीडीन नामक क्षारक (अम्लाशी विक्रिया होऊन लवणे देणारा पदार्थ) हा दुसरा [→प्रतिजैव पदार्थ].
कार्बोहायड्रेटांचे विलगीकरण, अभिज्ञान आणि मापन : निसर्गात कार्बोहायड्रेटे मिश्रणरूपात असतात म्हणून त्यांचे अभिज्ञान आणि मापन करण्यापूर्वी ती विलग करावी लागतात. त्याकरिता त्यांचे फिनिल हायड्रोझोन व फिनिल ओसाझोन या वर्गांचे अनुजात बनविणे सोयीचे असते. कारण हे अनुजात सुकरतेने बनतात आणि स्फटिकीकरणाने त्यांचे शुद्धीकरण करणे सोपे असते. शुद्ध अनुजातांचे वितळबिंदू, प्रकाशीय वलन इ. भौतिक गुणांचा उपयोग करून त्यांचे अभिज्ञानही करता येते.
नमुना अत्यल्प असेल तर गालनपत्र ⇨वर्णलेखन पद्धतीने मिश्रणाचे घटक विलग करता येतात, त्यांचे अस्तित्व दाखविता येते आणि अभिज्ञानही करता येते. तनुस्तर वर्णलेखन पद्धतीही या कामी उपयोगी पडते व गालनपत्र पद्धतीऐवजी ती अधिक वापरण्यात येत आहे.
नमुना पुरेसा असेल तर स्तंभ वर्णलेखन पद्धती वापरता येते. या ठिकाणी ॲल्युमिना, सेल्युलोजाची पूड, कोळसा किंवा सिलिसिक अम्ल अधिशोषणाकरिता (पृष्ठभागावर शोषण करण्याकरिता) वापरतात.
वायुद्रव वर्णलेखन पद्धतीनेही विलगीकरण होते. त्याकरिता शर्करांची ॲसिटेटे, ट्रायफ्ल्युरोॲसिटेटे आणि मिथिल एस्टरे वापरतात.
कार्बोहायड्रेटांचे अस्तित्व काही वर्णपरीक्षांनीही ठरविता येते. उदा., संहत सल्फ्युरिक अम्ल आणि आल्फा-नॅप्थॉल यांचे मिश्रण कार्बोहायड्रेटाच्या विद्रावात मिसळले तर जांभळा रंग येतो (मॉलीश यांची परीक्षा). ॲसिटिक अम्लात विरघळलेल्या बेंझिड्रिनाच्या विद्रावात तापविल्यास पेंटोज वर्गाच्या कार्बोहायड्रेटांमुळे चेरीसारखा तांबडा रंग येतो. रिसॉरसिनॉल व हायड्रोक्लोरिक अम्ल यांच्या मिश्रणामुळे कीटोज शर्करांना तांबडा रंग येतो. पोटॅशियम आयोडाइडामध्ये विरघळलेल्या आयोडीन विद्रावाचा रंग स्टार्च या पॉलिसॅकॅराइडामुळे निळा होतो व ग्लायकोजेनामुळे करडा होतो.
आल्डोजे व कीटोजे क्षपणकारक आहेत. या गुणाचा उपयोग त्यांचे परिणामात्मक विश्लेषण करण्याकरिता होतो. सुक्रोज आणि रॅफिनोज यांसारख्या मूलत: क्षपणकारी नसलेल्या शर्करांचे तसेच स्टार्चाचे जलीय विच्छेदन केल्यास त्यापासून क्षपणकारी घटक मिळतात. त्यांचा उपयोग त्या शर्करांचे प्रमाण ठरविण्याच्या कामी करता येतो.
फेलिंग यांच्या विद्रावात क्षपणकारी कार्बोहायड्रेटे तापविली म्हणजे क्युप्रस ऑक्साइडाचा जो अवक्षेप मिळतो, तो त्या कार्बोहायड्रेटाच्या प्रमाणास अनुसरून असतो.
नमुना पुरेसा असेल आणि त्यामध्ये प्रकाशत: सक्रिय असलेला दुसरा पदार्थ नसेल, तर शर्करेच्या विशिष्ट प्रकाशीय वलनाचा उपयोग करूनही शर्करेचे अभिज्ञान आणि मापन करता येते.
अवरक्त वर्णपटमापन, प्रोटॉन-चुंबकीय अनुस्पंदी वर्णपटमापन, द्रव्यमान वर्णपटमापन व क्ष-किरण वर्णपटमापन यांचा उपयोग कार्बोहायड्रेटांची संरचना आणि विन्यास यांच्या निश्चितीसाठी करतात [→द्रव्यमान वर्णपटविज्ञान वर्णपटविज्ञान वैश्लेषिक रसायनशास्त्र].
शर्करांच्या विशेष विक्रिया : (१) ज्या शर्करांच्या रेणूत हेमिॲसिटल गट असतो त्याची फिनिल हायड्रॅझिनाच्या तीन रेणूंबरोबर विक्रिया होऊन ओसाझोने तयार होतात. त्यांची विद्राव्यता, स्फटिकाकृती, निर्मितीचा वेग आणि वितळबिंदू भिन्न असतात. त्यांच्या ह्या गुणधर्मांवरून निरनिराळ्या शर्करा ओळखता येतात. ग्लुकोज, फ्रुक्टोज आणि मॅनोज यांची कार्बन अणू क्र. ३, ४ आणि ५ यांवरील मांडणी सारखीच असल्यामुळे त्यांची ओसाझोने सारखी असतात.
(२) हेमिॲसिटलासारखी संरचना असलेल्या शर्करांचे Cu++, Ag+, Bi+++ व Fe (CN)6— करवी क्षारीय विद्रावात ऑक्सिडीकरण होते. पुष्कळशा गुणवाचक आणि परिणामवाचक पद्धतींचा मूलभूत पाया ह्या विक्रियेवर आधारलेला आहे. उदा.,
|
ग्लुकोज + कॉपर सल्फेट |
सोडियम |
कॉपर ऑक्साइड (पिवळा वा तांबडा अवक्षेप). |
|
→ |
||
|
सायट्रेट |
क्षपणीय शर्करांचे प्रमाण मोजण्याकरिता जी विक्रियाकारके वापरतात त्यांत टार्टारेटासह क्युप्रिक आयन (विद्युत भारित अणू, रेणू वा अणुगट) किंवा ऑक्सिडीकारक फेरिसायनाइड असते. दिलेल्या पदार्थाबरोबर उकळल्यावर किती क्षपित क्युप्रस आयन किंवा फेरोसायनाइड आयन तयार झाले आहेत, हे निरनिराळ्या पद्धतींनी मोजतात. त्यासाठी केव्हा आयोडिनाच्या संयुगाशी विक्रिया करून मिळणाऱ्या आयोडिनाचे मापन करण्याच्या पद्धतीचा अवलंब करतात, तर केव्हा फॉस्फोमॉलिब्डेट अथवा फॉस्फोटंगस्टेटाचा उपयोग करतात. फॉस्फेट आणि मॉलिब्डेट अथवा टंगस्टेट यांचा संयोग फार तीव्र ऑक्सिडीकारक असल्यामुळे क्षपण झाल्यावर ह्यांपासून मॉलिब्डेनम ब्ल्यू असे रंगीत संयुग तयार होते आणि मॉलिब्डेनम ब्ल्यू किती प्रकाश शोषून घेते एवढेच मोजण्यात येते. किती मॉलिब्डेनम ब्ल्यू तयार झाले हे क्युप्रस आयनांच्या प्रमाणावर अवलंबून असते आणि क्युप्रस आयन किती तयार झाले हे क्षपणीय शर्करेच्या प्रमाणावर अवलंबून असते. रक्त आणि मूत्र यांतील ग्लुकोजाचे प्रमाण मोजण्याकरिता वरीलप्रमाणे क्षपणकारी शर्करेचे मापन करीत असत, परंतु ह्यामुळे ग्लुकोजाव्यतिरिक्त इतरही क्षपणकारी शर्करांचे मापन होते, केवळ ग्लुकोजाचे होत नाही. त्यामुळे सांप्रत ग्लुकोज ऑक्सिडेज या एंझाइमाचा उपयोग करतात. यात फक्त ग्लुकोजाचे ऑक्सिडीकरण झाल्यामुळे ग्लुकोनेट तयार होऊन ते हायड्रोजन पेरॉक्साइडाची निर्मिती करते. नंतर पेरॉक्सिडेजाच्या साहाय्याने पेरॉक्साइडाचे प्रमाण मोजतात. ह्याकरिता कार्बनी अमाइनावर पेरॉक्सिडेजाच्या प्रक्रिया करून किती रंगीत संयुग तयार होते हे मोजतात.
(३) जैव पदार्थातील संपूर्ण बहुवारिक कार्बोहायड्रेटांचे विश्लेषण करणे जरा अवघड आहे. अँथ्रोनाच्या तीव्र अम्लीय विद्रावात जर पॉलिसॅकॅराइडे तापविली, तर रंगीत संयुगे तयार होतात. युरोनेट वा ओसाझोनांच्या वर्णमापनावर विजातीय पॉलिसॅकॅराइडांचे मापन आधारलेले असते.
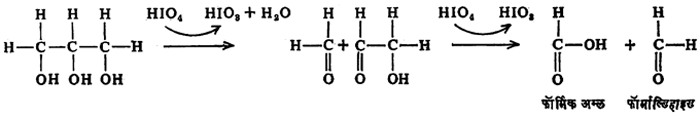
(४) परआयोडेट ऑक्सिडीकरण : ज्या संयुगात शेजारी शेजारी असणाऱ्या कार्बन अणूंना एक एक हायड्रॉक्सी गट (OH) जोडलेला असतो, अशा संयुगाचे परआयोडिक अम्लामुळे ऑक्सिडीकरण होऊन C-C बंध तुटतो. ग्लिसरॉलावर परआयोडिक अम्लाची मागील पृष्ठावर दाखविल्याप्रमाणे विक्रिया होते. ह्या विक्रियेमुळे कार्बोहायड्रेटाची संरचना ठरविण्यास बहुमोल मदत होते.
पहा : चयापचय.
संदर्भ : 1. Bell, D. J. Introduction to Carbohydrate Biochemistry, 1952.
2. Cantarow, A.; Scheparts, B. Biochemistry, Bombay, 1961.
3. Pigman, W. W., Ed. The Carbohydrates, New York, 1962.
4. West, E. S.; Todd, W. R.; Mason, H. S.; Bruggen, J. T. V. Textbook of Biochemistry, New York, 1967.
5. Wolfrom, M. L., Ed. Advances in Carbohydrate Chemistry, 17 Vols., New York, 1945—1962.
मगर, न. गं.