कार्बोनिले : कार्बन आणि ऑक्सिजन यांच्या अणूंपासून बनलेल्या CO या गटाला कार्बोनील गट असे म्हणतात. कार्बोनिल गट ![]() हा कार्बनी रसायनशास्त्रात फार महत्त्वाचा गट आहे. हा गट असलेल्या संयुगांची संख्या फार मोठी आहे. मात्र कार्बोनिल ही सामान्य संज्ञा कार्बोनिल गट ज्या धातू संयुगांत आढळतो त्यांनाच देण्यात येते. धातु-कार्बोनिलांखेरीज कार्बोनिल गट ज्या संयुगांत आढळतो अशा संयुगांत प्रथिने, शर्करा, वासाची द्रव्ये, पेनिसिलिनासारखे प्रतिजैव (अँटिबायॉटिक) पदार्थ, प्लॅस्टिके, (बेकेलाइट, टेक्सोलाइट), डेक्रॉन, नायलॉन, रेयाॅन यांसारखे कृत्रिम तंतू, रेशीम, लोकर तसेच इतर रासायनिक द्रव्यांचा समावेश होतो. कार्बोनिल गटातील कार्बन अणूला जोडलेल्या दोन गटांच्या स्वरूपावरून कार्बोनिल गट असणाऱ्या संयुगांचे सामान्यपणे काही प्रकारांत वर्गीकरण करता येते. अशा संयुगांत काही अपवाद वगळता कार्बोनिल गट हा कमीत कमी एखाद्या तरी कार्बनी गटाला (पुढील उदाहरणातील R ला) जोडलेला असतो. उदा., [R–(C = O] सारखा कार्बोनिल गट असलेला क्रियाशील ॲसिल गट, [CH 3–(C = O)–] सारखा ॲसिटल गट किंवा [C6H5–(C = O)–] सारखा बेंझॉइल गट. या गटातील एका बंधाचा हायड्रोजनाशी संयोग असला तर त्या संयुगास आल्डिहाइड असे म्हणतात उदा.,
हा कार्बनी रसायनशास्त्रात फार महत्त्वाचा गट आहे. हा गट असलेल्या संयुगांची संख्या फार मोठी आहे. मात्र कार्बोनिल ही सामान्य संज्ञा कार्बोनिल गट ज्या धातू संयुगांत आढळतो त्यांनाच देण्यात येते. धातु-कार्बोनिलांखेरीज कार्बोनिल गट ज्या संयुगांत आढळतो अशा संयुगांत प्रथिने, शर्करा, वासाची द्रव्ये, पेनिसिलिनासारखे प्रतिजैव (अँटिबायॉटिक) पदार्थ, प्लॅस्टिके, (बेकेलाइट, टेक्सोलाइट), डेक्रॉन, नायलॉन, रेयाॅन यांसारखे कृत्रिम तंतू, रेशीम, लोकर तसेच इतर रासायनिक द्रव्यांचा समावेश होतो. कार्बोनिल गटातील कार्बन अणूला जोडलेल्या दोन गटांच्या स्वरूपावरून कार्बोनिल गट असणाऱ्या संयुगांचे सामान्यपणे काही प्रकारांत वर्गीकरण करता येते. अशा संयुगांत काही अपवाद वगळता कार्बोनिल गट हा कमीत कमी एखाद्या तरी कार्बनी गटाला (पुढील उदाहरणातील R ला) जोडलेला असतो. उदा., [R–(C = O] सारखा कार्बोनिल गट असलेला क्रियाशील ॲसिल गट, [CH 3–(C = O)–] सारखा ॲसिटल गट किंवा [C6H5–(C = O)–] सारखा बेंझॉइल गट. या गटातील एका बंधाचा हायड्रोजनाशी संयोग असला तर त्या संयुगास आल्डिहाइड असे म्हणतात उदा.,
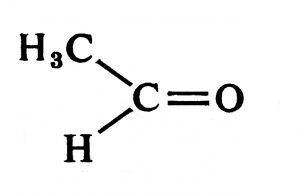
जर दोन्ही गट कार्बनी असतील तर त्या संयुगाला कीटोन असे म्हणतात उदा.,
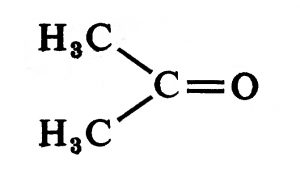
डायमिथिल कीटोन वा ॲसिटोन [→ आल्डिहाइडे कीटोने कार्बॉक्सिलिक अम्ले ॲमिनो अम्ले अमाइडे]. या नोंदीच्या उरलेल्या भागात धातु-कार्बोनिलांचेच वर्णन केले आहे.
धातु–कार्बोनिले : आवर्त सारणीच्या (मूलद्रव्यांच्या विशिष्ट पद्धतीने केलेल्या कोष्टकरूप मांडणीच्या) गट क्र. ६, ७ व ८ यांतील धातूंची कार्बोनिले होतात. क्षार धातू (आवर्त सारणीच्या पहिल्या गटातील लिथियम, सोडियम, पोटॅशियम इ. म्हणजे अल्कली धातू) आणि क्षारीय मृत्तिकांचे धातू (कॅल्शियम, स्ट्राँशियम, बेरियम व रेडियम) यांवर कार्बन मोनॉक्साइडाची विक्रिया होऊन बनणाऱ्या संयुगांचीही आनुभविक सूत्रे MCO (M = एकसंयुजी म्हणजे अणूंची परस्परांशी संयोग पावण्याची क्षमता दर्शक अंक एक असणाऱ्या धातूचा अणू) अशीच आहेत. परंतु त्यांच्या संरचना खऱ्या धातु-कार्बोनिलांपेक्षा भिन्न असल्यामुळे त्यांचा समावेश धातु-कार्बोनिलांत होत नाही.
इतिहास : निकेल कार्बोनिलाचा शोध १८९० मध्ये माँड व लांगर यांना लागला. हेच पहिले कार्बोनिल होय. निकेल व कार्बन मोनॉक्साइड यांच्यामधील विक्रियेचा अभ्यास करीत असताना त्यांना ते सापडले. नंतर १८९१ मध्ये माँड यांनी लोहाचे पेंटाकार्बोनिल बनविले. हे लोहाचे संयुग झोत भट्टी वायू, पाणवायू (प्रदीप्त कोळशावर पाण्याच्या वाफेची विक्रिया केल्यास मिळणारा वायू), प्रोड्यूसर वायू (पाण्याची वाफ, हवा व कोळसा यांच्यामध्ये उच्च तापमानाला विक्रिया करून मिळणारा वायू) वगैरेंमध्ये सापडते. जेव्हा कार्बन मोनॉक्साइड आणि लोह यांचा संबंध वातावरणाच्या तापमानापासून २५०० सें. या तापमान मर्यादेत येतो तेव्हा ते तयार होते. १९०८ च्या सुमारास माँड यांनी कोबाल्ट कार्बोनिल, मॉलिब्डेनम कार्बोनिल व रूथेनियम कार्बोनिल ही संयुगे तयार केली.
तयार करण्याच्या पद्धती : कार्बन मोनॉक्साइडबरोबर धातूंची सरळ विक्रिया करून कार्बोनिले तयार करतात. क्रोमियम, ऱ्हीनियम, ऑस्मियम व इरिडियम धातू मात्र त्याला अपवाद आहेत. सरळ संश्लेषणात (कृत्रिम रीत्या तयार करण्यात) जेथे एकाच धातूची अनेक कार्बोनिले बनतात तेथे सर्वांत जास्त कार्बन मोनॉक्साइड असलेले कार्बोनिल तयार होते व नंतर त्यापासून विक्रिया होऊन नीच कार्बोनिले बनविली जातात. सरळ संश्लेषण करताना धातू सूक्ष्मकणी व त्याचे पृष्ठभाग विशेष संस्कार करून क्रियाशील बनविलेले असणे क्षेयस्कर असते. दाब वाढविला असता उतारा वाढतो. फक्त निकेल व लोह यांची संयुगे सामान्य वातावरण दाबात बनतात, परंतु सामान्यत: तापमान ५०० से. ते २००० से. व दाब १०० ते ४०० वातावरण दाब इतका ठेवावा लागतो. बहुतेक सर्व कार्बोनिले, कार्बन मोनॉक्साइडाची विक्रिया उच्च तापमानाला चांदी व तांबे यांच्या अस्तित्वात त्या त्या धातू किंवा त्यांची ऑक्साइडे, सल्फाइडे किंवा इतर लवणे यांवर करून तयार करतात. उदा.,
(१) Fe + 5 CO → Fe (CO)5
(२) 2 CoO + 10 CO → Co2 (CO)8 + 2 CO2
काही ज्ञात धातु – कार्बोनिले व त्यांचे गुणधर्म
|
आवर्त सारणी गट क्रमांक |
धातू व त्याचा अणुक्रमांक |
कार्बोनिल |
रंग |
वितळबिंदू (०से.) |
उकळबिंदू (०से.) |
|
६. |
क्रोमियम (२४) |
Cr (CO)6 |
रंगहीन |
१४५⋅७ |
— |
|
|
मॉलिब्डेनम (४२) |
Mo (CO)6 |
रंगहीन |
१५६⋅३ (संप्लवन) |
— |
|
|
टंगस्टन (७४) |
W (CO)6 |
रंगहीन |
१७५ (संप्लवन) |
— |
|
७. |
मँगॅनीज (२५) |
Mn2(CO)10 |
सोनेरी पिवळे |
१५४ |
— |
|
|
ऱ्हीनियम (७५) |
Re2 (CO)10 |
रंगहीन |
१७७ (संप्लवन) |
— |
|
८. |
लोह (२६) |
Fe (CO)5 |
पिवळे |
–२० |
१०३ |
|
|
|
Fe2 (CO)9 |
पिवळे |
१०० (अपघटन) |
— |
|
|
|
Fe3 (CO)12 |
हिरवे |
१०० (अपघटन) |
— |
|
|
कोबाल्ट (२७) |
Co2 (CO)8 |
नारिंगी |
५० |
— |
|
|
|
Co4 (CO)12 |
काळे |
६० |
— |
|
|
निकेल (२८) |
Ni (CO)4 |
रंगहीन |
२५ |
४६ |
|
|
रूथेनियम (४४) |
Ru (CO)5 |
रंगहीन |
–२२ |
— |
|
|
|
Ru (CO)9 |
नारिंगी |
— |
— |
|
|
|
Ru3 (CO)12 |
हिरवे |
— |
— |
|
|
ऱ्होडियम (४५) |
Rh2 (CO)8 |
नारिंगी |
७६ (अपघटन) |
— |
|
|
|
[Rh (CO)3]n |
तांबडे |
— |
— |
|
|
|
[Rh4 (CO)11]m |
काळे |
— |
— |
|
|
ऑस्मियम (७६) |
Os (CO)5 |
रंगहीन |
–१५ |
— |
|
|
|
Os2 (CO)9 |
चकचकीत |
|
|
|
|
|
|
पिवळे |
२२४ |
|
|
|
इरिडियम (७७) |
Ir2 (CO)8 [ IR (CO)3]n |
पिवळट हिरवे कँनरी पिवळे |
— २१० (अपघटन) |
— — |
(अपघटन म्हणजे घटक द्रव्ये अलग होणे. संप्लवन म्हणजे घनस्थितीतून एकदम वायुस्थितीत रूपांतर होणे.)
गुणधर्म : कार्बोनिलांचे काही भौतिक गुणधर्म कोष्टकात दिलेलेच आहेत. लोहाचे व निकेलाचे कार्बोनिल सर्वसाधारण तापमानाला द्रवरूप असतात. इतर स्फटिकी व घनरूप आहेत. सामान्यत: ती १६०० से. तापमानाखाली वितळतात किंवा अपघटन पावतात. पण नीच तापमान व नीच दाबाखाली त्यांचे बाष्पीभवन होते. ती अत्यंत विषारी, प्रतिचुंबकीय (चुंबकीय पार्यता निर्वातापेक्षा कमी असलेली), पाण्यात अविद्राव्य (विरघळत नाही) पण कार्बनी विद्रावकांत (विघळविणाऱ्या पदार्थांत) विद्राव्य असतात. हॅलोजने, अमाइने, क्षारक (अम्लाशी विक्रिया झाल्यास लवणे देणारी संयुगे), क्षार धातू, सायनाइडे व ॲरोमॅटिक संयुगे यांच्याबरोबर कार्बोनिलाची विक्रिया होऊन कार्बोनिल गटाच्या जागी ती ती मूलके (रासायनिक विक्रियांत स्थिर राहणारे पण सामान्यत: स्वतंत्र अस्तित्व नसणारे अणुगट) येतात. कार्बोनिल तापविले असता किंवा प्रकाशाच्या सान्निध्यात त्यातील CO गट निघून जातो. धातूंची कार्बोनिल-हायड्राइडे ही त्यांची अम्ले होत. त्या अम्लांची लवणे माहीत आहेत. आयर्न कार्बोनिलाचे आयनी अपघटन (विद्युत् भारित अणू, रेणू व अणुगट यांच्या म्हणजे आयनांच्या रूपात घटक अलग होणे) हायड्रोजन सल्फाइडासारखे होते तर कोबाल्ट कार्बोनिलाचे आयनी अपघटन हायड्रोक्लोरिक अम्लासारखे होते. आल्फेट व्हर्नर यांनी कार्बोनिलासाठी स्वतंत्र सूत्र सुचविले आहे. या सूत्रात मध्यभागी धातु-मूलक असून कार्बोनिल गट त्याला जोडलेले दाखविले जातात. उदा., निकेल कार्बोनिल.
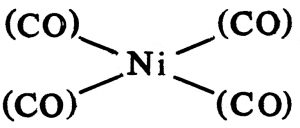
उपयोग : धातु-कार्बोनिलांचे उपयोग धातू तयार करण्यासाठी व ती शुद्ध करण्यासाठी करतात. आयर्न पेंटाकार्बोनिलाचे अपघटन करून लोखंडाची भुकटी मिळते. तिचा उपयोग इलेक्ट्रॉनीय उद्योगात होतो. चूर्ण धातुविज्ञानातही (चूर्णरूप धातूवर साच्यात दाब देऊन विविध आकाराच्या वस्तू तयार करण्याच्या क्रियेतही) ती वापरली जाते. कार्बन मोनॉक्साइडाने निकेलाचे धातुक (कच्ची धातू) निष्कर्षित केले जाते व त्यापासून कार्बन मोनॉक्साइडानेच निकेल कार्बोनिल बनते. निकेल कार्बोनिलाचे अपघटन होऊन ९९.८% शुद्ध निकेल मिळविता येते. धातूंच्या कार्बोनिलाचे उष्ण पृष्ठभागावर अपघटन होऊन छिद्रे नसलेली धातूची फिल्म (पापुद्रा) मिळते. काही धातु-कार्बोनिले एंजिनांच्या इंधनात मिसळल्यामुळे त्यांना आघात-रोधी गुणधर्म येतो. समावेशित (इतर अणू वा अणुगट सामावून घेतलेल्या) संयुगापासून प्रतिष्ठापित (एक अणू वा अणुगट काढून तेथे दुसरा अणू वा अणुगट बसविलेल्या) संयुगापर्यंत कार्बोनिलाचे रासायनिक गुणधर्म अतिव्यापक आहेत.
संदर्भ : Partington, J. R. General and Inorganic Chemistry, New York, 1966.
कारेकर, न. वि.