वायूंचे द्रवीकरण: द्रवामधील रेणू परस्परांमधील आकर्षण प्रेरणांमुळे निकटपणे बद्ध असतात. याउलट वायूमधील रेणू परस्परांपासून बरेच दूर असतात व त्यामुळे त्यांचे हालचाल करण्याचे स्वांतंत्र्य अबाधित राहते. वायुचे द्रवीकरण घडून येण्यासाठी त्यातील रेणूंच्या आकर्षण प्रेरणांनी त्यांच्या गतिज ऊर्जेवर मात करणे आवश्यक असते. हे साध्य करण्यासाठी वायूवरील दाब वाढविणे किंवा त्याचे शीतन करणे हे मार्ग आहेत. दाब वाढविल्याने रेणू परस्परांच्या अधिक निकट येतात व आकर्षण प्रेरणा वाढतात. शीतनाने रेणूंची गतिज ऊर्जा कमी होते. द्रवीकृत वायूंचे उद्योगांत व वैज्ञानिक संशोधनात अनेक महत्त्वाचे उपयोग होतात.
मायकेल फॅराडे यांनी वायूंच्या द्रवीकरणाचा प्रथम पद्धतशीर अभ्यास केला. १८२३ मध्ये त्यांनी क्लोरीन वायूचे द्रवात रूपांतर करण्यात यश मिळविले. याकरिता त्यांनी केलेल्या प्रयोगाचे स्वरूप साधारणपणे पुढीलप्रमाणे होते : ज्या पदार्थाला उष्णता दिली असता त्यापासून क्लोरीन वायू निर्माण होईल असा पदार्थ एका वक्र नळीच्या एका टोकास ठेवलेला होता. नळीची दोन्ही टोके बंद करून दुसरे टोक शीतकारी मिश्रणात बुडविलेले होते. पदार्थाला उष्णता दिल्यावर क्लोरीन वायू निर्माण झाला. जास्त वायू निर्माण झाल्यावर त्याचा दाब वाढला व त्यामुळे नळीच्या थंड भागात त्या वायूचे द्रवात रूपांतर झाले. फॅराडे यांनी नंतरच्या प्रयोगांत वातावरणीय दाबाच्या ५० पटींपर्यंत दाब वापरला आणि त्या काळी ज्ञात असलेल्या बहुतेक वायूंचेद्रवीकरण केले. परंतु नंतरच्या शास्त्रज्ञांनी ऑक्सिजन, नायट्रोजन, हायड्रोजन, कार्बन डाय-ऑक्साइड यांसारख्या वायूंवर ३,००० वातावरणाइतका दाब देऊनही त्यांचे द्रवात रूपांतर होऊ शकले नाही व यामुळे त्यांना नित्य वायू अशी संज्ञा दिली गेली.
या नित्य वायूंच्या द्रवीकरणाचे प्रयोग अयशस्वी होण्याचे कारण १८६३ मध्ये टॉमस अँड्रूज यांनी कार्बन डाय-ऑक्साइड वायूच्या द्रवीकरणासंबंधी केलेल्या प्रयोगामुळे स्पष्ट झाले. कार्बन डाय-ऑक्साइड वायू वेगेवेगळ्या तापमानांना ठेवून त्याचे घनफळ व दाब यांच्यामधील परस्पर संबंधाचा त्यांनी अभ्यास केला. त्यावरून त्यांनी असे सिद्ध केले की, प्रत्येक वायूच्या बाबतीत एका विशिष्ट तापमानाखाली जर त्याचे तापमान असेल, तरच त्याच्यावरील दाब पुरेसा वाढवून त्या वायूंचे द्रवात रुपांतर होऊ शकते. पण जर त्या वायूचे तापमान या विशिष्ट तापमानापेक्षा जास्त असेल, तर त्यावर कितीही दाब दिला, तरी त्याचे द्रवात रूपांतर होऊ शकत नाही. या विशिष्ट तापमानाला अँड्रूज यांनी ‘क्रांतिक तापमान’ अशी संज्ञा दिली. कार्बन डाय-ऑक्साइड वायूच्या बाबतीत क्रांतिक तापमान सु. ३१० से. असते.
द्रवीकरणाची मूलभूत तत्त्वे : तथाकथित नित्य वायूंच्या बाबतीत क्रांतिक तापमान अतिशय नीच असल्याने त्यांचे द्रवीकरण म्हणजे प्रशीतनाचीच एक समस्या होते. याकरिता वायूतील उष्णता काढून घेणे व त्यासाठी यांत्रिक कामे करणे जरूरीचे असते. एखाद्या विशिष्ट वायूच्या दिलेल्या राशीचे द्रवीकरण करण्याकरिता कराव्या लागणाऱ्या किमान कार्याचे परिगणन करता येते आणि मग विविध द्रवीकरण प्रक्रियांच्या कार्यमानांची या आदर्श कार्यक्षमतेशी तुलना करता येते.
वेगळ्या प्रशीतनक एंजिनाचा वा शीत साठ्याचा उपयोग न करता वायूचे शीतन करण्याचे दोन मार्ग आहेत. पहिल्या प्रकारात बाह्य प्रे रणांविरूद्ध कार्य करून रेणू आपली ऊर्जा गमावतात उदा., गतिशील दट्टयाने बंद केलेल्या सिलिंडरात प्रसरण पावून केलेले कार्य. दुसरा प्रकार एका पात्रात ठेवलेल्या उच्च दाबाखालील वायूला एका सच्छिद्र गुडदीच्या वा बुचाच्या द्वारे निम्न दाबाखाली असलेल्या पात्रात प्रसरण पावण्याची मुभा दिल्याने त्यातील रेणू परस्परांपासून दूर जाण्याच्या क्रियेवर (यामुळे कार्य घडून येऊन गतिज ऊर्जा गमावली जाते) अवलंबून आहे. हायड्रोजन व हीलियम यांचा अपवाद सोडल्यास बाकी सर्व वायूंच्या बाबतीत अशा प्रकारच्या प्रसरणामुळे तापमान उतरते [यालाच जूल-टॉमसन परिणाम म्हणतात ⟶ नीच तापमान भौतिकी]. हायड्रोजन व हीलियम यांच्या बाबतीत मात्र अशा प्रसरणामुळे तापमान वाढते. यात होणारा तापमान बदल दिलेल्या वायूकरिता व दिलेल्या दाबपाताकरिता उच्च तापमानांसाठी कमी होत जातो. उदा., २०० वातावरण दाबापासून एक वातावरण दाबापर्यंत १५० से. ला हवेचे प्रसरण केल्यास तापमान बदल ३९० होतो, तर १००० से. ला तो फक्त २०० होतो. जूल-टॉमसन परिणामामुळे होणारे शीतन सामान्यतः फारच अल्प असते. वायूचे मूळचे तापमान जितके कमी असेल, तितके प्रसरणामुळे त्याचे शीतन जास्त होते. वायू एका विशिष्ट मूळ तापमानाला ठेवून त्याचे मुक्त प्रसरण केल्यास त्याचे तापमान कमी व जास्तही होत नाही, असे आढळल्यास त्या विशिष्ट तापमानाला त्या वायूचे ‘पर्यसन तापमान’ म्हणतात. हायड्रोजनाकरिता पर्यसन तापमान सु. १९०० के., तर हीलियमाकरिता सु. ३०० के. आहे. मुक्त प्रसरण करतांना वायूंचे मूळचे तापमान पर्यसन तापमानापेक्षा कमी असेल, तर त्या वायूचे तापमान प्रसरणांमुळे उतरते पण मूळ तापमान पर्यसन तापमानापेक्षा जास्त असेल, तर प्रसरणामुळे त्याच्या तापमानात अल्पशी वाढ होते. जूल-टॉमसन परिणामाचा द्रवीकरण प्रक्रियेत उपयोग करण्यासाठी वायूचे प्रथम त्याच्या पर्यसन तापमानाखाली शीतन करणे आवश्यक ठरते. मात्र पर्यसन तापमान क्रांतिक तापमानापेक्षा पुष्कळच उच्च असते.
द्रवीकरण पद्धती : ऑक्सिजन या नित्य वायूचे द्रवीकरण करण्यात यश आल्याचे फ्रान्समधील एल्. पी. कायते व स्वित्झर्लंडमधील आर्. पिकटे यांनी १८७७ मध्ये जवळजवळ एकाच वेळी जाहीर केले. कायते यांनी जाड भिंती असलेल्या काचेच्या नळीवर पाऱ्याच्या साहाय्याने २०० वातावरण दाबाने ऑक्सिजन संपीडित (संकोचित) केला व प्रसरणानंतर द्रवरूप ऑक्सिजनाचे थेंब असलेले धुके काही सेकंद आढळून आले. बाह्य कार्याने प्रसरण करून वायूचे द्रवीकरण करण्याचे हे उदाहरण आहे. पिक्टे यांच्या प्रयोगात टप्प्यांच्या पद्धतीने (या पद्धतीचे वर्णन पुढे दिले आहे) प्रारंभिक शीतन करून मग जूल टॉमसन प्रसरणाने ऑक्सिजनाचे द्रवीकरण करण्यात आले होते. त्यांनी प्रथम सल्फर डाय- ऑक्साइड वायूचे कोठी (सर्वसाधारण) तापमानाला दाब देऊन द्रवीकरण केले. दाब कमी केल्यावर तो उकळू लागला व या क्रियेत त्याचे तापमान-६०० से. इतके उतरले. या तापमानाला कार्बन डाय- ऑक्साइडाचे दाबाखाली द्रवीकरण करण्यात आले. कार्बन डाय-ऑक्साइडाचे निर्वातात बाष्पीभवन करून ३०० वातावरण दाबाखाली असलेल्या ऑक्सिजनाने भरलेले पात्र -११०० से. इतक्या तापमानापर्यंत थंड करण्यात आले.या ऑक्सिजनाचे नेहमीच्या वातावरणीय दाबात सूची झडपेतून प्रसरण केल्यावर द्रवरूप ऑक्सिजना चा फवारा बाहेर पडला. काही वर्षानंतर झेड्. फोन व्हरूव्लेफस्की व के. एस्. ओल्झेफस्की यांनी भौतिक गुणधर्म निर्धारित करण्याइतपत पुरेशा प्रमाणात विविध द्रवीकृत वायू मिळविले.
एकोणिसाव्या शतकाच्या अखेरीस वायूंच्या द्रवीकरणात महत्त्वाची प्रगती झाली. १८९५ मध्ये कार्ल फोन लिंडे यांनी मोठ्या प्रमाणात द्रवीभूत हवा तयार केली, १८९८ मध्ये जेम्स देवार (ड्युअर) यांनी हायड्रोजनाचे व १९०८ मध्ये एच्. कामर्लिंग-ऑनेस यांनी हीलियमाचे द्रवीकरण केले. ही इतकी मोठी प्रगती होण्याचे कारण म्हणजे लिंडे व विल्यम हॅम्पसन यांनी द्रवीकारक उपकरणात प्रवेश करणारा गरम वायू त्यातून बाहेर जाणाऱ्या वायूने वा बाष्पाने थंड करणारा उष्णता विनिमयक किंवा पुनर्जनक प्रचारात आणला. उष्णता विनिमयकामुळे शीतता वाया जात नाही आणि जी शीतन प्रक्रिया द्रवीकरण करण्यास स्वतः पुरेशी नसेल तिचे विवर्धन करण्यासाठी तो उपयुक्त ठरतो.
सर्वांत साधा उष्णता विनिमयक धातूच्या दोन एककेंद्री नलिकांचा (या नलिका बहुधा वेटोळ्यांच्या स्वरूपात असतात) बनलेला असून त्यांतील वायू परस्परांच्या विरूद्ध दिशेने वाहतात. उष्णता संक्रमण करणारा पृष्ठभाग वाढवून (उदा., एकाच आतील नलिकेऐवजी नलिकांचा एक जुडगा वापरून) अधिक कार्यक्षम उष्णता विनिमय साधता येतो. [⟶ उष्णता विनिमयक].
पुनर्जनकामध्ये (याला शीत-संचायक असेही म्हणतात) दोन वायू वेगवेगळ्या पात्रांतून वाहतात. या पात्रात बहुधा अल्युमिनियमाच्या पन्हाळी पत्र्याच्या पट्टया भरलेल्या असतात. वायू प्रवाहांची ठराविक वेळाने अदलाबदल करण्यात येते. प्रत्येक पात्राची उष्णता धारिता (तापमान १० से. मधून वाढविण्यास द्यावी लागणारी उष्णता) मोठी असते व त्याचा वायू प्रवाहाबरोबरील उष्णता विनिमयही चांगला होतो. यामुळे प्रत्येक पात्र पाळीपाळीने एका प्रवाहाकडून मिळणारी शीतता साठविते आणि ती दुसऱ्या पात्राला परत देते. पुनर्जनकाचा शुद्धकारक म्हणूनही उपयोग होतो. आत येणाऱ्या वायूतील सहजपणे संघनित होणाऱ्या अशुद्धी एका पाळीत निक्षेपित होतात (साखा रूपाने जमा होतात) व पुढच्या पाळीत काढून टाकल्या जातात.
हवेचे द्रवीकरण : हवेचे द्रवीकरण करण्यापूर्वी तिच्यातील पाण्याची वाफ व कार्बन डाय- ऑक्साइड वायू काढून टाकणे जरूरीचे असते.नाही तर हे पदार्थ आधीच गोठून नलिकेतून जाण्याचा हवेचा मार्ग बंद करतात.
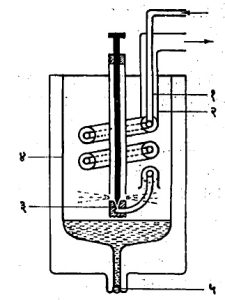
लिंडे प्रक्रिया : जर २०० वातावरण दाब व १५० से. तापमान असलेली हवा नियामक झडपेद्वारे एक वातावरण दाबाला प्रसरण पावली, तर ती-२४०से. इतक्या तापमानापर्यंत थंड होते. या प्रसरण पावलेल्या हवेला तिचे मूळ तापमान पुन्हा प्राप्त होण्यासाठी तिला तिची उष्णता धारिता गुणिले तापमान फरक(३९०) इतकी उष्णता द्यावी लागेल. याचाच अर्थ कोठी तापमानाला असलेली प्रत्येकी एक ग्रॅम हवा स्थिर तापमानाला २०० वातावरण दाबापासून एक वातावरण दाबात जाईपर्यंत बाह्य कार्य न करता Cp DT इतकी उष्णता शोषून घेते. येथे Cp ही एक वातावरण दाबाखाली स्थिर असलेल्या हवेची विशिष्ट उष्णता [⟶उष्णता] आहे व ΔT हा जूल-टॉमसन शीतनामुळे होणारा तापमान बदल आहे. हा शीतन परिणाम अल्प असला, तरी उष्णता विनिमयकाच्या साहाय्याने हवेच्या द्रवीकरणासाठी त्याचा उपयोग करता येतो. आ. १ मध्ये दाखविलेल्या लिंडे-हॅम्पसन हवा द्रवीकारक उपकरणात जूल-टॉमसन शीतनाचा अशा प्रकारे उपयोग करण्यात येतो. यातील (१) व (२) या नलिकांनी उष्णता विनिमयक बनतो. (३) ही प्रसरण झडप असून सर्व उपकरण (४) या उष्णता-निरोधित पात्रात ठेवलेले असते. २०० वातावरण दाबाला संपीडीत केलेली व कोठी तापमानाला असलेली हवा उपकरणात (१) या नलिकेद्वारे शिरते. ही हवा एक वातावरण दाब होईपर्यंत प्रसरण पावते व थंड होते आणि शेवटी (२) या नलिकेतून कोठी तापमानाला बाहेर पडते. समग्र उपकरणातून (म्हणजे ते ज्या धातूचे बनविलेले आहे ती धातू व त्यात असलेली हवा यांतून मिळून) होणारा उष्णता व्यय त्यातून जाणाऱ्या प्रत्येक ग्रॅम हवेकरिता Cp ΔTकॅलरी या दराने होतो. झडपेचे तापमान क्रमाक्रमाने उतरत जाते व शेवटी हवेचा काही भाग प्रसरण पावल्यावर द्रवीकृत होतो. मग तापमान स्थिर राहते व उपकरणात प्रवेश करणाऱ्या हवेचा काही अंश तेथेच द्रवरूपात राहतो. ही द्रवरूप हवा (५) या अटक झडपेतून काढून घेता येते. द्रवीकरणाने प्राप्त होणारा द्रवीकृत हवेचा उतारा हा उपकरणात हवा प्रवेश करताना असलेल्या तिच्या तापमानाला निर्माण होणारा जूल-टॉमसन परिणाम ΔT यावरून निर्धारित होतो. या उताऱ्यावर उपकरणातील दाब व तापमान यांच्या वितरणाचा अथवा झडपेपाशी उद्भवणाऱ्या प्रत्यक्ष तापमानाचा परिणाम होत नाही. १५० से. तापमानाला आणि २०० वातावरण दाबाखाली असलेल्या एका किग्रॅ. हवेपासून प्रारंभ केल्यास लिंडे द्रवीकारक उपकरणातून द्रवीकृत हवेचा ०.०९५ किग्रॅ. म्हणजे झडपेतून जाणाऱ्या हवेच्या सु. १०% उतारा मिळतो. उतरत्या तापमानाबरोबर जूल-टॉमसन परिणाम जलद वाढत जातो. जर उपकरणात शिरण्यापूर्वी हवेचे अमोनिया प्रशीतकाने -४५० से. पर्यंत शीतन केले, तर उतारा ०.१९ %पर्यंत वाढतो.
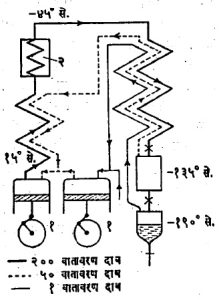
द्रविकारक उपकरणाची कार्यक्षमता वायूच्या दिलेल्या राशीचे द्रवीकरण करण्यासाठी कराव्या लागणाऱ्या यांत्रिक कार्याने मोजली जाते. पूर्वशीतनाची योजना नसलेल्या साध्या लिंडे द्रवीकारक उपकरणाकरिता फक्त संपीडक चालविण्यासाठी शक्ति आवश्यक असते. एक लिटर (०.८६किग्रॅ) द्रवीकृत हवा निर्माण करण्यासाठी ९ किग्रॅं वायुरूप हवा एक वातावरण दाबापासून २०० वातावरण दाबापर्यंत संपीडित करावी लागते. समतापी (एकाच तापमानाला) संपीडन गृहीत धरल्यास याकरिता १.१० किलो वॉट-तास (किवॉ. ता.) शक्ती लागते. आदर्श व व्युत्क्रमी प्रक्रियेने एक लिटर द्रवीकृत हवा निर्माण करण्यासाठी फक्त ०.१७ किवॉ. ता. शक्ती लागते. पूर्वशीतनाने प्रक्रियेची कार्यक्षमता वाढते. उच्च उताऱ्यामुळे संपीडित करावयाची वायुराशी कमी असते. याखेरीज अमोनिया प्रशीतकाला थोडीच शक्ति लागते व त्यामुळे एकूण शक्ति वापर ०.५५ किवॉ. ता./लि. इतका कमी होतो. एकाच टप्प्यात एक वातावरण दाबापर्यंत प्रसरण करण्या ऐवजी प्रथम एखाद्या मध्यम दाबाला प्रसरण केल्यासही कार्यक्षमता वाढते. सामान्यतः पहिल्या टप्प्यात २०० वातावरण दाबापासून ५० वातावरण दाबा-पर्यंत प्रसरण करतात. यातील ८०% हवा एका उष्णता विनिमयकामधून संपीडकाकडे परत पाठवितात व राहिलेल्या हवेचे एक वातावरण दाबापर्यंत प्रसरण करतात. या हवेचे अंशतः द्रवीकरण होते. या पद्धतीत ०.६ किवॉ. ता./लि. शक्ति वापर होतो. असे उच्च दाब मंडल व अमोनिया प्रशीतन यांचा संयोग केल्यास (आ.२) शक्तिचा वापर ०.३६ किवॉ. ता./लि. इतका कमी होतो.
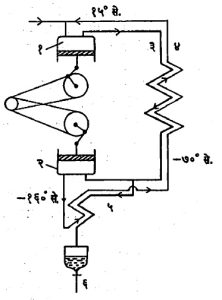
क्लोद प्रक्रिया: १९०२ मध्ये जी. क्लोद यांनी द्रवरूप हवा मोठ्या प्रमाणावर निर्माण करण्यासाठी सतत चालणारे पश्च-अग्र गतीचे प्रसरण एंजिन विकसित केले (आ.३). ४० वातावरण दाब आणि कोठी तापमान असलेली हवा (३) या नलिकेतून उपकरणात शिरते. (३) व (४) या नलिका मिळून उष्णता विनिमयक बनतो. या हवेचे प्रसरणकारकातील (प्रसरण एंजिनातील) सिलिंडरामध्ये एक वातावरण दाबापर्यंत प्रसरण होते, ती सिलिंडराच्या भिंतींना थंड करते व मग (४) या नलिकेतून बाहेर जाते. सिलिंडरात हवेचे द्रवीकरण होण्याचे टाळण्यासाठी ४० वातावरण दाबाखालील हवा उष्णता विनिमयकात सु. -७०० से. पर्यंत थंड झाल्यावर तिचे दोन अंशांत विभाजन केले जाते. प्रमुख अंशाचे सिलिंडरात प्रसरण होऊन त्याचे तापमान-१६०० से. पर्यंत उतरते. पूर्वशीतीत उच्च दाबाखालील हवेचा राहिलेला अंश (५) या नलिकेतून जातो व प्रसरण पावलेल्या हवेने त्याचे द्रवीकरण होते. (६) या अटक झडपेद्वारे द्रवीकृत हवा काढून घेता येते. या प्रक्रियेत ४० वातावरण दाबापासून ७ वातावरण दाबापर्यंत व मग ७ वातावरण दाबापासून एक वातावरण दाबापर्यंत अशा दोन क्रमागत टप्प्यांत प्रसरण क्रिया केली, तर तिची कार्यक्षमता वाढते. इतक्या नीच तापमानात येणाऱ्या वंगणासंबंधीच्या अडचणी सोडविण्यासाठी क्लोद यांनी पेंटेन किंवा वंगण न दिलेली कातडी दट्ट्या कडी वापरली. क्लोदहेलांत द्रवीकारक उपकरणात प्रसरणकारक एंजिनाने पूर्वशीतित केलेली हवा वापरणाऱ्या लिंडे उपकरणाचा उपयोग करतात. हे उपकरण सापेक्षतः उच्च तापमानाला कार्य करते व त्यात साधी वंगणे वापरता येतात, हा त्याचा फायदा आहे. क्लोद व क्लोद-हेलांत या दोन्ही प्रक्रियांचा परिगणन केलेला शक्ती वापर साधारण सारखाच म्हणजेच ०.२८ किवॉ. ता./लि. आहे, अशा प्रकारे सैद्धांतिक दृष्ट्या क्लोद प्रक्रिया लिंडे प्रक्रियेपेक्षा जास्त कार्यक्षम आहे. लिंडे प्रक्रियेत प्रसरण झडपेतून बाहेर पडणाऱ्या झोताच्या गतिज ऊर्जेचे घर्षणामुळे पुन्हा उष्णतेत रूपांतर होते. या प्रक्रियेत कोणतेच बाह्य कार्य केले जात नाही व शीतन पूर्णपणे अंतर्गत कार्यामुळे घडून येते. याउलट क्लोद व क्लोद-हेलांत प्रक्रिया शीतनासाठी मुख्यत्वे बाह्य कार्यांवर अवलंबून आहेत आणि त्या आदर्श व्युत्क्रमी प्रक्रियेच्या अधिक निकटवर्ती जातात.
टरबाइन प्रक्रिया: दट्ट्यायुक्त एंजिन वापरण्याऐवजी टरबाइनाचा उपयोग करणे शक्य आहे, असे लॉर्ड रॅली यांनी प्रथम सुचविले होते. हवेचे द्रवीकरण करण्यासठी टर्बो-प्रसरणका रकांचा समावेश करणारी उपकरणे जर्मनीत लिंडे कंपनीने व रशियात पी. एल्. काप्यिट्स यांनी मुख्यत्वे हवेतील घटक अलग करणाऱ्या मोठ्या संयंत्रात उपयोग करण्यासाठी विकसित केली.
टप्प्यांची प्रक्रिया : एखाद्या वायूचे तापमान क्रांतिक तापामानाहून कमी करून व त्यावरील दाब पुरेसा वाढवून त्याचे द्रवात रूपांतर करता येते, या तत्त्वाचा या प्रक्रियेत उपयोग केलेला आहे. तापमान कमी करण्याचे कार्य पायरीपायरीने निरनिराळ्या द्रवरूप पदार्थांचा उपयोग करून केले जात असल्याने या प्रक्रियेला टप्प्यांची प्रक्रिया म्हणतात. प्रारंभी दिलेली पिक्टे यांची टप्प्यांची प्रक्रिया ऑक्सिजनाचे वा हवेचे मोठ्या प्रमाणावर द्रवीकरण करण्यासाठीही वापरता येते. यात कोठी तापमान व ऑक्सिजनाचे क्रांतिक तापमान यांतील अंतर भरून काढण्यासाठी मिथिल क्लोराइड व एथिलिन यांचा उपयोग करतात.
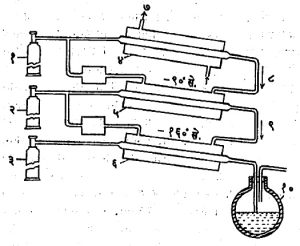
कामर्लिंग-ऑनेस यांनी एक अतिशय कार्यक्षम असे टप्प्यांचे उपकरण विकसित केले (आ.४). त्यात(४), (५) व (६) हे संपीडक एकसरीत जोडलेले असून ते (१), (२) व (३) या पंपानी चालविले जातात. संपीडक (४) हा मिथील क्लोराइडाचे कोठी तापमानाला चार वातावरण दाबात द्रवीकरण करण्यासाठी वापरतात. वायूचे तापमान कोठी तापमानाला आणण्यासाठी संपीडकाभोवतील वेष्टनातून वाहणाऱ्या पाण्याच्या प्रवाहाचा उपयोग करतात. द्रवरूप मिथिल क्लोराइड संपीडकाभोवतील वेष्टनातून वाहू देतात, हे वेष्टन (१) या पंपाच्या चोषण बाजूला जोडलेले असल्याने द्रवरूप मिथिल क्लोराइड निम्न दाबाला (सु. १/५० वातावरण दाबाला) उकळून-९०० से. तापमान निर्माण होते. मिथिल क्लोराइड बाष्प (१) या पंपाने (४) या संपीडकात परत जाते व त्यामुळे या वायूचा सतत प्रवाह चालू राहतो. (५) मधील एथिलीन वायु-९०० से. पर्यंत थंड होऊन त्याचे (२) या पंपाने सहा वातावरण दाबाखाली द्रवीकरण होते, मग द्रवरूप एथिलिनाचे निम्न दाबाखाली (६) या संपीडकाभोवतील वेष्टनात बाष्पीकरण करून तो पुन्हा (५) या संपीडकात नेतात. यामुळे (६) चे तापमान -१६०० से. पर्यंत उतरते. ऑक्सिजन (६) मध्ये (३) या पंपाने संपीडित करतात आणि निम्न तापमान (-१६०० से.) व उच्च दाब (२० वातावरण) यांच्या प्रभावामुळे त्याचे द्रवीकरण होऊन तो (१०) या देवार पात्रात जमा होतो. हा द्रवरूप ऑक्सिजन पुढील टप्पा म्हणून हवेच्या किंवा नायट्रोजनाच्या द्रवीकरणासाठी वापरता येतो. या प्रक्रियेचा शक्ति वापर साधारणपणे पूर्वशीतनयुक्त लिंडे द्रवीकरण उपकरणाइतकाच म्हणजे ०.६ किवॉ. ता./लि. असतो.
वर दिलेले कार्यक्षमतेचे सर्व आकडे सैद्धांतिक असून त्यात उष्णता निरोधक, उष्णता विनिमयक व संपीडक अथवा प्रसरण एंजिन यांतील अपरिहार्य दोष विचारात घेतलेले नाहीत.
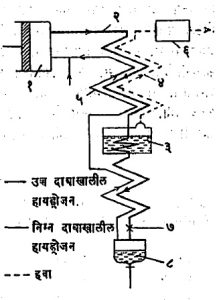
हायड्रोजनाचे द्रवीकरण : हायड्रोजनाचे क्रांतिक तापमान फक्त ३३०.२ के. आहे. कमी केलेल्या दाबात द्रवरूप हवेचे बाष्पीकरण करून मिळणाऱ्या किमान तापमानापेक्षा हे तापमान पुष्कळच कमी आहे. यामुळे हायड्रोजनाच्या बाबतीत द्रवीकरणाची टप्प्यांची पद्धत वापरता येत नाही. लिंडे प्रक्रिया वापरून हायड्रोजनाचे द्रवीकरण करण्यात १८९८ मध्ये देवार यांना यश मिळाले आणि तेव्हापासून हीच प्रक्रिया याकरिता वापरण्यात येत आहे. हायड्रोजनाचे कोठी तापमानाला प्रसरण केल्यास त्याचे तापन होते. यामुळे द्रवरूप हवेने हायड्रोजन वायूचे त्याच्या पर्यसन तापमानाखाली पूर्वशीतन करतात. आ.५ मध्ये हायड्रोजन वायूच्या द्रवीकारक उपकरणाची मांडणी दाखविली आहे. यात हायड्रोजन १८० वातावरण दाबाखाली (२) या नलिकेद्वारे उपकरणात शिरतो व त्याचे (३) या पात्रात कमी केलेल्या दाबाखाली उकळणाऱ्या द्रवरूप हवेमुळे शीतन होते. (३) या पात्रातील थंड बाष्प (४) या नलिकेतून उपकरणाच्या बाहेर जाते. नलिका (४) द्रवीकरण न झालेल्या हायड्रोजनाचा अंश वाहून नेणारी नलिका (५) व वायुरूप हायड्रोजन वाहून आणणारी नलिका (२) यांनी मिळून (२) मधील उच्च दाबाखालील हायड्रोजनाचे पूर्वशीतन करणारा उष्णता विनिमयक बनतो. हा हायड्रोजन मग दुसऱ्या एका उष्णता विनिमयकात शिरतो व प्रसरण झडपेतून गेल्यावर त्याचे अंशतः द्रवीकरण होते. मिळणाऱ्या द्रवरूप वायूचे प्रमाण मुख्यत्वे (२) या नलिकेच्या तापमानावर अवलंबून असते. जर हायड्रोजन दुसऱ्या उष्णता विनिमयकात द्रवरूप हवेच्या नेहमीच्या उकळबिंदू तापमानाला शिरला, तर पर्याप्त दाब १८० वातावरणाइतका वापरून १७% उतारा मिळतो. परंतु पाऱ्याच्या २ सेंमी. स्तंभाइतक्या कमी केलेल्या दाबाखाली ६०० के. इतके पूर्वशीतन केल्यास उतारा ३३% इतका मिळतो. या प्रक्रियेने एक लिटर हायड्रोजन मिळविण्यासाठी २ किवॉ. ता. इतके कार्य करावे लागते. यापैकी निम्मे कार्य प्रत्येक लिटर हायड्रोजनाकरिता १ ते १.५ लिटर या दराने आवश्यक असलेल्या हवेच्या द्रवीकरणासाठी खर्च होते. वरील कार्याचे आदर्श मूल्य हे वरील मूल्याच्या सु १/१० म्हणजे ०.२३ किवॉ. ता./लि. इतके आहे.
हायड्रोजनाकिरता वापरण्यात येणाऱ्या लिंडे द्रवीकारक उपकरणांची कक्षा ही दर ताशी काही लिटर उत्पादन असणाऱ्या प्रयोगशाळेत वापरण्यात येणाऱ्या उपकरणांपासून ते दर ताशी कित्येकशे लिटर उत्पादन करणाऱ्या मोठ्या संयंत्रांपर्यंत आहे. याहून अधिक मोठ्या (३,००० लि./ता) संयंत्रांमध्ये पश्च-अग्र किंवा टर्बो प्रसरणकारकांचा उपयोग करतात. यामुळे शक्ति वापर द्रवरूप हायड्रोजनाच्या १ किवॉ. ता./लि. यापेक्षा काहीसा कमी होतो.
हवेच्या द्रवीकरणापेक्षा हायड्रोजना च्या द्रवीकरणासाठी शुद्धतेच्या अटी जास्त कडक असतात. जलबाष्प व कार्बन डाय-ऑक्साइड यांच्याखेरीज नायट्रोजन व ऑक्सिजन यांचाही पूर्णपणे निरास करणे आवश्यक असते. कारण येथे अंतर्भूत असलेल्या नीच तापमानाला त्यांचे घनीभवन होते. काप्यिट्स यांच्या उपकरण मांडणीत हायड्रोजनाच्या फक्त थोड्या राशीचे शुद्धीकरण करावे लागते. या द्रवरूप हायड्रोजनाचे एका लिंडे उपकरणात अभिसरण करण्यात येते व त्याचा उपयोग कित्येक टक्के अशुद्धी असली तरी चालू शकते अशा व्यापारी हायड्रोजनाच्या द्रवीकरणासाठी करण्यात येतो, कारण हा हायड्रोजन सूक्ष्म प्रसरण झडपेतून जात नाही.
हीलियमाचे द्रवीकरण : हीलियमाचा उकळबिंदू सर्व पदार्थांत नीच आहे. त्याचे क्रांतिक तापमान फक्त ५०.२ के. असून घनरूप हायड्रोजनाच्या साहाय्याने सु. ८० के. इतक्याच तापमानापर्यंत पोहोचता येते. यामुळे हीलियमाच्या द्रवीकरणासाठी टप्प्यांची प्रक्रिया वापरणे अशक्यच आहे. कामर्लिंग-ऑनेस यांनी १९०८ मध्ये हीलियमाच्या पर्यसन तापमानाच्या खाली तापमान नेण्यासाठी द्रवरूप हवा व द्रवरूप हायड्रोजन यांचा पूर्वशीतनासाठी वापर करून लिंडे प्रक्रिया उपयोगात आणली. उपकरणात प्रवेश करणाऱ्या वायूचा पर्याप्त दाब ३० वातावरणाइतका ठेवल्यास व १५० के. पर्यंत पूर्वशीतन केल्यास द्रवीकरण उतारा १५% मिळतो. या प्रक्रियेचा शक्ति वापर ६ किवॉ. ता./लि. असून तो ०.२३ किवॉ. ता./लि. या सैंद्धांतिक मूल्याच्या जवळजवळ २६ पट आहे. हीलियम द्रवीकारक उपकरणांच्या आकारमानाची कक्षा ताशी १०० लि. उत्पादन करणाऱ्या संयंत्रांपासून ते अर्ध्या तासात १०-२० घ. सेंमी. द्रवरूप हीलियम तयार करू शकणाऱ्या प्रयोगशाळेत वापरावयाच्या लहान उपकरणांपर्यंत आहे. क्लोद प्रक्रियेचा हीलियमाच्या द्रवीकरणासाठी वापर केल्यास द्रवरूप हवेच्या तापमानाचा किंवा कोठी तापमानाचाही प्रारंभाकरिता उपयोग करता येतो. यामुळे हायड्रोजन द्रवीकरणाच्या संयंत्राची जोड द्यावी लागत नाही. तसेच द्रव हायड्रोजन हाताळण्यातील स्फोटाचा धोका टळतो.
काप्यिट्स यांनी द्रवरूप नायट्रोजन कमी केलेल्या दाबाखाली उकळून ३० वातावरण दाबाखाली हीलियमाचे ७५० के. पर्यंत शीतन केले व मग क्लोद-हेलांत द्रवीकरणाचे तत्त्व वापरून हीलियमाच्या द्रवीकरण केले. यात हीलियमाच्या काही भागाचे एका सिलिंडरात दोन वातावरण दाबापर्यंत प्रसरण होऊन तो १०० के. पर्यंत थंड होतो. याच्या साहाय्याने हीलियमाच्या राहिलेल्या भागाचे पूर्वशीतन करतात व मग त्याचे नियामक झडपेतून प्रसरण करून अंशतः द्रवीकरण करतात. यात वायुची गळती अल्पशीच होईल इतक्या वेगाने प्रसरण धावेत गतिमान होणारा सैलसर दट्ट्या वापरून काप्यिट्स यांनी वंगणाचा प्रश्न सोडविला.त्यांनी सु. ४ किवॉ. ता./लि. शक्तिचा वापर करून ताशी १.७ लि. द्रवरूप हीलियम मिळविला.
एस्. सी. कॉलिन्स यानी विकसित केलेल्या प्रसरण द्रवीकारक उपकरणात दट्ट्याभोवतील गळती कमी करण्यासाठी कठीण नायट्रालॉय पोलादाचे घट्ट जुळणी होणारे दट्ट्या व सिलिंडर वापरले, या द्रवीकारक उपकरणात दोन प्रसरण एंजिने टप्पा पद्धतीने जोडलेली असून प्रत्यक्ष द्रवीकरण जूल-टॉमसन प्रसरणाने होते. व्यवहारात सामान्यतः वापरण्यात येणाऱ्या या पद्धतीच्या उपकरणात ताशी ६ लि. द्रवरूप हीलियम तयार होतो. आवश्यकता वाटल्यास नायट्रोजनाने करण्यात येणाऱ्या पूर्वशीतनाशिवाय हे उपकरण चालविता येते, पण त्यामुळे हीलियमाचे उत्पादन साधारण निम्म्यावर येते.
एफ्. ई. सायमन यांनी हीलियमाचे द्रवीकरण दट्ट्याच्या एकाच धावेत होणाऱ्या प्रसरणाने केले व त्याकरिता घनरूप हायड्रोजनाच्या तापमानापासून म्हणजे १२० के. पासून प्रारंभ केला. या पद्धतीने कायते यांच्या प्रयोगात द्रवरूप हवेचे फक्त त्वरीत नाहीसे होणारे धुके प्राप्त झाले होते पण हीलियमाच्या बाबतीत ही पद्धत परिणामकारक ठरण्याची अनेक कारणे आहेत. पहिले कारण म्हणजे साधारण तापमानाला पात्राची उष्णता धारिता वायुशी तुलना करीता मोठी असते पण अतिनीच तापमानांना घन पदार्थांची विशिष्ट उष्णता अतिशय कमी होते, तर वायूंची स्थिर राहते. १२० के. तापमानाला जाड भिंती असलेल्या कित्येक किग्रॅ. वजनाच्या तांब्याच्या पात्राची उष्णता धारिता त्यातील १५० वातावरण दाबाखालील हीलियम वायूच्या उष्णता धारितेच्या १% पेक्षाही कमी असते. यामुळे प्रसरणाने निर्माण होणारा शीतन परिणाम पात्राच्या शीतनामध्ये दुर्लक्षणीय प्रमाणातच वाया जातो. दुसरे कारण म्हणजे १२० के. तापमानाला असलेल्या वायुरुप हीलियमाच्या बाबतीत त्याच्या नेहमीच्या उकळबिंदू ला असणारी त्याची घनता मिळण्यासाठी ४० वातावरण दाब पुरेसा होतो, तर कोठी तापमानाला असलेल्या हवेची घनता द्रवरूप हवेइतकी होण्यासाठी ती ३,००० वातावरण दाबापर्यंत संपीडित करावी लागते. १२० के. तापमानाला व १५० वातावरण दाबाखाली असलेल्या हीलियमाचे त्याचा दाब एक वातावरण दाबापर्यंत कमी होईल इतके प्रसरण केले तर त्याचे घनफळ फक्त अडीच पट वाढते व तापमान ४०.२ के. पर्यंत उतरून ८०% वायू चे द्रवीकरण होते. या थोड्याशाच घनफळ बदलामुळे गतिमान दट्ट्याचा त्याग केला, तरी कार्यक्षमतेची फारच थोडी हानी होते. वायूचे कोठी तापमानालाठेवलेल्या झडपेतून प्रसरण केले जाते आणि पात्र त्याच्या ७०% घनफळापर्यंत द्रवरूप हीलियमाने भरले जाते.
सायमन यांनी टप्प्यांच्या तत्त्वाचाही हीलियमाच्या द्रवीकरणासाठी उपयोग केला. घनरूप हायड्रोजनाचे तापमान व हीलियमाचे क्रांतिक तापमान यांतील अंतर पार करण्यासाठी त्यांनी सक्रियित लोणारी कोळशावर [⟶ कार्बन, सक्रियित] काही थोड्या वातावरण दाबाखाली वायू अधिशोषित केला (पृष्ठभागावर शोषण केले). मग दाब कमी केला असता जसजसे हीलियमाचे विशोषण होते तसतसे कोळशाचे हीलियमाच्या क्रांतिक तापमानाच्या बऱ्याच खालीपर्यंत शीतन होते आणि काही हीलियमाचे वेगळ्या पात्रात द्रवीकरण होते.
द्रवीकृत वायूंचे गुणधर्म : काही महत्त्वाच्या द्रवीकृत वायूंचे भौतिक गुणधर्म कोष्टकात दिलेले आहेत.
|
द्रवीकृत वायूंचे भौतिक गुणधर्म |
||||
|
पदार्थ |
उकळबिंदू (०के) |
क्रांतिक तापमान (०के) |
क्रांतिक दाब (वातावरण) |
उकळबिंदूला द्रवाची घनता (ग्रॅ./सेंमी.३) |
|
मिथिल क्लोराइड (CH३ CL) |
२४९.१ |
३१६.२ |
६५.८ |
१.०१ |
|
अमोनिया (NH३ ) |
२३९.७ |
३०५.६ |
१११.५ |
०.६७ |
|
कार्बन डाय ऑक्साइड (CO2) |
१९४.७ |
३०४.३ |
७३.० |
१.६३ |
|
एथिलिन (C2 H4 ) |
१७०.३ |
२८२.९ |
५०.९ |
०.५७ |
|
ऑक्सिजन (O2) |
९०.२ |
१५४.३ |
४९.७ |
१.१५ |
|
नायट्रोजन (N2) |
७७.४ |
१२६.० |
३३.५ |
०.८१ |
|
हायड्रोजन(H2) |
२०.४ |
३३.२ |
१२.८ |
०.०७१ |
|
हीलियम (He) |
४.२२ |
५.२४ |
२.२६ |
०.१२५ |
कार्बन डाय-ऑक्साइड : एक वातावरण दाबाइतक्या बाष्प दाबाला कार्बन डाय-ऑक्साइड घनरूपात मिळतो. सिलिंडरातील संपीडित द्रवरूप कार्बन डाय-ऑक्साइड बाहेर सोडल्यास तो बारीक चूर्णाच्या रूपात तयार होतो. घन ठोकळ्यांच्या रूपात व्यापारात तो उपलब्ध असून सामान्यतः त्याला शुष्क बर्फ म्हणतात. [⟶ कार्बन डाय-ऑक्साइड].
ऑक्सिजन, नायट्रोजन व हवा : द्रवरूप ऑक्सिजन गर्द निळा, द्रवरूप नायट्रोजन रंगहीन व द्रवरूप हवा तिच्यातील ऑक्सिजनाच्या प्रमाणानुसार वेगवेगळ्या छटांची असते.त्रिक् बिंदूपाशी (एकाच पदार्थाच्या तीन निरनिराळ्या प्रावस्ता समतोलात सहअस्तित्वात राहू शकतात अशा विशिष्ट तापमान व दाब यांच्याशी) द्रवरूप नायट्रोजनाचा बाष्प दाब उच्च असल्याने त्याचे कमी केलेल्या ९ सेंमी. पाऱ्याच्या दाबाखाली सहजपणे घनीकरण करता येते.
हायड्रोजन: द्रवरूप हायड्रोजन रंगहीन असतो व त्याची घनता कमी असते. एक लिटर द्रवरूप हायड्रोजनाचे वजन फक्त ७० ग्रॅ. असते. वायुरूप हायड्रोजनाची घनता कमी असल्याने एक लिटर द्रव साधारण तापमान व दाब असतांना १,००० लिटर वायूच्या समान असतो, हा उपयुक्त नियम लागू पडतो. कमी केलेल्या दाबाखाली बाष्पीकरणाने हायड्रोजनाचे सहजपणे घनीकरण करता येते.[⟶ हायड्रोजन].
हीलियम : द्रवरूप हीलियमसुद्धा रंगहीन व कमी घनतेचा असतो. केवळ संपीडनाने त्याचे तापमान कमी करून घनीकरण करता येत नाही. २०.१९ के. तापमानाच्या खाली त्याचे शीतन केल्यास त्याचे अनेक विस्मयजनक गुणधर्म (उदा., अतिप्रवाहिता) आढळून येतात. या प्रकारचा द्रवरूप हीलियम व २0.१९ के. च्या वर अस्तित्त्वात असणारा द्रवरूप हीलियम यांत भेद करण्यासाठी त्याला हीलियम II असे म्हणतात. [⟶ नीच तापमान भौतिकी हीलियम].
द्रवीकृत वायूंची साठवण : द्रवीकृत वायू साठविण्याकरिता उत्तम उष्णता निरोधकाची आवश्यकता असते. याकरिता द्रवीकृत वायू ठेवलेल्या पात्राभोवती ⇨खनिज लोकर किंवा मॅग्नेशियम कार्बोनेटाचे चूर्ण यासारख्या उष्णतेच्या कुसंवाहक पदार्थांचे वेष्टन करतात अथवा ते पात्र सुपरिचित थर्मास किंवा देवार पात्राप्रमाणे उच्च निर्वात केलेल्या आवरणात ठेवतात. [⟶ थर्मास, निरोधन, औष्णिक]. द्रवरूप ऑक्सिजन किंवा हवा साठविण्याच्या पहिल्या प्रकारच्या टाक्यांची धारणक्षमता एक ते वीस टन असते. सर्वांत मोठ्या पात्रांतून दर दिवशी होणारे बाष्पीभवन त्यांच्या पूर्ण धारणक्षमतेच्या सु. २% असते पण लहान पात्रांचे २०% इतके असू शकते. काचेची देवार पात्रे सु. १५ लि. पर्यंतच्या धारणक्षमतेची तयार केलेली असतात. या आकारमानाच्या गोलाकार पात्रातून दर दिवशी फक्त १०० सेंमी३. इतक्या द्रवरूप हवेचा व्यय होतो परंतु द्रवरूप हायड्रोजनाची बाष्पीभवन उष्णता कमी असल्याने त्याचा व्यय याच्या दहा पट होतो. २५ लि. धारणक्षमतेची धातूची पात्रे द्रवरूप हवा व ऑक्सिजन यांच्या लहान प्रमाणावरील वाहतुकीसाठी व साठवणीकरिता वापरली जातात. या पात्रांतून दर दिवशी अर्धा ते एक लिटर बाष्पीभवन व्यय होतो. द्रवरूप हीलियम व हायड्रोजन यांच्या करिता ही १५ ते २०० लि. धारणक्षमतेची धातूची निर्वात पात्रे वापरतात. प्रारणामुळे (तरंगरूपी उर्जेमुळे) होणारा उष्णतेचा अंतःप्रवाह कमी करण्यासाठी निर्वात जागेत द्रवरूप नायट्रोजनाने थंड केलेले आणि प्रारणापासून संरक्षण करणारे कवच बसवितात.
भरण नलिकेचा अभिकल्प काळजीपूर्वक करून तिच्यातून पात्रात जाणाऱ्या उष्णता प्रवाहाची त्यातून निसटून जाणाऱ्या बाष्पाच्या शीततेने बऱ्यांच प्रमाणात भरपाई करण्यात येते. त्यामुळे हीलियम व हायड्रोजन या दोहोंसाठी बाष्पीभवन व्यय दर दिवशी एक टक्क्याच्या काही अंशापर्यंत मर्यादित ठेवता येतो. द्रवरूप ऑक्सिजन साठविण्यासाठीही कित्येक टन धारणक्षमतेची स्थिर देवार पात्रे वापरण्यात येतात. ही पात्रे कायम पंपाला जोडल्यास व प्रारणामुळे होणारा व्यय किमान ठेवण्यासाठी उत्तम पॉलिश केलेल्या धातूचे कवच निर्वात आवरणात बसविल्यास ५०० लि. धारणक्षमतेच्या पात्रातून दर दिवशी केवळ ५ लि. बाष्पीभवन व्यय होतो. द्रवरूप ऑक्सिजन एका पात्रातून दुसऱ्या पात्रात भरण्यासाठी निरोधित ⇨ वक्रनलिकाही वापरतात.
वायूंचे विलगीकरण : वायूंच्या द्रवीकरणाचा हा सर्वांत महत्त्वाचा औद्योगिक उपयोग आहे. एखाद्या मिश्रणातील घटकांचे उकळबिंदू बरेच वेगवेगळे असतील, (उदा., कोक भट्टी वायूतील एथिलीन, मिथेन व ऑक्सिजन), तर त्यांचे क्रमाक्रमाने द्रवीकरण करता येते. जर घटकांचे उकळबिंदू फार जवळजवळ असतील (उदा., ऑक्सिजन ९००.२ के. व नायट्रोजन ७७०.४ के.), तर ही पद्धत समाधानकारकपणे वापरता येत नाही. यामुळे हवेचे घटक विलग करण्यासाठी विशोधन पद्धती वापरतात. ही पद्धती प्रथम लिंडे व क्लोद यांनी वापरली. जर द्रवरूप हवा व सर्वसाधारण संघटनाची वातावरणीय हवा परस्परांच्या संपर्कात आणली, तर बाष्पातील ऑक्सिजनाचे द्रवीकरण होते व द्रवातील नायट्रोजनाचे बाष्पीभवन होते. या गोष्टीचा विशोधन पद्धतीत उपयोग करण्यात येतो. अशा प्रकारे वायुरूप हवा वाढत्या नायट्रोजन संहतीच्या (प्रमाणाच्या) द्रवरूप हवेच्या संपर्कात क्रमाक्रमाने आणून तिच्यातील ऑक्सिजन काढून टाकता येणे शक्य होते.
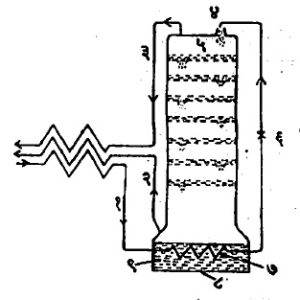
हवेपासून ऑक्सिजनाचे उत्पादन करण्यासाठी वापरण्यात येणारा साधा विशोधन स्तंभ आ. ६ मध्ये दाखविला आहे. या स्तंभात छिद्रे पाडलेल्या अनेक थाळ्या बसविलेल्या असतात. द्रव हवा स्तंभाच्या वरच्या टोकाशी शिरते व तळाशी तिचे पुन्हा बाष्पीकरण करण्यात येते. वर चढणारे बाष्प थाळ्यांतील छिद्रांतून शिरकाव करून आपला मार्ग काढते व त्यामुळे द्रवाशी त्याचा चांगला संपर्क होतो. जर स्तंभात वातावरणीय संघटनाची हवा भरली, तर बाष्पातून द्रवाला ऑक्सिजन दिला जातो व त्यातील नायट्रोजन कमी होतो. अशा प्रकारे काही वेळानंतर स्तंभाच्या खालच्या भागात ऑक्सिजन-संपन्न मिश्रणे तयार होतात. जर थाळ्यांची संख्या पुरेशी असेल, तर तळाशी असलेल्या बाष्पित्रात (बॉयलरमध्ये) शुद्ध ऑक्सिजन जमा होतो. हा ऑक्सिजन (२) या नलिकेद्वारे द्रवरूपात वा वायुरूपात काढून घेता येतो. ऑक्सिजनाचे प्रमाण कमी झालेली हवा स्तंभाच्या वरच्या टोकाकडून (३) या नलिकेद्वारे काढून घेतात. घटकांत विलगीकरण करावयाची हवा सु. पाच वातावरण दाबाखाली (१) या नलिकेतून स्तंभात शिरते. (७) या सर्पिल नलिकेत तिचे द्रवीकरण होते व त्यामुळे बाष्पित्रातील द्रवरूप ऑक्सिजनाचे पुन्हा बाष्पीकरण होते. ही हवा मग (६) या झडपेतून जाऊन वरच्या टोकाशी द्रवरूप हवा म्हणून एक वातावरण दाबाखाली स्तंभात शिरते. स्तंभाच्या वरच्या टोकाशी काढून घेतलेल्या नायट्रोजन-संपन्न मिश्रणात किमान ७% ऑक्सिजन असतो. शुद्ध नायट्रोजनाच्या उत्पादनासाठी आ. ७. मध्ये दाखविलेला दुहेरी विशोधन स्तंभ वापरतात. वरचा स्तंभ एक वातावरण दाबात कार्य करतो आणि शुद्ध नायट्रोजन व शुद्ध ऑक्सिजन यांचे उत्पादन करतो. खालचा स्तंभ पाच वातावरण दाबाखाली प्राथमिक विभाजक म्हणून कार्य करतो व वरच्या स्तंभाला लागणारे शुद्ध द्रवरूप नायट्रोजन आणि ऑक्सिजन-संपन्न मिश्रण पुरवितो. खालच्या स्तंभाची रचना साधारणपणे साध्या विशोधन स्तंभासारखीच असते. या वातावरण दाबाखालील नायट्रोजनाचा उकळबिंदू एक वातावरण दाबाखाली ऑक्सिजनाच्या उकळबिंदूपेक्षा उच्च आहे व यामुळे वरच्या स्तंभाच्या तळाशी उकळणारा द्रवरूप ऑक्सिजन खालच्या स्तंभातून वर चढणाऱ्या नायट्रोजन बाष्पाचे द्रवीकरण होण्यास उपयोगी पडतो. या द्रवरूप नायट्रोजनापैकी निम्मा खालच्या स्तंभातून ठिबकण्यासाठी राहू देतात आणि उरलेला निम्मा भाग (७) या झडपेतून प्रसरण पावू देऊन एक वातावरण दाबाखाली वरच्या स्तंभाच्या वरच्या टोकाशी भरण्यात येतो.
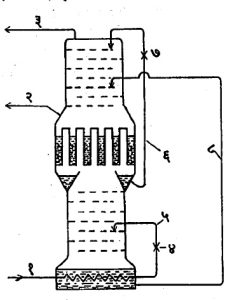
ऑक्सिजनाचे किंवा ऑक्सिजन व नायट्रोजन या दोन्हीचे ताशी १०,००० मी.३ उत्पादन करणारी हवा विलगीकरण संयंत्रे उपलब्ध आहेत. जर फक्त वायूचे उत्पादन केले, तर सर्वांत मोठ्या व कार्यक्षम संयंत्राची शक्तीची गरज ऑक्सिजनाच्या दर घन मीटरला सु. ०.४ किवॉ. ता. इतकी असते (याचे सैद्धांतिक मूल्य ०.०७ किवॉ. ता. आहे). उत्पादन द्रवरूपात केले, तर द्रवीकरणासाठी करावे लागणारे कार्य वरील आकड्यात मिळवावे लागेल परंतु उत्पादनाच्या खर्चापैकी काहीची भरपाई वाहतुकीतील बचतीमुळेहोते.
नीच तापमान विशोधन पद्धती इतर वायू मिश्रणांसाठीही वापरण्यात येते. विशेषतः खनिज तेलाच्या परिष्करणातून उपउत्पादन म्हणून मिळणाऱ्या वायूंतून या पद्धतीने शुद्ध एथिलीन, प्रोपिलीन व इतर ओलेफिने विलग करता येतात.
द्रवीकृत वायूंचे उपयोग : वायूच्या घनतेशी तुलना करता द्रवीकृत वायूंची असलेली उच्च घनता व त्यांचे प्रशीतन गुणधर्म यांमुळे उद्योगांत व वैज्ञानिक संशोधनात त्यांना महत्त्वाचे स्थान आहे. काटकसरीची वाहतूक व साठवण यांकरिता त्यांची उच्च घनता विशेष महत्त्वाची आहे आणि त्यासाठी उष्णता निरोधित पात्रे मोठ्या प्रमाणावर वापरतात. ऑक्सिजनाचा वापर जेव्हा सतत करावयाचा असतो तेव्हा तो द्रवरूपात साठविणे सोयीचे असते. द्रवरूप ऑक्सिजन उष्णता निरोधित पात्रात ठेवतात आणि त्याचे आवश्यक त्या दराने २० वातावरण दाबापर्यंत बाष्पीभवन करतात. कोळशाचे चूर्ण वा इतर ज्वलनशील पदार्थांबरोबर द्रवरूप ऑक्सिजन मिसळून स्फोटक म्हणून वापरतात. हायड्रोकार्बन इंधनाबरोबर त्याचा रॉकेट प्रचालक म्हणूनही उपयोग करतात. द्रवरूप हायड्रोजनाचाही रॉकेट प्रचालक म्हणून उपयोग करतात [⟶ रॉकेट]. द्रवरूप हवा, नायट्रोजन किंवा ऑक्सिजन यांचा प्रयोगशाळेत वायूंच्या शुद्धीकरणासाठी आणि उच्च निर्वात उपकरणातील झडपा थंड ठेवण्यासाठी वापर करतात. उच्च निर्वात निर्माण करण्यासाठी द्रवीकृत वायूंचा सक्रियित कोळशासह अथवा त्याशिवाय उपयोग करण्यात येतो. द्रवरूप हायड्रोजन व द्रवरूप हीलियम हे दोन्ही अणुक्रेंद्रीय संशोधनासाठी बुद्बुद् कोठीत वापरतात [⟶ कण अभिज्ञातक]. द्रवरूप हीलियमाने थंड केलेल्या पृष्ठभागांच्या साहाय्याने पंपक्रियेचा उच्च वेग व अतिशय नीच दाब मिळविता येतात. द्रवीकृत नौसर्गिक वायू (एलएनजी) व द्रवीकृत पेट्रोलियम वायू (एलपीजी) यांचा इंधन म्हणून मोठ्या प्रमाणावर उपयोग करण्यात येतो.
वैज्ञानिक संशोधनाकरिता ००.३ के. पर्यंत कोणतेही नीच तापमान टिकवून ठेवण्यासाठी द्रवरूप हवा, हायड्रोजन व दोन हीलियम समस्थानिक (अणुक्रमांक तोच पण अणूभार भिन्न असलेले त्याच मूलद्रव्याचे प्रकार) यांचा उपयोग करता येतो. १९३० पा वेतो द्रव्याच्या नीच तापमानाला होणाऱ्या वर्तनाचा अभ्यास काही विशेष प्रयोगशाळांतच होत असे. यांतील पहिली व सर्वांत महत्त्वाची म्हणजे नेदर्लंड्समधील लायडन विद्यापीठातील व कामर्लिंग-ऑनेस यांच्या नावाने ओळखण्यात येणारी प्रयोगशाळा होय. मोठ्या सुधारित हायड्रोजन द्रवीकारक उपकरणाचा व कॉलिन्स हीलियम द्रवीकारक उपकरणाचा विकास झाल्यावर नीच तापमानासंबंधीच्या संशोधनाचे क्षेत्र खूप विस्तारले. १९६० सालानंतर द्रवरूप हीलियम तापमानाला प्रयोग करण्याच्या सुविधा बहुतेक विद्यापीठांतील व संशोधन संस्थांतील भौतिकीय प्रयोगशाळांत आवश्यक समजण्यात येऊ लागल्या.
पहा : नीच तापमान भौतिकी प्रशीतन.
संदर्भ : 1. Baron, R. Cryogenic Systems, 1966.
2. Collins, S. C. Canoaday, R. L. Expansion Machines for Low Temperature Processes, London, 1958.
3. Flynn, T. M. Timmerhaus, K. D. Cryogenic Process Engineering, 1985.
4. McClintock, M. Cryogenics, New York, 1964.
5. Saha, M. N. Srivastava, B. N. A Treatise on Heat, Allahabad, 1965.
6. White, G. K. Experimental Techniques in Low Temperature Physics, London, 1959.
घन, प. द.; भदे, व. ग.