आयन – विनिमय : आयन-विनिमय म्हणजे विद्रावातील आयन (विद्युत् भारित अणू, रेणू वा अणुगट) व त्याच प्रकाराचे अविद्राव्य (न विरघळणाऱ्या) घन पदार्थातील (किंवा अमिश्रणीय द्रवांतील) आयन ह्यांची व्युत्क्रमी (उलटसुलट दिशांनी होणारी) अदलाबदल. ज्या अविद्राव्य घन पदार्थातील आयनांची विद्रावातील आयनांबरोबर अदलाबदल होते त्या घन पदार्थास (किंवा अमिश्रणीय द्रव पदार्थास) आयन-विनिमयक असे म्हणतात. उदा., आयन-विनिमयकातील सोडियम आयन व विद्रावातील पोटॅशियम आयन यांची होणारी अदलाबदल. ह्या विनिमय विक्रियेत आयन-विनिमयकाच्या मूलभूत रचनेत बदल होत नाही. विनिमयकाच्या रचनेचे दोन भाग मानता येतात. पहिला म्हणजे विनिमयकाची मूलभूत असलेली बहुवारिकी (एकापेक्षा जास्त रेणू जोडलेली) रचना व दुसरी म्हणजे त्या बहुवारिकी रचनेला जोडलेले विक्रियाकारी गट. ज्या जागी विक्रियाकारी गट जोडलेले असतात त्याच जागी विनिमय विक्रिया होते. बहुवारिकाच्या इतर रचनेमध्ये विनिमय विक्रियेत काहीही फरक होत नाही. विनिमय विक्रियेची ही वैशिष्ट्ये पुढील उदाहरणांवरून स्पष्ट होतील : ल्यूसाइट हा एक अविद्राव्य घन पदार्थ असून त्याच्या संघटनेत पोटॅशियम आयन आहेत. सोडियम क्लोराइडाच्या विद्रावाच्या संपर्कात आयन-विनिमय विक्रिया होऊन त्याचे ॲनालसाइट बनते. ते पोटॅशियम क्लोराइडाच्या सान्निध्यात ठेवले, तर परत त्याचे ल्यूसाइटामध्ये रूपांतर करता येते. समीकरणाने ह्या दोन विक्रिया अशा लिहिता येतील.
| K2o.Al2O3.4SiO2 + 2Na + ⇌ Na2O. Al2O3.4SiO2 + 2K+ | |||
| ल्यूसाइट | सोडियमआयन | ॲनालसाइट | पोटॅशियम आयन |
| Na2O.Al2O3.4SiO2 + 2K + ⇌ K2O.Al2O3.4SiO2 + 2Na+ | |||
| ॲनालसाइट | पोटॅशियम आयन | ल्यूसाइट | सोडियम आयन |
ह्या विक्रियेत पोटॅशियम आयन व सोडियम आयन ह्यांत विनिमय होतो. विनिमयकाच्या इतर रचनेत, विनिमयामुळे काहीही फरक पडत नाही व तयार झालेल्या ॲनालसाइटापासून ल्यूसाइट परत मिळविता येते, म्हणजेच ही विनिमय विक्रिया व्युत्क्रमी आहे.
इतिहास : आयन-विनिमय प्रथम शोधून काढण्याचे श्रेय टॉमसन आणि वे या इंग्रज शेतकीतज्ञांना दिले जाते. त्यांनी १८५० साली ॲल्युमिनियम सिलिकेटामुळे होणाऱ्या कॅल्शियम व अमोनियम आयनांच्या विनिमयावर अन्वेषण (संशोधन) केले. १८७० साली लेमबर्ग यांनी आयन-विनिमय विक्रिया व्युत्क्रमी असतात, हे दाखविले. औद्योगिक दृष्ट्या पाण्याचे फेनदीकरण (पाण्यातील कॅल्शियम व मॅग्नेशियम आयन काढून टाकणे) करण्यासाठी आर्. गान्स यांनी आयन-विनिमयाचा प्रथम उपयोग केला. ॲडम्स व होम्झ यांनी १९३५ मध्ये संश्लेषित (कृत्रिम रीत्या) विनिमयक प्रथम तयार केले. वैश्लेषिक रसायनशास्त्रात आयन-विनिमयाचा प्रथम उपयोग कॉलिन व बेल यांनी मूत्रातील अमोनियाचे प्रमाण मोजण्यासाठी केला.
उपयोग : आयन-विनिमयाचा उपयोग पाण्याचे फेनदीकरण करण्यासाठी फार पूर्वीपासून होत आहे. अफेनद पाण्यात कॅल्शियम व मॅग्नेशियम आयन असतात. त्यामुळे अशा पाण्यात साबणाचा फेस होत नाही. आयन-विनिमयाच्या साहाय्याने अफेनद पाण्यातील हे अनिष्ट आयन काढून टाकले म्हणजे त्याचे फेनदीकरण होते. फेनदीकरण करण्याकरिता पूर्वी काही नैसर्गिक विनिमयकांचा (उदा., काही सिलिकेटे) उपयोग करीत असत. परंतु ह्या विनिमयकांची विनिमय क्षमता फार कमी होती. तसेच ते विनिमयक निसर्गात सापडत असल्यामुळे त्यांची संघटना हमखास ठराविकच असेल, अशी खात्री नसे. अलीकडे ठराविक संघटना असणारे व विनिमयक्षमता विपुल असणारे असे विनिमयक रासायनिक विक्रियांनी बनविता येऊ लागले आहेत. ते पाण्याच्या फेनदीकरणासाठी वापरता येतात. पाण्यातील कॅल्शियम आयन व विनिमयकातील सोडियम आयन यांचा विनिमय पुढील समीकरणाने दाखविता येईल. या समीकरणआत R–हा Na+ आयनाव्यतिरिक्त असलेला आयन विनिमयकाचा बहुवारिकी भाग होय.
| 2R¯Na+ + Ca++ (विद्राव) ⇌ R2– Ca++ + 2Na+ | ||
| आयन
विनियमक |
कॅल्शियम सोडियम
आयन आयन |
|
कॅल्शियम समाविष्ट रूपात गेलेला विनिमयक, सोडियम क्लोराइडाच्या सान्निध्यात ठेवल्यास, त्याचे सोडियम समाविष्ट रूप परत मिळविता येते व त्यामुळे विनिमयक पुन्हा पुन्हा वापरता येतो. होणारी विक्रिया पुढील समीकरणाने दाखविली आहे.
| R2— Ca++ + 2Na+ (विद्राव) ⇌ 2R— Na+ + Ca++ | ||
| सोडियम
आयन |
आयन
विनियमक |
कॅल्शियम
आयन |
वरील विक्रियांमुळे हे दिसून येईल की, थोड्या विनिमयकाच्या साहाय्याने पाण्याच्या बऱ्याच मोठ्या साठ्याचे फेनदीकरण करता येते.
आयन-विनिमयाचा उपयोग करून निसर्गात एकत्र सापडणाऱ्या व सारखे रासायनिक गुणधर्म असणाऱ्या पदार्थांचे विलगीकरण करता येते. याचे एक ठळक उदाहरण ð विरल मृत्तिकांचे विलगीकरण हे होय. तसेच वैद्यकीय शास्त्रात शरीरातील जादा सोडियम काढून टाकण्याकरिता पोटॅशियम-अमोनियम स्वरूपातील आयन-विनिमयकाचा उपयोग केला जातो. तसेच जठरामध्ये हायड्रोक्लोरिक अम्लाची वाजवीपेक्षा जादा निर्मिती झाल्यामुळे होणाऱ्या व्याधीच्या निवारणासाठी प्रभावी क्षारक (अम्लाशी विक्रिया झाल्यास लवण देणारा पदार्थ) विनिमयकांचा उपयोग करतात. आयन-विनिमयाचा उपयोग उद्योगधंद्यातील टाकाऊ विद्रावांतून मौल्यवान धातू मिळविण्याकरितादेखील करतात. अशा प्रकारचा विद्राव जर योग्य विनिमयकातून जाऊ दिला म्हणजे धातूंचे आयन, आयन-विनिमयक अधिशोषित (पृष्ठभागावरील शोषण) करील. हे अधिशोषित आयन त्या विनिमयकाची योग्य त्या विद्युत् विच्छेद्याच्या (विजेच्या प्रवाहाने विघटन होणाऱ्या पदार्थांच्या) विद्रावाबरोबर विक्रिया करून परत मिळविता येतील.
काही औद्योगिक विक्रियांमध्ये वापरावयाच्या पाण्यातील विद्रुतांचे (विरघळणाऱ्या पदार्थांचे) आयन संपूर्णपणे काढून टाकणे आवश्यक असते. यासाठीही आयन-विनिमयकाचा उपयोग करता येतो. R– H+ आणि R+OH– ह्या स्वरूपातील विनिमयक त्याकरिता वापरतात. या विनिमय विक्रिया पुढील समीकरणांनी दाखविता येतील.
| R– H+ + NaCl → R– Na+ + HCl | |||
| हायड्रोजन आयन समाविष्ट विनिमयक | सोडियम क्लोराइड | सोडियम आयन समाविष्ट विनिमयक | हायड्रो-क्लोरिकअम्ल |
| R¯O¯ + HCI → R+Cl¯ + H2O | |||
| हायड्रॉक्सिल आयनसमाविष्टविनमयक | हायड्रोक्लोरिकअम्ल | क्लोरीन आयनसमाविष्टविनिमयक | पाणी |
वापरलेल्या विनिमयकाचे पुनरुज्जीवन करण्यासाठी एकदा वापरलेल्या विनिमयकाची आवश्यकतेप्रमाणे हायड्रोक्लोरिक अम्ल किंवा सोडियम हायड्रॉक्साइडाबरोबर विक्रिया करतात. ह्यामुळे विनिमयक मूळच्या स्वरूपात पुन्हा मिळवून वापरता येतो व आर्थिक दृष्ट्या बरीच बचत होते.
विनिमय तंत्रे : विनिमय विक्रिया होण्यासाठी आयन-विनिमयक व विद्राव यांचा एकमेकांशी संबंध येणे आवश्यक असते. तो आणण्यासाठी दोन तंत्रांचा उपयोग करतात. पहिल्या तंत्रास संच (बॅच) पद्धती व दुसऱ्यास स्तंभ पद्धती म्हणतात. संच पद्धतीत एका पात्रात विद्राव व विनिमयक एकत्र करून ते मिश्रण समतोल स्थापन होईपर्यंत ढवळतात व नंतर गाळून विद्राव व विनिमयक वेगवेगळे करतात. स्तंभ पद्धतीत एका दंडगोलाकृती नलिकेत आयन-विनिमयक भरतात व त्यातून विद्राव हळूहळू झिरपू देतात.
वापरलेल्या विनिमयकाचे नंतर पुनरुज्जीवन करून तो पुन्हा वापरतात. आयन-विनिमय व विद्राव यांत आयनांची अदलाबदल सुलभ व जलद होण्यासाठी आयन-विनिमयकाची रचना स्तरयुक्त असणे आवश्यक असते. तसेच आयन-विनिमयकाचे कण अतिसूक्ष्म असावे लागतात.
रासायनिक संश्लेषणाने अनेक आयन-विनिमयक अलीकडे तयार करता येऊ लागले आहेत. असा विनिमयक हा अविद्राव्य अम्ल किंवा अविद्राव्य क्षारक असतो व त्याचे लवणदेखील अविद्राव्य असते. संश्लेषित आयन-विनिमयकाचे प्रबल अम्लाच्या किंवा प्रबल क्षारकाच्या विद्रावात अपघटन होत नाही. नैसर्गिक आयन-विनिमयकाचे प्रबल क्षारकाच्या किंवा प्रबल अम्लाच्या विद्रावात अपघटन होते व त्यामुळे pH मूल्याच्या [→ पीएच मूल्य] ठराविक टप्प्यातच त्यांचा उपयोग करता येत असे. संश्लेषित विनिमयकांत हा दोष नसल्यामुळे आयन-विनिमय क्षेत्रात फार झपाट्याने प्रगती झाली आहे.
विनिमय विक्रियांचे प्रकार : अम्लीय विनिमय R– H+ या सूत्राने व क्षारकाच्या असणारा विनिमयक R+OH–अशा सूत्राने दाखविण्याचा प्रघात आहे. जेव्हा विनिमय विक्रियेत विनिमयकातील ऋणायन (धन विद्युत् भारित आयन) व विद्रावातील ऋणायन भाग घेतात, तेव्हा त्या विनिमय विक्रियेस ऋणायन-विनिमय असे म्हणतात. उदा.,
| 2R– H+ + Ca++ (विद्राव)→R2– Ca++ + HCI | |||
| हायड्रोजन आयन समाविष्ट विनिमयक | कॅल्शियम आयन | कॅल्शियम आयन समाविष्ट विनिमयक | हायड्रो-क्लोरिकअम्ल |
ह्या विक्रियेत विद्रावातील Ca++ आयन व विनिमयकातील H+ आयन ह्या दोन ऋणायनांनी भाग घेतला आहे. म्हणून ही ऋणायन-विनिमय विक्रिया आहे. जर विनिमय विक्रियेत विनिमयकातील धनायन (ऋण विद्युत् भारित आयन ) व विद्रावातील धनायन भाग घेत असतील, तर त्या विनिमय विक्रियेस धनायन-विनिमय असे म्हणतात.
ऋणायन-विनिमय विक्रियेताल विनिमयकाला ऋणायन-विनिमयक व धनायन-विनिमय विक्रियेतील विनिमयकास धनायन-विनिमयक असे म्हणतात. संश्लेषित ऋणायन-विनिमयक व धनायन-विनिमयक ह्यांच्या प्रातिनिधिक रचना पुढीलप्रमाणे दाखविता येतील.
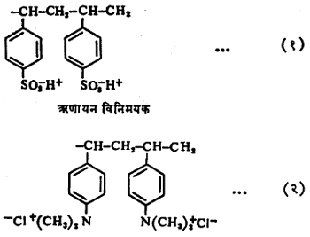
वरील रचनांतील (१) मध्ये विनिमयकातील H+ हा ऋणायन व (२) मधील विनिमयकातील Cl– हा धनायन विनिमयात भाग घेतात.
निवड गुणांक : विद्रावातील आयनांचे व आयन-विनिमयकातील आयनांचे वाटप कसे होईल, हे ठरविण्याकरिता निवड गुणांकाचा उपयोग केला जातो. निवड गुणांकाची व्याख्या करण्यासाठी एक सर्वसाधारण विक्रिया घेऊ.
A+ (विद्राव) + B+ R¯ ⇌ B+ (विद्राव) + A+ R–
विनिमयक विनिमयक
ह्यात विद्रावातील A+ आणि विनिमयकातील B+ यांची अदलाबदल झालेली आहे. विनिमय विक्रियेत समतोल स्थापित झाल्यावर ‘द्रव्यमान-प्रभाव-नियम’[→ समतोल, रासायनिक] वापरून खालील समीकरण सिद्ध होते.
| aB+ aA+R¯ | =k |
| aA+ B+ R– |
वरील समीकरणात aB+ आणि aA+ हे विद्रावातील आयनांची विक्रियाशीलता दाखवितात, तर aA+R– आणि aB+ R– हे त्याच आयनांची विनिमयकातील विक्रियाशीलता दाखवितात. जर विद्रावाची संहती (एकक घनफळातील दिलेल्या पदार्थांच्या रेणूंची किंवा आयनांची संख्या) अगदी कमी असेल, म्हणजे विद्राव अगदी विरल असेल, तर वरील समीकरणात विक्रियाशीलतेऐवजी त्या त्या आयनांची विद्रावातील व विनिमयकातील संहती (ग्रॅमरेणूभारात, रेणूमधील सर्व अणूंच्या वजनांची ग्रॅम या एककातील बेरीज) वापरता येईल व तेच समीकरण पुढीलप्रमाणे लिहिता येईल.
| K = | [B+] [A+ R¯ ] |
| [A+] [B+ R¯ ] |
कंसात त्या त्या आयनांची, विद्रावातील व विनिमयकातील संहती ग्रॅमरेणुभारात दाखविलेली आहे. K ह्या समतोल स्थिरांकास विनिमय विक्रियेत निवड गुणांक असे म्हणतात. निवड गुणांक जितका एकापेक्षा जास्त तितके B+ ह्या आयनाचे, तो विनिमयक वापरून (ज्याच्या बाबतीत निवड गुणांक मोजलेला आहे) त्याच्या लवण विद्रावातून, विलगीकरण सोपे व सुलभ असते. निवड गुणांक हा त्या आयन-विनिमयकाची, A+ व B+ ह्या दोन आयनांबद्दलची पसंती किंवा असणारी आसक्ती दर्शवितो. आयन-विनिमयकाची एखाद्या आयनाबद्दल असणारी आसक्ती व त्या आयनाचे इतर भौतिक गुणधर्म यांचा काही संबंध नसतो. परंतु जेव्हा विनिमय होणारे आयन हे सारख्या ð संयुजांचे असतात त्यावेळी विनिमयकाची दोन आयनांबद्दल असणारी पसंती त्या आयनांच्या जलसंयोगित स्वरूपातील आकारमानावर अवलंबून असते, ज्या आयनाचे जलसंयोगी स्वरूपातील आकारमान कमी, त्याला तो विनिमयक जास्त पसंत करतो. हल्लीच्या सिद्धांताप्रमाणे पाण्यात आयन जलसंयोग रूपाने असतात व त्यांची जलसंयोगाची मात्रा, ही त्या आयनाच्या संयुजेच्या सम प्रमाणात व आयनी त्रिज्येच्या व्यस्त प्रमाणात बदलते. म्हणजे, जर विद्रावात Na+ वCs+ हे दोन आयन घेतले, तर विनिमयक Na+ पेक्षा Cs+ला जास्त पसंत करतो. कारण दोन्ही आयनांची संयुजा जरी सारखी असली, तरी Cs+ ची जलसंयोगी त्रिज्या ही Na+च्या जलसंयोगी त्रिज्येपेक्षा कमी आहे. आयनाची जलसंयोगी आयनी त्रिज्या ही, संयुजा व आयनी त्रिज्या यांच्या गुणोत्तरावर अवलंबून असते. जितके हे गुणोत्तर जास्त तितका तो आयन जास्त जलसंयोगी. सोडियमाची आयनी त्रिज्या ही सिझियमाच्या आयनी त्रिज्येपेक्षा कमी आहे. म्हणून सोडियम आयनाची संयुजा व आयनी त्रिज्या यांचे गुणोत्तर सिझियमाच्या गुणोत्तरापेक्षा जास्त आहे. त्यामुळे तो आयन जास्त जलसंयोगी आहे म्हणजे त्याची जलसंयोगी आयनी त्रिज्या जास्त आहे. इतर एकसंयुजी आयनांचे निवड गुणांक पुढील क्रमाने आहेत.
Li+ < H+ < Na+ < K+ K+ = NH4+
NH4+ < Rb+ < Cs+ < Ag+
द्विसंयुजी आयनांचा हाच क्रम खाली दाखविल्याप्रमाणे आहे.
Be++ < MN++ < Mg++ Mg++ = Zn++
Zn++ < Cu++ Cu++ = Ni++
Ni++ < Co++ < Ca++ < Sr++ < Pb++ < Ba++
वेगवेगळ्या संयुजा असलेल्या आयनांबाबत आयन-विनिमयकाची पसंती त्या आयनाच्या संयुजेवर अवलंबून असते, हे विधान फक्त विरल विद्रावापुरतेच खरे आहे. विरल विद्रावात आयन विनिमयक दोन वेगळ्या आयनांपैकी, ज्या आयनाची संयुजा जास्त असेल त्या आयनास विशेष पंसती दाखवितो.
आयन-विनिमयासंबंधीचे सिद्धांत : आयन-विनिमयाचे स्पष्टीकरण करण्यासाठी दोन सिद्धांत सुचविलेले आहेत. पहिला बाउमान व आइखहोर्न यांनी सुचविला. तो आयन-विनिमयकाचे कण व त्याच्या सभोवती असणारा विद्राव यांमधील डोनान समतोलावर [→ तर्षण] आधारित आहे. यात विनिमयक कणांचा पृष्ठभाग हा एक प्रकारचा पडदा आहे, अशी कल्पना केलेली असून विनिमयकातील ज्या जागी विनिमय होतो त्या जागा अविसरणशील (एकमेकांत आपोआप न मिसळणारे) आयन आहेत असे कल्पिलेले आहे.
दुसरा सिद्धांत ग्रेगर यांनी सुचविलेला आहे. यात विनिमयकाची आयनाबाबत निवड व बहुवारिकाला वेगळे आयन जोडल्यामुळे त्यास येणारा फुगीरपणा यांचा संबंध जोडलेला आहे. ज्याप्रमाणे एखादी स्प्रिंग ताणावयास शक्ती खर्च करावी लागते. त्याचप्रमाणे बहुवारिकाला फुगण्यासाठी शक्ती खर्च करावी लागते. त्यामुळे विनिमयक अशाच आयनांची निवड करील की, जे जलसंयोगी स्वरूपात कमी जागा व्यापतात म्हणजे विनिमयकाला कमी फुगवटा आणतात.
अलीकडे बॉइड, सोल्डानो आणि ग्लुएकॉफ यांनी निवड गुणांक, आयनाच्या विक्रियाशीलतेचा गुणांक आणि विनिमयकाचे फुगणे यांना सांधणारे खालील सूत्र सुचविले आहे.
lnK = ln(γ ¯A/ γ ¯B) – ln(γ a/ γ B) + p(V¯A-V¯B)/RT वरील समीकरणात K हा निवडगुणांक, γ ¯A/ γ ¯B हे A व B आयनांचे रेझिनामधील विक्रियाशीलतेचे गुणोत्तर व γA/γB हे त्याच आयनांचे विद्रावातील विक्रियाशील गुणकांचे गुणोत्तर, p हा फुगीरपणाचा दाब, V¯A व V¯B हे आयनांचे विशिष्ट आकारमान होय, In हा नैसर्गिक लॉगरिथम दर्शवितो, R हा समतोल स्थिरांक आणि T हा समतोल स्थिरांक आणि T हे समतोलाचे तापमान आहे.
यापैकी कोणताही सिद्धांत, आयन-विनिमयाचे समर्पक स्पष्टीकरण करीत नसल्यामुळे निवड गुणांक हा इतर गोष्टींवर कसा अवलंबून असतो, हे दाखविण्यासाठी प्रयोगावरून निघालेले निष्कर्ष पुढे दिले आहेत. विनिमयक रेझिनाची एखाद्या आयनाविषयी पसंती ही (१) त्याच्या संयुजेवर अवलंबून असते. संयुजा जास्त असेल, तर रेझिनाची त्या आयनासंबंधी पसंती जास्त असते. उदा., Na+ < Ca+ म्हणजे Ca++ बद्दलची विनिमयकाची पसंती ही Na+ च्यापेक्षा जास्त आहे. तसेच Ca++ < La+++ < Th++++. (२) आवर्त सारणीच्या (मूलद्रव्यांच्या विशिष्ट पद्धतीने केलेल्या कोष्टकरूप मांडणीच्या) एका विशिष्ट गटात ती आयनांच्या अनुक्रमांकांप्रमाणे वाढत जाते. उदा., Li + < Na+ < K+ < Rb+ < Cs+ व Mg++ < Ca++ < Sr++ < B++ व F– < Cl– < Br– < I– (३)आयनांची संयुजा सारखी असेल व दोन आयन हे आवर्त सारणीच्या वेगळ्या गटांत असतील, तर ही पसंती आयनाच्या विक्रियाशीलतेच्या गुणांकावर अवलंबून असते. जितका विक्रियाशीलता गुणांक जास्त तितकी त्या आयनासंबंधी पसंती जास्त. (४) पसंती ही आयनाच्या जलसंयोगाच्या व्यस्त प्रमाणात बदलते, हे आपण वर पाहिलेच आहे.
वरील विधाने तंतोतंत पाळली जातातच असे म्हणता येत नाही. उदा., (२) मध्ये जो क्रम दिला आहे तो क्रम तापमान जास्त असताना किंवा संहत विद्रावात बदलतो.
ऋणायनाबाबत पुढे दिल्याप्रमाणे क्रम लावण्याचा प्रयत्न कुनिन व मायर्स यांनी केला आहे. OH¯ > SO4¯ ¯ > CrO4—> C6H5O7 —(सायट्रेट) > C4H4O6— (टार्टरेट) >NO3–> AsO4—> PO4—> MoO4—> C2H2O2¯ C2H3O6¯ (ॲसिटेट) = I¯ = Br– Br-¯ > Cl-¯ > F –. हा क्रम आयनांच्या संहतीबरोबरच, विद्रावाच्या pH वर आणि विनिमय विक्रियाकारी गटाच्या क्षारकतेवर अवलंबून असतो.
विनिमय विक्रियेची गती ही विद्रावाची संहती, आयनांचे विद्रावातील व विनिमयक रेझिनामधील विसरण गुणांक [→ विसरण] व तापमान यावर अवलंबून असते, तशीच वापरण्यात येणाऱ्या विद्रावकावरही ही गती अवलंबून असते. विद्रावक म्हणून पाण्याचा उपयोग केला, तर ही विनिमय गती जास्त असते व अध्रुवीय (रेणूतील धन व ऋण भार वेगळे न झालेल्या) विद्रावकात ही गती कमी असते. ध्रुवीय विद्रावकात विद्रुताचे आयनीकरण होत असल्यामुळे वापरण्यात येणाऱ्या विद्रावकाच्या ध्रुवतेवर विनिमय विक्रियेची गती अवलंबून असते. आयन-विनिमय विक्रियेमध्ये रेझिनाच्या सन्निध असणाऱ्या विद्रावाच्या पातळ पापुद्र्यातून आयनांचे विसरण होते किंवा आयन-विनिमयकाच्या कणांतून आयनाचे विसरण होते, असे समजले जाते. पहिल्या यंत्रणेस आवरण यंत्रणा असे म्हणतात व दुसऱ्या यंत्रणेस कण यंत्रणा म्हणतात.
बॉइड व त्यांचे सहकारी यांनी असे दाखविले आहे की, आयन-विनिमय वरीलपैकी कोणत्या यंत्रणेने होतो, हे विद्रावाची संहती ०·००१ ग्रॅम रेणुभारापेक्षा कमी असेल, तर विनिमय पहिल्या यंत्रणेने (विद्रावाच्या पातळ पापुद्र्यातून आयनाचे विसरण) होईल. जर विद्रावाची संहती ०·१ ग्रॅमरेणुभारापेक्षा जास्त असेल, तर विनिमय दुसऱ्या यंत्रणेने होईल. परंतु विद्रावाची संहती जर ०·००१ आणि ०·१ यांमध्ये असेल, तर विनिमय दोन्ही यंत्रणांच्या साहाय्याने होईल. अशा यंत्रणेला मध्यस्त यंत्रणा असे म्हणतात. सर्वसाधारणपणे आयन विनिमयात वापरण्यात येणाऱ्या विद्रावाची संहती ०·००१ आणि ०·१ यांमध्ये असल्यामुळे ही मध्यस्त यंत्रणा जास्त महत्त्वाची आहे.
सुरुवातीस दिलेले उपयोग म्हणजे काही महत्त्वाच्या उपयोगाची उदाहरणे होत पण विज्ञानाच्या इतर विभागांत देखील आयन-विनिमयाचा उपयोग दिवसेंदिवस वाढत आहे. नवनवीन विनिमयक शोधून काढले जात आहेत व त्यांचे गुणधर्म अभ्यासिले जात आहेत, त्यामुळे आयन-विनिमयाच्या उपयोगांचे क्षेत्र जास्त व्यापक होत आहे. वैश्लेषिक रसायनशास्त्रात आयन-विनिमय विक्रिया हे एक प्रमुख अन्वेषण क्षेत्र बनले आहे.
पहा : रेझिने.
संदर्भ : 1. Helfferich, F. Ion Exchange, New York, 1962.
2. Kunin, R. Ion Exchange Resins, New York, 1958.
3. Nachod, F. C. Schubert, J. Ion Exchange Technology, New York, 1956.
भावे, अ. श्री.
“