नायट्रीकरण : कार्बनी संयुगात नायट्रो गटाचा (– NO2) प्रवेश घडविण्याची प्रक्रिया. ही प्रक्रिया कार्बनी संयुगांतील हायड्रोजन व हॅलोजन (क्लोरीन, ब्रोमीन, आयोडीन इ.) अणूंचे तसेच काही संयुगांतील विशिष्ट गटांचे (उदा., सल्फॉनिक –SO3 H, ॲसिटिल –COCH3) नायट्रो गटाने प्रतिष्ठापन होऊन (ते ते अणू अथवा गट यांच्या जागी नायट्रो गट येऊन) आणि असंतृप्त संयुगात (ज्या संयुगातील कार्बन अणू दोन अथवा अधिक बंधांनी एकमेकांस जोडले गेले आहेत अशा) नायट्रो गटाचे समावेशन (संयुगातील मूळचे अणू अथवा गट तसेच राहून नवीन गट संयुगात सामावला जाणे) होऊन घडून येते. बेंझिनापासून नायट्रोबेंझिनाची व ग्लिसरिनापासून नायट्रोग्लिसरिनाची निर्मिती ही हायड्रोजन अणूच्या प्रतिष्ठापनेची प्रसिद्ध उदाहरणे होत. बेंझिनामध्ये हा अणू कार्बनाला जोडलेला व ग्लिसरिनामध्ये तो ऑक्सिजनाला जोडलेला असतो. नायट्रोजन अणूला जोडलेला हायड्रोजन अणूही असाच नायट्रो गटाने प्रतिष्ठापित करता येतो व नायट्रामाइने मिळविता येतात. अमाइन द्वितीयक असेल [⟶ अमाइने], तर नायट्रिक अम्लाचा झिंक क्लोराइड व ॲसिटिक ॲनहायड्राइड यांच्या उपस्थितीत उपयोग करून त्याचे प्रत्यक्ष नायट्रीकरण करता येते. उदा., डायमिथिल अमाइन [(CH3)2· NH] यापासून डायमिथिल नायट्रामाइन [(CH3)2·N·NO2]. परंतु प्राथमिक अमाइनाची नायट्रो संयुगे प्रत्यक्ष त्या अमाइनांपासून बनविता येत नाहीत म्हणून त्यांची नायट्रो संयुगे मिळविण्यासाठी प्रथम अवश्य त्या अल्किल अमाइडाचे नायट्रीकरण करून त्याचे नायट्रो-अमाइड मिळवितात व त्याचे जलीय विच्छेदन (पाण्याची विक्रिया करून रेणूचे खंड पाडणे) करतात. उदा., मिथिल नायट्रामाइन CH3·NH–NO2 बनविण्यासाठी पुढील विक्रिया कराव्या लागतात.
|
CH3·CONH-CH3 |
HNO3 |
CH3-CO-N-CH3 |
H2O |
HNCH3 |
+ |
CH3COOH |
|
|
मिथिल ॲसिटामाइड |
⟶ |
| |
⟶ |
NO2 |
ॲसिटिक अम्ल |
||
|
NO2 |
मिथिल नायट्रामाइन |
||||||
|
N-नायट्रोमिथिल ॲसिटामाइड |
|||||||
अल्किल हॅलाइडावर (उदा., क्लोराइडावर) सिल्व्हर नायट्रेटाची तसेच सिल्व्हर नायट्राइटाची विक्रिया केली म्हणजेही नायट्रो संयुगे बनतात. हॅलोजन अणूचे नायट्रो गटाने प्रतिष्ठापन झाल्याची ही उदाहरणे होत.
|
R-Cl |
+ |
AgNO3 |
⟶ |
R-O-NO2 |
+ |
AgCl |
|
अल्किल क्लोराइड |
सिल्व्हर नायट्रेट |
नायट्रो संयुग |
सिल्व्हर क्लोराइड |
|||
|
R-Cl |
+ |
AgNO2 |
⟶ |
R-NO2 |
+ |
AgCl |
|
अल्किल क्लोराइड |
सिल्व्हर नायट्रेट |
नायट्रो संयुग |
सिल्व्हर क्लोराइड |
सल्फॉनिक (–SO3H) किंवा ॲसिटिल (–CO·CH3) गट संघटनेत असलेल्या ॲरोमॅटिक वर्गातील कित्येक संयुगांतील [⟶ ॲरोमॅटिक संयुगे] ते ते गट प्रतिष्ठापित होऊन नायट्रो संयुगे बनतात. उदा., ४ हायड्रॉक्सी बेंझीन १ : ३ डायसल्फॉनिक अम्ल यातील –SO3H हा गट आणि ३ : ४ डायमिथॉक्सीॲसिटोफिनोन यातील –CO·CH3 हा गट प्रतिष्ठापित होऊन तयार झालेली नायट्रो संयुगे.
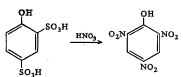
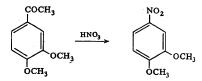
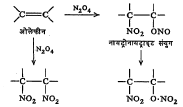
ओलेफिनांचे नायट्रीकरण नायट्रोजन डाय-ऑक्साइडाच्या योगाने घडून येते. या वेळी त्या त्या असंतृप्त संयुगात नायट्रो गटाचे समावेशन होते. उदा.,
ॲसिटिलिनाचे (CH ≡ CH) नायट्रीकरण नायट्रिक अम्लाच्या योगाने टप्प्याटप्प्यांनी होते. त्यात नायट्रो गटाचे समावेशन, ⇨ ऑक्सिडीभवन आणि दोन कार्बन अणूंमधील बंधाचा (C–C) भंग यांचा अंतर्भाव आहे या विक्रियेपासून टेट्रानायट्रोमिथेन [(NO2)4–C] हे संयुग निर्माण होते.
नायट्रीकरणाच्या यंत्रणा : (नायट्रो संयुग बनताना घटक संयुगांमध्ये होणाऱ्या फेरफारांची मालिका). नायट्रीकरण दोन यंत्रणांनी घडून येते. त्या म्हणजे (१) आयनी (विद्युत् भारित अणू किंवा अणुसमुच्चयामुळे होणारी) यंत्रणा व (२) मुक्तमूलक (ज्याच्या रेणूतील सर्व संयुजा तृप्त झालेल्या नाहीत असे काही काळ मुक्तावस्थेत राहू शकणारे संयुग) यंत्रणा या होत. नायट्रीकरण होणारे संयुग, विक्रिया घडविणारे संयुग व विक्रिया परिस्थिती यांवर यंत्रणा अवलंबून असते.
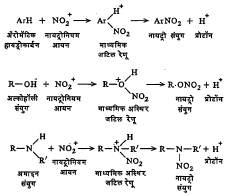
आयनी यंत्रणा : ॲरोमॅटिक संयुगे, विषम वलयी (ज्यांच्या रेणूंच्या वलयात कार्बनेतर अणू आहेत अशी) संयुगे, अल्कोहॉले, ग्लायकॉले, ग्लिसरीन, सेल्युलोज व अमाइने यांचे नायट्रीकरण या यंत्रणेने घडून येते. त्यासाठी सामान्यतः नायट्रिक अम्ल हे नायट्रीकारक वापरतात. अम्लाच्या आयनीभवनाने नायट्रोनियम आयन (NO2+) बनतात व तेच विक्रियेस कारणीभूत होतात.
2HNO3 ⟶ H2NO3+ + NO3–
H2NO+3 ⟶ NO+2 + H2O
नायट्रिक अम्लात नायट्रोनियम आयन अल्प प्रमाणात असतात त्यामुळे केवळ नायट्रिक अम्ल वापरले, तर नायट्रो संयुगाचा उतारा कमी पडतो उदा., बेंझिनापासून नायट्रोबेंझीन बनविताना नायट्रिक अम्लात सल्फ्यूरिक अम्ल मिश्र केले, तर नायट्रिक अम्लाची कार्यक्षमता वाढते.
नायट्रीकरण होताना जे पाणी निर्माण होते ते शोषून घेण्याचे कार्य सल्फ्यूरिक अम्ल करते व त्यामुळे ते नायट्रीकरणात साहाय्यकारी होते अशी पूर्वी समजूत होती पण ती निराधार आहे. सल्फ्यूरिक अम्ल मिश्र केल्याने नायट्रिक अम्लापासून जास्त प्रमाणात नायट्रोनियम आयन बनतात त्याचा हा परिणाम आहे, असे आता सिद्ध झाले आहे.
HNO3 + H2SO4 ⇄ H2NO3++ HSO4–
H2NO3+ ⇄ NO2++ H2O.
सल्फ्यूरिक अम्लाऐवजी दुसरी अम्ले उदा., फॉस्फोरिक, परक्लोरिक, सोलेनिक, ॲसिटिक किंवा बोरॉन ट्रायफ्ल्युओराइड, ॲसिटिक ॲनहायड्राइड इ. संयुगेही परिणामकारक ठरतात. तथापि औद्योगिक दृष्टीने सल्फ्यूरीक अम्ल वापरणेच सोयीचे असते.
क्षारीय (अल्कलाइन) नायट्रेट व सल्फ्यूरिक अम्ल यांचे किंवा नायट्रोजन डाय-ऑक्साइड व सल्फ्यूरिक अम्ल यांचे मिश्रणही नायट्रीकरणास उपयोगी पडते. येथेही नायट्रोनियम (NO2+) आयनच नायट्रीकरण घडवितात.
ॲसिटिक ॲनहायड्राइड व ॲसिटिक अम्ल यांचे नायट्रिक अम्लाबरोबर केलेले मिश्रणही कार्यक्षम असते. अशा मिश्रणात (NO2+) आयन असतातच पण त्याशिवाय ॲसिटिक ॲनहायड्राइड आणि नायट्रिक अम्ल यांपासून तयार होणारे ॲसिटिल नायट्रेट हेही नायट्रीकरणाचे कार्य करते.
|
(CH3·CO)2O |
+ |
HNO3 |
⟶ |
CH3COOH |
+ |
CH3·CO·NO3 |
|
ॲसिटिक ॲनहायड्राइड |
नायट्रिक अम्ल |
ॲसिटिक अम्ल |
ॲसिटिल नायट्रेट |
या मिश्रणाचा उपयोग करून हेक्झॅमिथिलीन टेट्रामाइनापासून [(CH2)6N4] औद्योगिक प्रमाणावर सायक्लोट्रायमिथिलीन ट्रायनायट्रामाइन (CH2)3–(NNO2)3 हे महत्त्वाचे संयुग बनवितात.
नायट्रीकरणासाठी जेथे सौम्य परिस्थितीची आवश्यकता असते अशा ठिकाणी, उदा., फिनॉल व ॲनिसोल यांच्या नायट्रीकरणात नायट्रिक अम्ल व थोडे नायट्रस अम्ल यांचे मिश्रण उपयोगी पडते. येथे नायट्रिक व नायट्रस अम्ल यांच्या विक्रियेने नायट्रोसोनियम आयन NO+ तयार होतात व त्यांच्या विक्रियेने प्रथम नायट्रोसोनियम संयुगे बनतात.नंतर नायट्रिक अम्लाने त्यांचे नायट्रो संयुगांत रूपांतर होते व नायट्रस अम्ल पुन्हा तयार होते.
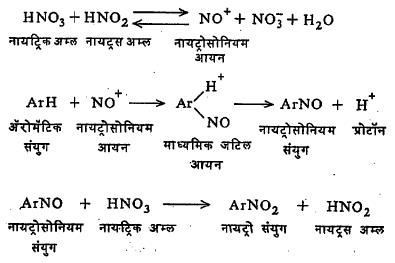
नायट्रीकरण होते तेव्हा संयुगाची नायट्रोनियम आयनाबरोबर विक्रिया होऊन प्रथम एक अस्थिर जटिल रेणू बनतो. त्याचे विघटन HSO4 – व NO3– यांच्या उपस्थितीत त्वरेने होते एक प्रोटॉन H+ बाहेर पडतो व नायट्रो संयुग बनते.
मुक्तमूलक यंत्रणा : पॅराफिने, सायक्लोपॅराफिने व ओलेफिने यांचे नायट्रीकरण या यंत्रणेने होते. ही (अ) बाष्पप्रावस्था व (आ) द्रवप्रावस्था या दोन प्रकारे घडून येते.
(अ) बाष्पप्रावस्था प्रक्रिया : बाष्पप्रावस्था नायट्रीकरणासाठी उच्च तापमान व कमी दाब वापरला जातो. नायट्रिक अम्ल नायट्रीकारक असेल तेव्हा तापमान ४००° से. च्या जवळपास व नायट्रोजन डाय-ऑक्साइड असेल, तर २००° ते ४५०° से. या मर्यादेत ठेवतात. कमी तापमानास पुरेसे नायट्रीकरण होण्यासाठी विक्रियेचा कालावधी काही मिनिटांचा असतो. उच्च तापमानास विक्रिया अल्पावधीत (काही सेकंदांत) घडून येते पण सहविक्रियाही (मुख्य विक्रियेशिवाय त्याच वेळी होणाऱ्या इतर विक्रिया) होतात व इतर आनुषंगिक पदार्थही बनतात. या विक्रिया फार ऊष्मादायी (उष्णता उत्पन्न करणाऱ्या) व स्फोटक असतात. त्यामुळे तापमान-नियंत्रण फार काळजीपूर्वक करावे लागते. या नायट्रीकरण प्रकारात हायड्रोकार्बनातील हायड्रोजनाचे नायट्रो गटाने प्रतिष्ठापन होतेच पण त्याचबरोबर संयुगातील C–C बंधही भंग पावतात. त्यामुळे नायट्रीकरणाने मिळणाऱ्या अंतिम मिश्रणात मूळ हायड्रोकार्बनातील रेणूत असलेल्या कार्बन अणूपेक्षा कमी कार्बन अणू असलेल्या हायड्रोकार्बनांची नायट्रो संयुगेही असतात. उदा., प्रोपेनाच्या नायट्रीकरणात १ –नायट्रोप्रोपेन व २ –नायट्रोप्रोपेन यांच्याबरोबरच नायट्रोएथेन व नायट्रोमिथेन ही संयुगेही बनतात. तापमान कमी असले, तर C-C बंध भंग पावण्याचे प्रमाण कमी असते.
नायट्रिक अम्ल वापरलेल्या प्रक्रियेत नायट्रो संयुगांशिवाय आल्डिहाइडे, कार्बन मोनॉक्साइड, कार्बन डाय-ऑक्साइड, ओलेफिने, अल्कोहॉले व कीटोने हे उपपदार्थ म्हणून निर्माण होतात.
सामान्यतः वापरलेल्या नायट्रिक अम्लापैकी निम्म्यापेक्षा कमी अम्लाचा विनियोग नायट्रीकरणासाठी होतो व राहिलेल्या अम्लापासून नायट्रिक ऑक्साइड, नायट्रोजन डाय-ऑक्साइड, नायट्रस ऑक्साइड, आणि नायट्रोजन ही द्रव्ये बनतात. नायट्रिक ऑक्साइड आणि नायट्रोजन डाय-ऑक्साइड परत मिळवून पुन्हा त्यांपासून नायट्रिक अम्ल बनवितात.
(आ) द्रवप्रावस्था नायट्रीकरण : यासाठी नायट्रिक व सल्फ्यूरिक अम्ल यांचे मिश्रण उपयोगी पडत नाही. नायट्रिक अम्ल १००° ते २००° से. तापमान आणि विक्रिया मिश्रणाचे घटक द्रवावस्थेत रहातील इतका दाब वापरावा लागतो. नायट्रिक ऑक्साइड व नायट्रोजन हे उपपदार्थ येथे निर्माण होतात व ते द्रवावस्थेत रहावेत यासाठी उच्च दाबाची आवश्यकता असते. आवश्यक असणारा दाब वापरलेल्या पॅराफिनाच्या बाष्पनशीलतेवरही (वाफ होण्याच्या प्रवृतीवरही) अवलंबून असतो. पॅराफीन जास्त बाष्पनशील असेल, तर दाब जास्त लागतो.
औद्योगिक नायट्रीकरण : पूर्वी हे खंडित प्रक्रियेने (प्रक्रियेस घेतलेल्या पदार्थावर एक विक्रिया पूर्ण करून नंतर दुसरी याप्रमाणे करून प्रक्रिया पूर्ण करण्याच्या रीतीने) करीत असत. त्यानंतर अखंडित (एकापाठोपाठ विक्रिया सतत चालू ठेवण्याची) प्रक्रिया प्रचारात आली. तथापि आजकाल खंडित प्रक्रिया मुळीच वापरीत नाहीत असे नाही, कारण दोन्हीमध्ये पुढे दिल्याप्रमाणे काही फायदे व काही तोटे आहेत.
खंडित प्रक्रियेसाठी लागणारी साधनसामग्री केवळ ठराविक नायट्रीकरण करण्यासाठी म्हणून विशेष प्रकारची रचना असलेली नसते. त्यामुळे ती निरनिराळ्या पदार्थांवर नायट्रीकरण प्रक्रिया घडविण्यासाठी किंवा प्रसंगी इतर प्रक्रिया करण्यासाठीही उपयोगी पडू शकते. विक्रियेत फेरबदल करून चाचणीसाठी विक्रिया करून पाहणे तसेच लहान प्रमाणावर केलेल्या प्रयोगांचे निष्कर्ष मोठ्या प्रमाणावर पडताळून पाहणे खंडित प्रक्रियेने जास्त सोयीचे असते. अखंडित प्रक्रियेच्या पूर्वतयारीसाठीही खंडित प्रक्रियेचा उपयोग होतो.
काही विवक्षित प्रमाणात उत्पादन मिळावे या दृष्टीने तुलना केली, तर खंडित प्रक्रियेच्या मानाने अखंडित प्रक्रियेला लागणारी साधनसामग्री आकारमानाने लहान असते. हा एक फायदा आहे कारण त्यामुळे तिच्या बनावटीसाठी जास्त टिकाऊ पण महाग मिश्रधातू इ. द्रव्ये वापरता येतात. येथे रासायनिक विक्रिया क्रमाक्रमाने थोडथोड्या पदार्थांवर होत असतात त्यामुळे विक्रिया अनियंत्रित होऊन स्फोट होण्याचा धोका कमी असतो. अखंडित प्रक्रियेला मनुष्यबळही कमी लागते.
साधससामग्री : (अ) खंडित प्रक्रिया : या प्रक्रियेसाठी वापरतात ते पात्र उभे आणि दंडगोलाकार असून ते बिडाचे किंवा मृदू कार्बन पोलादाचे केलेले असते. विक्रिया घटक आत सोडण्यासाठी प्रवेश मार्ग व तयार झालेला पदार्थ काढून घेण्यासाठी निर्गममार्ग त्यात ठेवलेले असतात. यांशिवाय विक्रिया अनियंत्रित होऊ लागली, तर धोका टळावा म्हणून पात्रातील विक्रिया मिश्रण त्वरेने भरपूर पाण्यात बुडवून टाकता येईल यासाठीही मोठे तोंड ठेवलेले असते.
विक्रिया मिश्रण जरूरीप्रमाणे थंड करता यावे म्हणून शीतनकारी नळ्यांच्या वलयांची दंडगोलाकार रचना करून ती पात्रात बसविलेली असते. या रचनेच्या मध्यभागी येईल अशा तऱ्हेने मिश्रण ढवळण्यासाठी एक फिरता उभा दांडा असून त्याला आडवे बाहू जोडलेले असतात. त्यामुळे दांडा फिरविला म्हणजे विक्रिया घटक एकमेकांत मिसळून सर्वत्र सारख्या प्रमाणात राहू शकतात आणि विक्रियेत उत्पन्न झालेली उष्णता एकाच ठिकाणी न राहता सर्वत्र पसरली जाते.
शीतनासाठी असलेल्या नळ्यांतून थंड केलेले पाणी किंवा मिठाचे पाणी खेळविण्याची योजना असते. मिश्रण गरम करण्याची आवश्यकता भासली, तर यांच नळ्यांतून गरम पाणी किंवा पाण्याची वाफही प्रवाहित करता येते.
विक्रिया चालू असताना विक्रिया मिश्रणाच्या वरच्या मोकळ्या जागेत जमणारी नायट्रोजनाची ऑक्साइडे, बाष्परूप अम्ल इ. पदार्थ ओढून घेता यावेत म्हणून वातशोषक नळ पात्राच्या वरच्या भागात बसविलेला असतो.
(आ) अखंडित प्रक्रिया : खंडित प्रक्रियेसाठी वापरतात तशाच तऱ्हेचे पात्र येथेही उपयोगी पडते. तथापि विक्रिया होताना बनणारे पदार्थ जसजसे तयार होतील तसतसे सतत बाहेर काढता यावेत आणि विक्रिया घटकांचा पुरवठा सतत होत रहावा म्हणून येथे योजना केलेली असते. पात्राच्या आतील भाग खाचखळगे नसलेला व अत्यंत गुळगुळीत केलेला असावा लागतो. हेतू हा की, पात्रातील नायट्रो संयुग सर्वच्या सर्व काढून घेता यावे आणि सांदीकोपऱ्यात ते अडकून राहून स्फोटाचे भय राहू नये.
सुरक्षिततेसाठी घ्यावयाच्या खबरदारीचे स्वरूप दोन्ही प्रक्रियांत सारखेच असते. अखंडित प्रक्रिया पात्रात त्यासाठी स्वयंचलीत यंत्रणा असते एवढाच फरक. पात्रातील विक्रिया मिश्रणाचे तापमान मर्यादेबाहेर जाऊ लागले, शीतन द्रव प्रवाह बंद पडला किंवा ढवळणे अकस्मात थांबले, तर विक्रिया घटकांचा होणारा पुरवठा आपोआप बंद पडावा अशी योजना केलेली असते व त्यासाठी पात्रातील मिश्रणाच्या तापमानाचे सतत निरीक्षण करण्यात येते.
नायट्रीकरण ही एक महत्वाची रासायनिक प्रक्रिया आहे. हिच्या साहाय्याने मिळणाऱ्या विविध नायट्रो संयुगांचा उपयोग स्फोटक द्रव्ये, कृत्रिम रंग, कृत्रिम तंतू, औषधे यांसाठी लागणारी कित्येक रसायने विद्रावक (विरघळविणारे पदार्थ) आणि कृत्रिम सुगंधी पदार्थ यांमध्ये होतो.
पहा : नायट्रोग्लिसरीन नायट्रोबेंझीन.
संदर्भ : 1. Groggins, P. H. Unit Processes in organic Synthesis, New York, 1958.
2. Topchiev, A. V. Trans. Matthews, C. Nitration ofHydrocarbons and other Compounds, Oxford, 1959.
केकरे, जी. शि.
“