मृद्–खनिजे : दोन वा तीन स्तरी स्फटिकरचना असलेल्या सजल सिलिकेटी, सूक्ष्मकणी खनिजांचा गट. १९१०–२० या दशकात क्ष-किरण विवर्तनाचे तंत्र [विशेषेकरून स्फटिकांद्वारे क्ष-किरणांचे प्रकीर्णन-विखुरले जाण्याची क्रिया-होऊन व्यतिकरण परिणामांमुळे त्यांच्या तीव्रतेत होणाऱ्या बदलांवर आधारलेले तंत्र → क्ष-किरण] विकसित झाले. नंतरच्या काही वर्षांत सुधारलेल्या सूक्ष्मदर्शकीय व ऊष्मीय पद्धती पुढे आल्या. या सर्वांच्या साहाय्याने मृत्तिका या काही थोड्या स्फटिकी खनिजांची जटिल (गुंतागुंतीची) मिश्रणे असल्याचे निश्चितपणे कळू आले. या खनिजांनाच ‘मृद्-खनिजे’ म्हणण्यात येऊ लागले. केओलिनाइट, माँटमोरिलोनाइट, अटापुलगाइट, हॅलॉयसाइट, इलाइट, क्लोराइट, व्हर्मिक्युलाइट ही काही मृद-खनिजे आहेत. मृत्तिकांचे वैशिष्ट्यपूर्ण गुणधर्म त्यांच्यातील मृद्-खनिजांमुळे आलेले असतात. त्यामुळे मृद्-खनिजांचा आढळ, उत्पत्ती व उपयोग यांविषयीच्या अधिक माहितीसाठी ‘मृत्तिका’ ही नोंद पहावी.
मृद्-खनिजांचे स्फटिक व कण अतिशय सूक्ष्म असल्याने क्ष-किरणांनी परीक्षण करण्यापूर्वी त्यांचे स्वरूप निश्चित समजले नव्हते. क्ष-किरणांच्या साहाय्याने केलेल्या विश्लेषणांतून मृत्तिकांच्या संघटनाप्रमाणेच मृद्-खनिजांच्या अंतर्गत आणवीय संरचनांची व थोड्या प्रमाणात त्यांच्या रासायनिक संघटनाविषयी (रा. सं. विषयी) माहिती मिळाली. पुढे ⇨ इलेक्ट्रॉन सूक्ष्मदर्शकाने त्यांचे परीक्षण केल्यावर त्यांचे आकार व आकारमान यांविषयी अचूक कल्पना आली.
रासायनिक संघटन : मृद्-खनिजे ही सजल ॲल्युमिनियम सिलिकेटे आहेत. म्हणजे ती मुख्यत्वे सिलिकॉन, ॲल्युमिनियम व पाणी यांच्या संयुगांची बनलेली असतात, असे म्हणता येते. कधीकधी याच्यातील सिलिकॉन व ॲल्युमिनियम या मूलद्रव्यांच्या जागी अंशतः वा पूर्णपणे लोह व मॅग्नेशियम आलेले असते. शिवाय मृद्-खनिजांत अल्प प्रमाणात क्षारीय धातू व क्षारीय मृत्तिका (बेरियम, कॅल्शियम, स्ट्राँशियम इ. धातू वा त्यांची ऑक्साइडे) सुद्धा असतात.
आणवीय संरचना : मृद्-खनिजांची दोन मुख्य आणवीय संरचनात्मक एकके असून ती जोडली जाऊन स्फटिक बनलेले असतात. यांपैकी एक एकक सिलिकेच्या चतुष्फलकाचे (SiO4) बनलेले असून त्याच्या मध्याशी सिलिकॉनाचा अणू असतो व या अणूपासून समान अंतरावर म्हणजे चतुष्फलकाच्या चार टोकांवर ऑक्सिजनाचे अणू अथवा हायड्रॉक्सिल (OH–) आयन (विद्युत् भारित अणुगट) असतात. सिलिकेच्या प्रत्येक चतुष्फलकांतील चारपैकी तीन ऑक्सिजन अणू हे शेजारच्या अशाच तीन चतुष्फलकांना जोडला गेलेला असतो. अशा तऱ्हेने सिलिकेचे चतुष्फलक एकमेकांना जोडले जाऊन एक जाळे बनते. ते षट्कोणी असल्यासारखे दिसते. अशी असंख्य भासमान षट्कोणी जाळी दोन दिशांना वाढत जाऊन मृद्-खनिजाचे एक पत्रक तयार होते. या पत्रकाला सिलिका पत्रक (वा स्तर), चतुष्फलकीय स्तर किंवा क्वचित सिलोक्सेन पत्रक असे म्हणतात (आ.१).
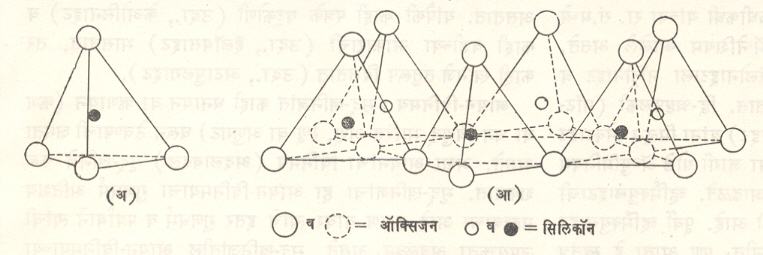 या पत्रकातील सिलिकॉन व ऑक्सिजन यांचे प्रमाण २ : ५ असून पत्रकाचे रा.सं. Si4O6(OH)4 असे असते. या पत्रकातील सर्व चतुष्फलकांची टोके एकाच दिशेला व त्यांची आधारतले (पाये) एकाच पातळीत असतात. यामुळे अश पत्रकाचे समग्र स्वरूप पुढीलप्रमाणे असते : (१)आधारतल ऑक्सिजनाच्या अणूंचे बनलेले असून या अणूंमध्ये मोकळी जागा असते (२) मधल्या प्रतलात (पातळीत) सिलिकॉनाचे अणू असून त्यांची रचना षट्कोणी जाळ्याप्रमाणे झालेली असते आणि (३) तिसऱ्या प्रतलात हायड्रॉक्सिल आयन असतात आणि ते चतुष्फलकांच्या टोकांवर व सिलिकॉनाच्या अणूंच्या नेमके वर असतात. अशा रीतीने चतुष्फलक एकमेकांस जोडले जाऊन मृद्-खनिजाच्या आणवीय संरचनात्मक एककाचे जे पत्रक तयार होते, त्याची जाडी ४·९३ Å एवढी असते (१ अँगस्ट्राम् Å =१०–१० मी.).
या पत्रकातील सिलिकॉन व ऑक्सिजन यांचे प्रमाण २ : ५ असून पत्रकाचे रा.सं. Si4O6(OH)4 असे असते. या पत्रकातील सर्व चतुष्फलकांची टोके एकाच दिशेला व त्यांची आधारतले (पाये) एकाच पातळीत असतात. यामुळे अश पत्रकाचे समग्र स्वरूप पुढीलप्रमाणे असते : (१)आधारतल ऑक्सिजनाच्या अणूंचे बनलेले असून या अणूंमध्ये मोकळी जागा असते (२) मधल्या प्रतलात (पातळीत) सिलिकॉनाचे अणू असून त्यांची रचना षट्कोणी जाळ्याप्रमाणे झालेली असते आणि (३) तिसऱ्या प्रतलात हायड्रॉक्सिल आयन असतात आणि ते चतुष्फलकांच्या टोकांवर व सिलिकॉनाच्या अणूंच्या नेमके वर असतात. अशा रीतीने चतुष्फलक एकमेकांस जोडले जाऊन मृद्-खनिजाच्या आणवीय संरचनात्मक एककाचे जे पत्रक तयार होते, त्याची जाडी ४·९३ Å एवढी असते (१ अँगस्ट्राम् Å =१०–१० मी.).
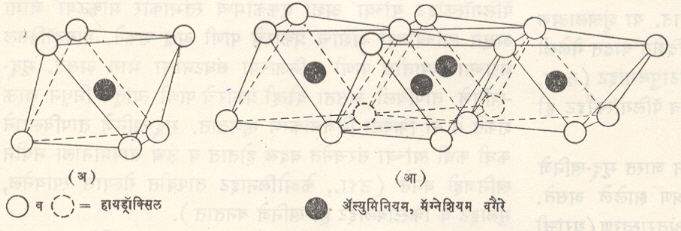 ऑक्सिजनाचे अणू अथवा हायड्रॉक्सिल आयन यांच्या दाट जुळणीमध्ये अष्टफलकीय साचा तयार होईल अशा रीतीने ॲल्युमिनियम, लोह किंवा मॅग्नेशियम अणू गुंफले जाऊन मृद्-खनिजातील आणवीय संरचनेचे दुसरे एकक तयार होते. अष्टफलकाच्या मध्याशी ॲल्युमिनियम, लोह किंवा मॅग्नेशियमाचे अणू असतात व त्याच्या टोकांशी ऑक्सिजनाचे अणू वा हायड्रॉक्सिल आयन असतात (आ.२). एककांच्या जुळणीमध्ये ॲल्युमिनियमाचे अणू असताना एकूण संरचना संतुलित होण्यासाठी अष्टफलकातील संभाव्य जागांपैकी २/३ जागाच भरलेल्या व बाकीच्या रिकाम्या असतात. त्यामुळे Al2(OH)6 हे संघटन असणाऱ्या गिब्साइटाची संरचना द्वि-अष्टफलकी होते. उलट या एककांच्या जुळणीत मॅग्नेशियमाचे अणू असताना अष्टफलकातील सर्व संभाव्य जागा व्यापलेल्या असतात आणि Mg3(OH)6 या संघटनाच्या ब्रूसाइटाची संरचना त्रि-अष्टफलकी होते. असे असंख्य अष्टफलक एकमेकांना जोडले जाऊन बनलेल्या एकक पत्रकाची जाडी ५·०५Åइतकी असते.
ऑक्सिजनाचे अणू अथवा हायड्रॉक्सिल आयन यांच्या दाट जुळणीमध्ये अष्टफलकीय साचा तयार होईल अशा रीतीने ॲल्युमिनियम, लोह किंवा मॅग्नेशियम अणू गुंफले जाऊन मृद्-खनिजातील आणवीय संरचनेचे दुसरे एकक तयार होते. अष्टफलकाच्या मध्याशी ॲल्युमिनियम, लोह किंवा मॅग्नेशियमाचे अणू असतात व त्याच्या टोकांशी ऑक्सिजनाचे अणू वा हायड्रॉक्सिल आयन असतात (आ.२). एककांच्या जुळणीमध्ये ॲल्युमिनियमाचे अणू असताना एकूण संरचना संतुलित होण्यासाठी अष्टफलकातील संभाव्य जागांपैकी २/३ जागाच भरलेल्या व बाकीच्या रिकाम्या असतात. त्यामुळे Al2(OH)6 हे संघटन असणाऱ्या गिब्साइटाची संरचना द्वि-अष्टफलकी होते. उलट या एककांच्या जुळणीत मॅग्नेशियमाचे अणू असताना अष्टफलकातील सर्व संभाव्य जागा व्यापलेल्या असतात आणि Mg3(OH)6 या संघटनाच्या ब्रूसाइटाची संरचना त्रि-अष्टफलकी होते. असे असंख्य अष्टफलक एकमेकांना जोडले जाऊन बनलेल्या एकक पत्रकाची जाडी ५·०५Åइतकी असते.
वरील मूलक (एकक) संरचनात्मक पत्रके एकाआड एक रचली जाऊन निरनिराळी मृद्-खनिजे बनलेली असतात. काही मृद्-खनिजांत पहिल्या व दुसऱ्या प्रकारची पत्रके एकाआड एक, तर इतर काहींत एकाचे एक व दुसऱ्याची दोन वा अधिक पत्रके एकाआड एक रचलेली असतात. [→ स्फटिकविज्ञान].
वर्गीकरण : कित्येक मृद्-खनिजांचे गुणधर्म इतके सारखे असतात की, ती वेगळी करणे व वेगळी ओळखणे अवघड असते. त्यामुळे त्यांचे काटेकोरपणे वर्गीकरण करणे शक्य होत नाही म्हणून विविध प्रकारच्या तपशीलांना अनुसरून त्यांची अनेक वर्गीकरणे करण्यात आली आहेत. सर्वसाधारणपणे वापरात असलेले आणि आणवीय संरचना व रा.सं. मधील फरक यांच्यावर आधारलेले एक वर्गीकरण पुढे दिले आहे. यामध्ये अस्फिटिकी व स्फटिकी असे दोन मुख्य प्रकार असून अस्फटिकी प्रकारात फक्त ॲलोफेन गट येतो. इतर खजिन गट स्फटिकी असून आणवीय संरचनेनुसार त्यांची वर्गवारी केली आहे.
ॲलोफेन गट : सजल ॲल्युमिनियम सिलिकेटयुक्त मृत्तिकांचे अध्ययन करताना त्यांच्यातील अस्फटिकी वाटलेल्या अकार्बनी घटकांना सुरुवातीच्या काळात ॲलोफेन हे नाव देण्यात आले. क्ष-किरणांच्या साहाय्याने परीक्षण केल्यावरही मृत्तिकांमध्ये बरेच अल्प अस्फटिकी घटक असल्याचे आढळले व तेव्हा अशा घटकांसाठी हे नाव योग्य होते. मात्र इलेक्ट्रॉन सूक्ष्मदर्शकाने केलेल्या परीक्षणात यांच्यापैकी कित्येक पदार्थ स्फटिकी असल्याचे दिसून आले. तथापि क्ष-किरण परीक्षणात मृत्तिकांमधील जे घटक अस्फटिकी वाटतात, त्यांना ॲलोफेन म्हणण्याची रूढी पडून गेली आहे. हे घटक विरल हायड्रोक्लोरिक अम्लात (अम्लाचे प्रमाण कमी असणाऱ्या विद्रावात) विरघळतात. हे विरळाच आढळतात व मृद्-खनिजांच्या दृष्टीने हे विशेष महत्त्वाचे नाहीत.
दोन स्तरयुक्त : याच्या पत्रकात एक थर सिलिकेच्या चतुष्फलकांचा आणि एक थर ॲल्युमिन्याच्या (ॲल्युमिनियमाच्या ऑक्साइडाच्या) चतुष्फलकांचा असतो. यांचे सम परिमाणी व लांबट असे प्रकार होतात. सम परिमाणी प्रकारात केओलिनाइट गटाची तर लांबट प्रकारात हॅलॉयसाइट गटाची खनिजे येतात.
केओलिनाइट गट : [Al4Si4O10 (OH)8]. केओलिनाइट, नॅक्राइट व डिकाइट ही यातील खनिजे असून त्यांचे रा. सं. सारखे असले तरी, स्फटिकरचना भिन्न आहेत. पूर्वी ॲनॉक्साइट हे यातील स्वतंत्र खनिज असल्याचे मानले जाई परंतु ते केओलिनाइट आणि क्वॉर्ट्झ यांचे साधे मिश्रण असल्याचे दिसून आले आहे.
हॅलॉयसाइट गट : [Al4Si4O10 (OH)8.2H2O]. यांचे रा.सं. काहीसे केओलिनाइटासारखे असले, तरी यांची आणवीय संरचना वेगळी आहे. हॅलॉयसाइटाच्या ताज्या पृष्ठाची चमक काचेसारखी असते. हॅलॉयसाइटाचे दोन प्रकार असून एका प्रकारामध्ये पाण्याच्या रेणूंची संख्या दोन, तर दुसऱ्यात ती चार असते. यांतील अधिक सजल म्हणजे दुसऱ्या प्रकाराला काहींनी एंडेलाइट हे नाव दिले आहे.
तीन स्तरयुक्त : यांच्यात दोन थर सिलिकेच्या चतुष्फलकांचे असून मधला थर द्वि-अष्टफलकांचा अथवा त्रि-अष्टफलकांचा असतो. यांच्या प्रसरण पावणारी (पाणी शोषले जाऊन फुगणारी) व प्रसरण न पावणारी अशा दोन संरचना असून प्रसरण पावणाऱ्यांचे सम परिणामी व लांबट असे प्रकार होतात. सम परिणामी प्रकारात माँटमोरिलोनाइट, सॉकोनाइट, व्हर्मिक्युलाइट, तर लांबट प्रकारात नाँट्रोनाइट सॅपोनाइट, बायडेलाइट, हेक्टोराइट ही खनिजे येतात. प्रसरण न पावणारी संरचना सजल अभ्रकासारखा प्रकार असून त्यात इलाइट गटाची खनिजे येतात.
माँटमोरिलोनाइट गट : [Al4Si8O20(OH)4.nH2O]. यांच्या संरचनात्मक एककांच्या थरांमध्ये पाण्याचे अधिशोषण (पृष्ठभागी शोषले जाण्याची क्रिया) होत असल्याने यांच्या अंगी प्रसरणशीलता हा महत्त्वाचा गुणधर्म आलेला असतो. कधीकधी यांच्या रा.सं.मध्ये ॲल्युमिनियमाच्या जागी लोह अथवा मॅग्नेशियम आलेले असते. अशा तऱ्हेने बनलेल्या लोहयुक्त माँटमोरिलोनाइटाला नाँट्रोनाइट व मॅग्नेशियमयुक्त प्रकाराला सॅपोनाइट म्हणतात. द्वि-अष्टफलकी (माँटमोरिलोनाइट) व त्रि-अष्टफलकी (सॅपोनाइट) यांना मिळून स्मेक्टाइट म्हणतात. बायडेलाइटामध्ये सिलिकॉनाच्या जागी थोडे ॲल्युमिनियम आलेले असते व हे पातळ पत्ररूपात आढळते. व्हर्मिक्युलाइटाची प्रसरणशीलता माँटमोरिलोनाइटापेक्षा कमी आहे. पूर्वी व्हर्मिक्युलाइट अभ्रकाशी संबंधित असलेले खनिज मानीत पण आता हे स्वतंत्र मृद्-खनिज मानतात.
इलाइट गट : [K7Al4(Si8-yAly)O20(OH)4]. इलाइट सजल अभ्रकासारखे आहे पण प्रसरणशील नाही. याच्या आणवीय संरचना एककांच्या थरांमध्ये १०Åएवढे अंतर असते. यांचे द्वि-अष्टफलकीय व त्रि-अष्टफलकीय असे दोन प्रकार आहेत.
नियमित मिश्र स्तरयुक्त :क्लोराइट गटाच्या खनिजांचा यात समावेश होतो. यांच्यामध्ये संरचनात्मक एककांचे भिन्न प्रकारचे थर नियमितपणे एकाआड एक रचलेले असतात.
क्लोराइट गट : ही मृद्-खनिजे लोह व मॅग्नेशियमयुक्त असून यांचे अभ्रकाशी बरेच साम्य आहे. त्यांच्यात कृष्णाभ्रक व ब्रूसाइट यांच्या संरचनात्मक एककांचे स्तर एकाआड एक रचलेले असतात.
साखळीसारख्या संरचनेची : यांची संरचना अँफिबोलांच्या संरचंनेप्रमाणे असते म्हणजे सिलिकेच्या चतुष्फलकांच्या शृंखला बनलेल्या असून अशा दोन शृंखला ॲल्युमिनियम किंवा/आणि मॅग्नेशियम यांच्या अणूंची एकमेकींस जोडल्या गेलेल्या असतात. या शृंखलात्मक एककाचे संघटन Si4O11 असते व शृंखला एकाच दिशेत वाढत गेलेली आढळते. या संरचनेची रुंदी ११·५Åअसते. अटापुलगाइट (सूक्ष्म, कांडीरूप), सेपिओलाइट (लांबट नलिकाकार) व पॅलिगॉर्स्काइट ही तंतुरूप खनिजे यांत येतात.
संमिश्र स्तरयुक्त : पुष्कळ मृत्तिकांत एकाहून जास्त मृद्-खनिजे आढळतात. बऱ्याचदा या खनिजांचे साधे मिश्रण झालेले असते. काही वेळा मात्र वेगवेगळ्या खनिजांच्या स्तरांचे अंतरास्तरण (थरांची सरमिसळ) झाल्याने संमिश्र संरचना निर्माण होते. संमिश्र स्तरांतील खनिजांची आणवीय संरचना एकसारखी असल्याने अंतरास्तरण होऊ शकते. एका बाबतीत स्फटिकाच्या सी-अक्षाच्या [→स्फटिकविज्ञान] दिशेत नियमित स्वरूपाचे अंतरास्तरण म्हणजे थरांची एकाआड एक अशी पुनरावृत्ती झालेली असते. दुसऱ्या बाबतीत असे भिन्न भिन्न स्तरांचे यदृच्छया वा अनियमितपणे अंतरास्तरण झालेले असते. पुष्कळ वेळा माँटमोरिलोनाइट व इलाइट, तसेच क्लोराइट व व्हर्मिक्युलाइट या खनिज जोड्यांचे अंतरास्तरण झालेले आढळते.
गुणधर्म : मृद्-खनिजांचे स्फटिक अतिसूक्ष्म आकारमानाचे असतात आणि या आकारमानामुळेच मृद्-खनिजांना त्यांचे बहुतेक वैशिष्ट्यदर्शक गुणधर्म प्राप्त झालेले असतात. मृद्-खनिजांना विविध प्रकारच्या उद्योगधंद्यांमध्ये उपयोग करून घेताना त्यांचे हे गुणधर्म महत्त्वाचे ठरतात.
आकार व आकारमान : मृद्-खनिजांचे कण अतिसूक्ष्म असल्याने त्यांचे आकार व आकारमान ठरविण्यासाठी इलेक्ट्रॉन सूक्ष्मदर्शकाचा वापर करावा लागतो. कारण या सूक्ष्मदर्शकाने त्यांचे पंधरा हजारपट वर्धन करता येऊ शकते व नंतर छायाचित्रणाद्वारे आणखी कित्येक पट वर्धन करता येते. अशा परीक्षणात हे कण ०·००२ मिमी. आकारमानाचे असल्याचे दिसून आले आहे. यांच्या आणवीय संरचनेतील एकक प्रतलाकार (चापट) असल्याने बहुतेक मृद्-खनिजे पत्रकाकार असतात. यांपैकी काही पत्रके षट्कोणी (उदा., केओलिनाइट) व काही वडीच्या आकाराची (उदा., हॅलॉयसाइट) भासतात, तर काही खनिजे तंतुरूप दिसतात (उदा., अटापुलगाइट).
आयन-विनिमय : मृद्-खनिजांत काही धनायन वा ऋणायन (ऋण वा धन विद्युत् भारित अणू, रेणू वा अणुगट) धरून ठेवण्याची क्षमता असते. अशा आयनांचा विनिमय (अदलाबदल) मृद्-खनिजे करू शकतात. मृद्-खनिजांचा हा आयन-विनिमयाचा गुणधर्म अतिशय महत्त्वाचा आहे कारण यावर त्यांचे इतर गुणधर्म व पर्यायाने त्यांची उपयुक्तता अवलंबून असते. मृद्-खनिजांतील आयन-विनिमयाच्या दृष्टीने कॅल्शियम, पोटॅशियम, अमोनियम व सोडियम हे ऋणायन आणि सल्फेट, क्लोराइट, फॉस्फेट आणि नायट्रेट हे धनायन महत्त्वाचे आहेत.
मृद् खनिजाचा प्रकार व आयन संहती यांच्यानुसार आयनविनिमयाची त्वरा (गती) ठरते. (उदा., केओलिनाइटाच्या बाबतीत आयन-विनिमयाची क्रिया तात्काळ, तर इलाइटाच्या बाबतीत काही तासांत व दिवसांतही पूर्ण होते).
मृद्-खनिजे व पाणी : मृद्-खनिजांमध्ये दोन प्रकारे पाणी अंतर्भूत झालेले असते. सर्वसाधारण तापमानाला व दाबाला अधिशोषणामुळे आलेले पाणी आणि संघटनातील हायड्रॉक्सिल गटाच्या रूपातील पाणी मृद्-खनिजात असू शकते. अधिशोषित पाणी मृद्-खनिजातील छिद्रांत, त्याच्या कणांच्या पृष्ठभागी, कडांवर व कोपऱ्यात असते. काही मृद्-खनिजांच्या आणवीय संरचनेतील एककांच्या थरांमध्ये म्हणजे अंतरास्तरित पाणी असते. अटापुलगाइट, सेपिओलाइट व पॅलिगॉर्स्काइट यांच्या अशा एककांमध्ये स्तंभाकार मोकळ्या जागा असून त्यांच्यातही अशाच प्रकारचे पाणी असू शकते. हायड्रॉक्सिल गटाच्या रूपातील पाणी खनिजाच्या संघटनाचा भाग असते. मृद्-खनिजे तापविली असता दोन्ही प्रकारचे पाणी त्यांतून निघून जाऊ शकते व या क्रियेला निर्जलीकरण म्हणतात. मृद्-खनिजे तापविल्याने कधी कधी त्यांच्या संरचनेत बदल होतात व उच्च तापमानाला नवीन खनिजही बनते (उदा., केओलिनाइट तापवीत गेल्यास स्पायनेल, मुलाइट व क्रिस्टोबलाइट ही खनिजे बनतात).
मृद्-खनिजे व कार्बनी द्रव्य : मृद्-खनिजांतील कार्बनी द्रव्य कणमय वा त्यांच्याशी विक्रिया होऊन बनलेल्या संयुगांच्या रूपात असते. मृद्-खनिजांची कार्बनी पदार्थांशी विक्रिया होऊ शकते, तसेच ती कार्बनी द्रव्याचे शोषण व अधिशोषण करू शकतात. यामुळे कार्बनी पदार्थाचे अपघटन (मोठ्या रेणूचे तुकडे होऊन लहान रेणू बनण्याची क्रिया) करण्यासाठी, तसेच तेले, चरबी, मेण वगैरेंचा रंग, अप्रिय वास व चव घालविण्यासाठी मृद्-खनिजे वापरतात. शिवाय कार्बनी द्रव्ययुक्त मृद्-खनिजे रंगलेप. शाई, प्लॅस्टिके इत्यादींच्या निर्मितीत उपयोगी ठरतात.
प्रकाशकीय गुणधर्म : मृद्-खनिजांचे कण अतिसूक्ष्म असून एकाच खनिजाच्या रा.सं. मध्ये नैसर्गिक रीतीनेच श्रेणीवत फरक झालेले आढळतात. शिवाय त्यांच्यातील एका अणूच्या जागी दुसरा येऊ शकतो व अंतरास्तरित पाण्याचे प्रमाण कमीजास्त असू शकते. या विविध कारणांमुळे त्यांच्या प्रकाशकीय गुणधर्मांत बदल होऊ शकतात. यामुळे त्यांच्या प्रकाशकीय गुणधर्मांचे परीक्षण करणे व ते निश्चित करणे अवघड असते.
विद्राव्यता : (विरघळण्याचे प्रमाण). मृद्-खनिजाची एखाद्या विद्रावामधील विद्राव्यता ही पुढील गोष्टींवर अवलंबून असते : विद्रावातील अम्लाचे (किंवा क्षाराचे म्हणजे अम्लाशी विक्रिया झाल्यास लवण देणाऱ्या पदार्थांचे) प्रमाण व स्वरूप, त्यांचे मृद्-खनिजाशी असलेले गुणोत्तर, तसेच तापमान व काळ.
आढळ : मृद्-खनिजे सामान्यतः पत्र्या, रिपा आणि सूच्याकार स्फटिक यांच्या पुंजाच्या रूपात आढळतात. (उदा., केओलिनाइटाच्या पत्र्यांचे पुस्तकासारखे पुंज आढळतात). प्राचीन व अलीकडील अशा सर्व काळांत तयार झालेले गाळ, गाळाचे खडक, जलतापीय निक्षेप (गरम पाण्यातील विद्रावांची विक्रिया होऊन बनलेले साठे), वाळवंटे, लोएस व लिथोमार्ज यांसारखे निक्षेप, तांबड्या मृत्तिका वगैरेंमध्ये मृद्-खनिजे आढळतात. सर्व प्रकारच्या मृदांमध्येही ती आढळतात (उदा., पॉडझॉलमध्ये केओलिनाइट व चेर्नोसेममध्ये इलाइट). समुद्रतळ, जमीन, नदीमुख, सरोवरे येथे सध्या साचत असलेल्या गाळांत ही मृद्-खनिजे आढळतात. महासागरातील गाळात क्लोराइट आणि इलाइट तर मेक्सिकोच्या आखातात स्मेक्टाइट मोठ्या प्रमाणात आढळतात. लवणी परिस्थिती असलेल्या वाळवंटी भागात इलाइट, क्लोराइट, सेपिओलाइट आणि अटापुलगाइट आढळतात. उन्हाळी वा गायझरे (गरम पाण्याची नैसर्गिक कारंजी) यांच्यामुळे बदल झालेल्या, तसेच धातुक निक्षेपांभोवतीच्या (कच्च्या रूपातील धातूच्या साठ्यांभोवतीच्या) खडकांमध्ये अटापुलगाइटाशिवाय सर्व मृद्-खनिजे आढळली आहेत. अशा ठिकाणी उष्णतेच्या उद्गमालगत (उदा., उन्हाळे) अभ्रक व केओलिनाइट, तर त्यापासून दूर जाताना क्लोराइट व स्मेक्टाइट आढळतात. दगडी कोळशाच्या थरांमध्ये केओलिनाइट आणि इलाइट, लिथोमार्जमध्ये केओलिनाइट व हॅलॉयसाइट, तांबड्या मृत्तिकेत हॅलॉयसाइट तर बेंटोनाइटात माँटमोरिलोनाइट व बायडेलाइट आढळतात. नॅक्राइट व डिकाइट ही खनिजे विरळाच व धातुकांबरोबर आढळतात.
पुष्कळ शेल खडक मुख्यत्वे क्लोराइट व इलाइट यांचे बनलेले असून मध्यजीव महाकल्पाच्या (सु. २३ ते १५·५ कोटी वर्षांपूर्वीच्या कालखंडाच्या) आधीच्या काळातील अशा खडकांच्या मानाने तदनंतरच्या काळातील खडकांत सामान्यतः स्मेक्टाइट अधिक प्रमाणात आढळते. केओलिनाइट डेव्होनियननंतरचा (सु. ४० ते ३६·५ कोटी वर्षांपूर्वीच्या कालखंडानंतरच्या) खडकांत अधिक आढळते, तर याहून जुन्या खडकांत मुख्यत्वे इलाइट व क्लोराइट आढळतात. अटापुलगाइट व सेपिओलाइट ही खनिजे तृतीय कल्पानंतरच्या (सु. ६·५ ते १·२ कोटी वर्षांपूर्वीच्या कालखंडानंतरच्या) खडकांतच आढळली आहेत. पाटीच्या दगडांत व कार्बोनेटी खडकांत मुख्यत्वे इलाइट आणि क्लोराइट आणि काहींत केओलिनाइट आढळते. मात्र अलीकडच्या काळातील कार्बोनेटी खडकांत मुख्यत्वे स्मेक्टाइट व अटापुलगाइट आढळतात.
संश्लेषण व उत्पत्ती : प्रयोगशाळेत सर्वसाधारण ते उच्च तापमान व दाबाच्या परिस्थितींमध्ये पुष्कळ मृद्-खनिजे संश्लेषित करण्यात (कृत्रिम रीतीने बनविण्यात) आली आहेत. त्यावरून त्यांच्या निर्मितीविषयीचे पुढील सर्वसाधारण निष्कर्ष काढता येऊ शकतात. आणि मृद्-खनिजांच्या उत्पत्तीच्या दृष्टीने त्यांचा उपयोग करता येतो. ऑक्साइडे आणि हायड्रॉक्साइडे यांच्या मिश्रणांपासून बऱ्याच कमी तापमानाला व दाबाला बहुतेक मृद्-खनिजे निर्माण करता येतात. हॅलॉयसाइट हे याला अपवाद आहे. क्षार व क्षारीय मृत्तिका नसलेल्या ॲल्युमिना-सिलिका या ऑक्साइडांच्या प्रणालींमध्ये केओलिनाइट बनण्याची शक्यता अधिक असते. या प्रणालीत पोटॅशियमाची भर पडल्यास त्याच्या प्रमाणानुसार स्मेक्टाइट व क्लोराइट निर्माण होतात. वरील ऑक्साइडांचे सावकाश मिश्रण केल्यास व त्यांची संहती अगदी कमी असल्यास सर्वसामान्य तापमान व दाबाला मृद्-खनिजे बनू शकतात (उदा., अम्लीय स्थितीत केओलिनाइट व मॅग्नेशियमयुक्त क्षारीय स्थितीत माँटमोरिलोनाइट बनते). उच्च तापमानाच्या स्थितीमध्ये कोणते खनिज निर्माण होईल हे आयनांची संहती, तापमान व ॲल्युमिना/सिलिका गुणोत्तर यांच्यावर अवलंबून असते.
विविध प्रकारच्या खडकांवर वातावरणक्रिया वा कधीकधी जलतापीय क्रिया होऊन मृद्-खनिजे निर्माण होतात. मूळ खडकाचे स्वरूप, जलवायुमान (दीर्घकालीन सरासरी हवामान), भूमिस्वरूप, वनश्री व कालावधी यांच्यावर वातावरणक्रिया अवलंबून असल्याने मृद्-खनिजांच्या निर्मितीवरही या घटकांचा परिणाम होतो. उदा., शुष्क भागात तयार होणाऱ्या चेर्नोसेम या मृदेत इलाइट व कधीकधी क्लोराइट आणि स्मेक्टाइट ही खनिजे निर्माण होतात. कारण अशा भागात क्षार व क्षारीय मृत्तिका पाण्याबरोबर झिरपून खाली जाण्याची क्रिया विशेष प्रभावीपणे होत नाही आणि ती भूपृष्ठालगत राहिल्याने ही खनिजे बनण्यास अनुकूल परिस्थिती निर्माण होते. तसेच मॅग्नेशियमाचे प्रमाण जास्त असणाऱ्या अतिशुष्क भागात अटापुलगाइट निर्माण होऊ शकते. क्षार व क्षारीय मृत्तिकांचा प्रयोगशाळेतील खनिजनिर्मितीवर जसा परिणाम होतो, तसाच त्यांचा परिणाम जलतापीय क्रियांमध्येही होतो. मृद्-खनिजांच्या क्रियांचाही त्यांच्यावर परिणाम होतो. उदा., गोड्या पाण्यातून खाऱ्या पाण्यात जाताना स्मेक्टाइटात सागरी पाण्यातील पोटॅशियमाचे व मॅग्नेशियमाचे अधिशोषण होऊन अनुक्रमे इलाइट व क्लोराइट बनतात. गाळ साचताना, घट्ट होताना किंवा त्याचे रूपांतरण (दाब व तापमान यांच्यातील बदलांचा परिणाम होण्याची क्रिया) होतानाही मृद्-खनिजांमध्ये भौतिकीय व रासायनिक बदल होऊ शकतात.
फेल्स्पारे व ग्रॅनाइटासारखे खडक यांच्यावर वातावरणक्रिया किंवा उष्णवायुक्रिया (घट्ट होणाऱ्या शिलारसातून बाहेर पडणाऱ्या वायूंमुळे होणारी स्फटिकीभवनाची क्रिया) होऊन केओलिनाइट निर्माण होते तसेच शुभ्र अभ्रक व फेल्स्पार यांच्यावर वातावरणक्रिया किंवा जलतापीय क्रिया होऊन इलाइट बनते, तर तांबूस अभ्रकात बदल होऊन बायडेलाइट होते.
उपयोग : मृद्-खनिजांच्या वैशिष्ट्यपूर्ण गुणधर्मांमुळे त्यांचा अनेक उद्योगधंद्यांत विविध प्रकारच्या वस्तू बनविण्यासाठी व इतर प्रकारे उपयोग केला जातो. उदा., मातीची भांडी, उच्चतापसह (दीर्घकाळ उच्च तापमानाला न वितळता टिकून राहणारे) पदार्थ, वेधनासाठी (पाहणी व इतर कामाकरिता जमिनीत भोके पाडण्यासाठी) लागणारा चिखल, औषधे व सौंदर्यप्रसाधने, कागद, रबर, काच, खनिज तेलाचे परिष्करण वगैरे. शेतीच्या दृष्टीनेही मृद्-खनिजे महत्त्वाची असतात. उदा., मृदेत मध्यम प्रमाणात स्मेक्टाइट असणे शेतीला फायदेशीर असते मात्र त्याचे प्रमाण जास्त झाल्यास ते फायदेशीर ठरत नाही. तसेच इलाइट व क्लोराइट असलेल्या मृदा केओलिनाइटयुक्त मृदांपेक्षा शेतीला चांगल्या असतात.
पहा : मृण्मय खडक मृत्तिका मृत्तिका उद्योग मृदा.
संदर्भ : 1. Grim. R. E. Clay Mineralogy, New York, 1968.
2. Rich, C. L. Kunze, G. W. Soil Clay Mineralogy, Chapal Hill, N. C., 1964.
3. Swineford, A. Ed., Clay and Clay Minerals, Oxford, 1960.
4. Zviagin, B. B. Trans. Lyse, S., Electron Diffraction Analysis of Clay Minerals Structures, New York, 1967.
आगस्ते, र. पां. ठाकूर, अ. ना.
“